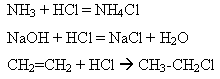Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сполуки неметалічних елементів ізГідрогеном
Сполуки неметалічних елементів ізГідрогеном складаються змолекул. Атоми в них сполучені ковалентними зв’язками. Фізичні властивості. Більшість сполук неметалічних елементів із Гідрогеном за звичайних умов є газами, а гідроген фторид HF(за температури нижче 19,5 °С) і вода — рідинами. Усі ці сполуки безбарвні; чимало їхможна виявити за характерним запахом —неприємним, іноді різким.Температури плавлення і кипіння сполукіз Гідрогеном неметалічних елементів кожної групи періодичної системи зростають зізбільшенням відносних молекулярних мас1. Проте сполуки елементів 2_го періоду вода, амоніак і фтороводень — «випадають»із цієї залежності. Аномально високі температури їх плавлення і кипіння зумовлені існуванням водневих зв’язків між молекулами. Вам відома аналогічна залежність для алканів С n H2 n +2. Найбільшу розчинність у воді мають сполуки галогенів із Гідрогеном та амоніак. Метан дуже слабо розчиняється у воді через неполярність молекул СН4, неможливість утворення ними водневих зв’язків і нездатність до дисоціації. Розчини сполук галогенів із Гідрогеном іСульфуру з Гідрогеном у воді виявляють властивості кислот. Досить полярні зв’язки Н– Е зумовлюють дисоціацію молекул цих сполуку водному розчині з утворенням катіонів Гідрогену: HCl↔H+ + Cl–; H2S↔H+ + HS–; HS–↔H+ + S2–. Водні розчини HCl, HBr і HI поводяться як сильні однооснoвні кислоти, HF — як кислота середньої сили, а H2S — як слабка двохоснoвна кислота. Хлороводень і хлороводнева кислота Фізичні властивості. Хлороводень — безбарвний газ із різким запахом, важчий за повітря, добре розчиннийу воді. За температури 20 °С і нормального тиску в 1 л води розчиняється 445 л цього газу. У вологому повітрі гідроген хлорид «димить» унаслідок утворення дрібних краплинок його водного розчину. Хлороводень сильно подразнює дихальні шляхи. Тому досліди із цим газом та його концентрованим водним розчином (концентрованою хлоридною кислотою) проводять у витяжній шафі. Хлоридна кислота Водний розчин гідрогенхлориду називають хлоридною кислотою.Тривіальна назва цього розчину — соляна кислота. Вона зумовлена тим, що раніше длядобування кислоти використовували природну сіль (натрій хлорид).
Майже насичений водний розчин гідроген хлориду (масова частка HCl у ньому становить 34—36 %) називають концентрованою хлоридною кислотою. Із цього розчину постійно виділяється хлороводень. Хлоридна кислота належить до сильних кислот; ступінь її дисоціації в розбавлених розчинах перевищує 90 %. Хімічні властивості. 1)Хлороводень безпосередньо взаємодіє з амоніаком, лугами, органічними речовинами тощо:
У лабораторній практиці здебільшого використовують не газуватий хлороводень, а його водний розчин – хлоридну кислоту, вона є сильною кислотою: 2)у водному розчині хлоридна кислота майже повністю дисоціює на йони: *Поясніть, чому і як молекула HCl розпадається на йони у водному розчині. HCl ↔ H++Cl- 3)взаємодіє з металами, які стоять в ряду активності (ряд стандартних електродних потенціалів) перед воднем:
4)взаємодіє з основними та амфотерними оксидами:
5)взаємодіє з основами та амфотерними гідроксидами: NaOH + HCl = NaCl + H2O Fe(OH)3 + 3HCl = FeCl3 + 3H2O 6)взаємодіє з солями:
Унаслідок взаємодії хлоридної кислоти та її солей з розчином арґентум нітрату утворюється білий сирнистий осад аргентум хлориду, нерозчинний у нітратній кислоті:
Арґентум нітрат AgNO3 – реактив на хлоридну кислоту та її солі * Для трьох останніх реакцій складіть йонно-молекулярні рівняння.
|
|||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 304; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.8.247 (0.004 с.) |