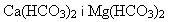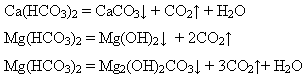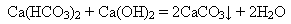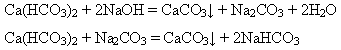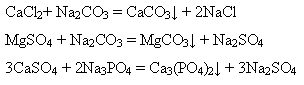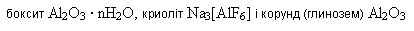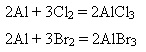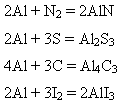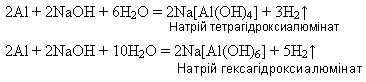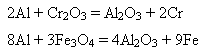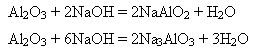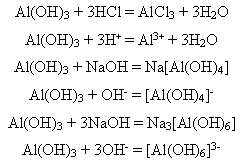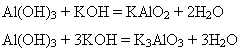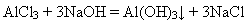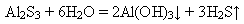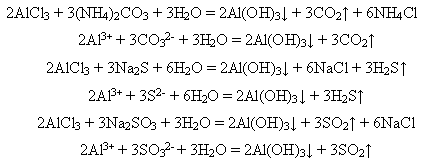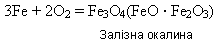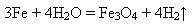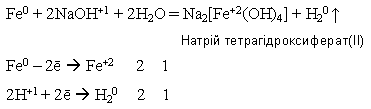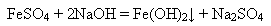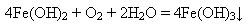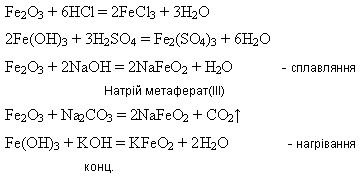Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічні властивості кальцію.
У хімічних реакціях атоми Кальцію легко віддають обидва електрони із зовнішнього енергетичного рівня і виявляють ступінь окиснення +2. Подібно до натрію і калію, кальцій є сильним відновником, хімічно активним металом: 1.на повітрі кальцій легко окиснюється, тому його зберігають під шаром гасу: 2Са + О2 = 2.інтенсивно взаємодіє з галогенами за стандартних умов: Ca + Cl2 = 3.під час нагрівання легко взаємодіє з сіркою Ca + S = 4.та іншими неметалами: 3Ca + N2 = Ca + 2C = 5.за стандартних умов реагує з водою: *напишіть рівняння реації
6.відновлює інші метали з їхніх сполук: 2 Ca + UF4 = 2CaF2 + U Ca + PbO = CaO + Pb Кальцій оксид Кальцій оксид СаО – кристалічна речовина білого кольору, дуже тугоплавка (tпл=2627oC). Хімічні властивості. Кальцій оксид виявляє усі хімічні властивості, характерні для основних оксидів активних металів: бурхливо реагує з водою за стандартних умов: *напишіть рівняння реакції
реагує з кислотами: *напишіть рівняння реакції
реагує з кислотними оксидами: *напишіть рівняння реакції
Добування і застосування. У промисловості кальцій оксид добувають випалюванням вапняку за температури 900 – 1000оС *напишіть рівняння реакції
Технічна назва СаО – негашене (палене) вапно. Застосовується СаО як основа в’яжучих матеріалів, для добування хлорного вапна, соди і як флюс у доменному виробництві чавуну та ін. Кальцій гідроксид Кальцій гідроксид Са(ОН)2 безбарвні кристали, малорозчинні у воді, милкі на дотик. Сполука йонної будови. Водний розчин називається вапняною водою, а суспензію – вапняним молоком. Хімічні властивості. Са(ОН)2 - сильна основа, луг. 1.у водному розчині дисоціює на йони: *напишіть дисоціацію кальцій гідроксиду по ступенево
2.взаємодіє з кислотами: *напишіть рівняння реакції
3.взаємодіє з кислотними оксидами: *напишіть рівняння реакції
4.взаємодіє з солями: *напишіть рівняння реакції
Добування і застосування. Добувають кальцій гідроксид за допомогою гасіння паленого (негашеного) вапна: *напишіть рівняння реакції
Застосовують у будівництві як в’яжучий матеріал, у харчовій промисловості для знецукрювання патоки, у виробництві сталі як компонент шихти, для пом’якшення води, розкиснення грунтів, вапнування стовбурів дерев, добування солей Кальцію і натрій гідроксиду.
Твердість води Природні води завжди містять хлориди, сульфати, гідрогенкарбонати Кальцію, Магнію та інших домішок.
Сумарний вміст солей Кальцію та Магнію називається загальною твердістю. Тверда вода непридатна для багатьох технічних цілей. При тривалому використанні твердої води стінки парових котлів вкриваються твердою кіркою накипу, що знижує теплообмін і призводить до збільшення витрати палива. Така кірка, може бути причиною утворення тріщин у кип’ятильних трубах і на стінках самого котла. Тверда вода не дає піни з милом, оскільки розчинні натрієві солі жирних кислот – пальмітинової і стеаринової, які є в милі, переходять у нерозчинні кальцієві солі:
Тверда вода непридатна для фарбування та інших технологічних процесів. Тому воду зм’якшують, тобто видаляють ці солі. Способи різні, залежно від виду твердої води. Загальна твердість води поділяється на карбонатну і некарбонатну. Карбонатна твердість зумовлена наявністю гідрогенкарбонатів – Способи усунення карбонатної твердості: кип’ятіння води:
Твердість води, що усувається кип’ятінням, називається тимчасовою твердістю. додавання вапняної води або гашеного вапна:
додавання натрій гідроксиду або соди:
Некарбонатна твердість зумовлена наявністю CaCl2, MgCl2, CaSO4, MgSO4. ЇЇ ще називають постійною твердістю, бо кип’ятінням вона не усувається. Зм’якшити воду з постійною твердістю можна тільки додаванням соди або натрій фосфату:
*1)Ca→CaO→Ca(OH)2→CaCO3→Ca(HCO3)2 2)MgCO3→MgO→MgSO4→Mg(NO3)2→Mg(OH)2→MgCI2→Mg 3)Добудьте п’ятьма способами магній фосфат. 4)Добудьте п’ятьма способами кальцій сульфат. Алюміній *охарактеризуйте алюміній за місеросташуванням в ПС,напишіть електронну конфігурацію його атома У збудженому стані атом Алюмінію може утворювати три ковалентні зв’язки або віддавати три валентні електрони, виявляючи ступінь окиснення +3. Отже, в окисно-відновних реакціях Алюміній поводить себе як відновник.
У природі Алюміній дуже поширений,найпоширеніший метал на Землі-складає 8% земної кори, трапляється тільки у вигляді алюмосилікатів. Це різні глини, слюда, польовий шпат, каолін тощо. Основною алюмінієвою рудою є
Фізичні властивості. Алюміній – сріблясто-білий метал, ковкий,легко витягається в дріт,доволі легкоплавкий tпл = 660oC, і дуже легкий r = 2,7 г/см3. Має високу електричну і теплову провідність, дуже пластичний. За кімнатної температури не змінюється на повітрі,тому що вкритий тонкою оксидною плівкою,яка має сильну захисн дію. Хімічні властивості. Алюміній – активний метал. Його поверхня вкрита тонкою, щільною і дуже міцною оксидною плівкою Al2O3, яка захищає його від подальшого окиснення і зумовлює високу корозійну стійкість: 4Al + 3O2 = 2Al2O3 1)якщо зняти оксидну плівку, алюміній енергійно реагує з водою:
2) за стандартних умов взаємодіє з хлором і бромом:
3) під час нагрівання – з багатьма неметалами:
4)за стандартних умов алюміній реагує з хлоридною і розбавленою сульфатною кислотою: *напишіть рівняння реакції
Концентровані сульфатна й нітратна кислоти пасивують алюміній: під дією цих кислот збільшується товщина оксидної плівки на металі, і він не взаємодіє з ними. 5) взаємодіє з лугами завдяки легкості розчинення в них оксидної плівки:
6)Алюміній – добрий відновник багатьох оксидів металів:
Спосіб відновлення оксидів металів алюмінієм називають алюмінотермією (різновид металотермії). Добування і застосування алюмінію. Спочатку з бокситу добувають глинозем, а потім електролізом розчину алюміній оксиду у розплавленому криоліті Na3[AlF6] добувають металічний алюміній. Алюміній за використанням у промисловості посідає друге місце після заліза. Основна маса його йде на виготовлення сплавів – дюраль, або дюралюміній. Це сплав алюмінію з міддю і невеликими кількостями магнію, мангану та інших компонентів. Використовується як конструктивний матеріал в авіа- і машинобудуванні, як розкисник (вилучає надлишковий кисень) під час виплавляння сталі, для добування кальцію, барію, мангану, хрому алюмінотермічним способом, для виготовлення фольги у виробництві конденсаторів, у радіотехніці та для упакування шоколаду, чаю, інших продуктів і виготовлення алюмінієвого дроту, “срібної” фарби. Зі сплавів алюмінію роблять різні предмети побуту. Алюміній оксид Алюміній оксид (глинозем) Al2O3 - біла тугоплавка (tпл=2044oC), нерозчинна у воді речовина. Хімічний зв’язок Al – O ковалентний полярний, близький за полярністю до зв’язку О – Н. Тому алюміній оксид може виявляти як основні, так і кислотні властивості залежно від кислотно-основних властивостей речовини, з якою реагує. З кислотами він взаємодіє як основний оксид, а з основами (лугами) – як кислотний. 1) свіжодобутий алюміній оксид розчиняється в кислотах і лугах:
2)Під час сплавляння з лугами також утворюються алюмінати:
Добувають алюміній оксид у лабораторних умовах: спалюючи метал: *напишіть рівняння реакції
прожарюючи алюміній гідроксид: *напишіть рівняння реакції
У природі існують модифікації алюміній оксиду у вигляді мінералу корунду, якому властива дуже висока твердість, і глинозему.
Застосування. Забарвлені прозорі кристали корунду – коштовні камені: - рубін – червоного кольору, -сапфір – синього кольору. Вони використовуються у ювелірній справі. Рубіни (штучно добуті) використовують як опорні камені у точних механізмах і як робочі тіла лазерів. -Непрозорі кристали корунду – наждак. З нього виробляють шліфувальні круги, бруски для полірування металів. З глинозему як тугоплавкого матеріалу виготовляють тиглі, цеглу для скловарних печей тощо.
Алюміній гідроксид Алюміній гідроксид Al(OH)3 - біла тверда речовина нерозчинна у воді, виявляє амфотерні властивості. 1)Свіжоосаджений алюміній гідроксид взаємодіє і з кислотами, і з лугами (сухий не взаємодіє):
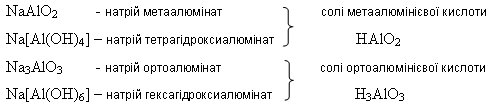
Залежно від молярного співвідношення речовин, що реагують, утворюються або тетра-, або гексагідроксиалюмінат. 2)Під час сплавляння утворюються або мета-, або ортоалюмінат:
У лабораторних умовах алюміній гідроксид добувають дією розчинів лугів на розчини солей Алюмінію:
Солі Алюмінію Солі Алюмінію та алюмінати у водних розчинах дуже гідролізують і перетворюються на основні:
або повністю гідролізують:
Тому у водних розчинах не утворюються ні карбонати, ні сульфіди, ні сульфіти Алюмінію:
*Здійснити претворення: 1)Алюміній оксид → алюміній сульфат → алюміній нітрат → алюміній гідроксид→гексаалюмінат натрію 2)Алюміній гідроксид→алюміній оксид→алюміній хлорид→алюміній гідроксид→тетраалюмінат калію 3)Алюміній→алюміній оксид→алюмінат натрію→алюміній сульфат→алюміній гідроксид
*2Al + 6HCl = 4Al + 3O2 = Al2O3 + 6HCl = AlCl3 + 3NaOH = 2Al(OH)3 = Ферум *охарактеризуйте ферум за місцеросташуванням в ПС,напишіть електронну конфігурацію його атома Найхарактерніші ступені окиснення +2 і +3 (відомі сполуки, де Ферум виявляє ступені окиснення, що дорінюють 0, +4, +6). За поширенням у природі Ферум посідає четверте місце після Оксигену, Силіцію, Алюмінію. Трапляється у вигляді різних сполук: оксидів, сульфідів, силікатів та ін. У вільному стані – тільки в метеоритах. Основні мінерали, що містять Ферум:
Фізіологічна дія. У рослин елемент Ферум входить до складу хлорофілу. В разі неcтачі Феруму рослини втрачають здатність асимілювати вуглекислий газ (карбон(IV) оксид). У тваринних організмах Ферум входить до складу гемоглобіну крові, який переносить кисень від органів дихання до різних тканин, а вуглекислий газ – від тканин до органів дихання. Ферум є складовою багатьох окисно-відновних ферментів, що забезпечують тканинне дихання. Сполуки Феруму накопичуються у печінці, кістковому мозку і селезінці. Ферум – необхідний елемент для кровотворення. В організмі людини міститься близько 3 г феруму.
Залізо Проста речовина, що складається з елемента Феруму, називається залізо. Фізичні властивості. Чисте залізо – сріблясто-білий блискучий метал, пластичний, відносно м’який, легко кується, прокатується, зварюється. Густина заліза = 7,87 г/см3 температура плавлення tпл=1535oС Має здатність намагнічуватися. *який тип зв’язку у заліза Хімічні властивості. Залізо належить до металів середньої хімічної активності.Можливі ступені окиснення +2 і +3. 1)взаємодіє з киснем:
2)під час нагрівання взаємодіє з іншими неметалами – хлором, сіркою, вуглецем, азотом: *Напишіть рівняння реакції взаємодії заліза з сіркою,фосфором,азотом,вуглецем 3)у розжареному стані (понад 700ОС) взаємодіє з водою (водяною парою):
4)корозія На вологому повітрі та у воді, яка містить кисень, залізо зазнає корозії, воно іржавіє, вкриваючись жовто-бурою плівкою, яка переважно складається із ферум(ІІІ) гідроксиду, але плівка не захищає метал від подальшої корозії: *Напишіть рівняння реакції ржавіння заліза,складіть схему електронного балансу,визначте окисник і відновник. 5)взаємодіє з хлоридною і розбавленою сульфатною кислотами: *Напишіть рівняння реакції -Концентрована (безводна) сульфатна кислота пасивує залізо, що дає змогу зберігати і перевозити її у залізних цистернах. -Концентрована нітратна кислота також пасивує залізо. 6)Залізо відновлює менш активні метали з розчинів їхніх солей: Fe + CuSO4 = FeSO4 + Cu 7)у подрібненому вигляді залізо може взаємодіяти з концентрованим гарячим розчином лугу з утворенням комплексних гідроксисолей:
Оксиди і гідроксиди Феруму Ферум утворює три оксиди і два гідроксиди:
Оксиди і гідроксиди Феруму обох ступенів окиснення мають амфотерні властивості. У сполук Феруму(ІІ) вони дуже слабко виражені, тому ферум(ІІ) оксид і ферум(ІІ) гідроксид виявляють переважно основні властивості: 1)взаємодія з кислотами *допишіть рівняння відповідних реакцій FeO + 2HCl = Fe(OH)2 + H2SO4 = 2)Ферум(ІІ) оксид з лугами не взаємодіє. 3)Ферум(ІІ) гідроксид, якщо він свіжодобутий і під час кип’ятіння реагує з концентрованим розчином лугу: Fe(OH)2 + 2NaOH = Na2[Fe(OH)4] Натрійтетрагідроксиферат(ІІ)
Ферум(ІІ) гідроксидутворюєтьсявнаслідокдіїлугівнарозчинисолейФеруму(ІІ):
Саме так відбувається реакція без доступу повітря. У протилежному разі ферум(ІІ) гідроксид легко окиснюється до ферум(ІІІ) гідроксиду:
Сполуки Феруму(ІІІ). Оксид і гідроксид Феруму(ІІІ) мають більш виражені амфотерні властивості:
Посилення кислотних властивостей сполук Феруму(ІІІ) порівняно із сполуками Феруму(ІІ) пояснюється збільшенням ковалентності зв’язку Fe – O із підвищенням ступеня окиснення Феруму.
Ферум(ІІІ) оксид утворюється внаслідок дії лугів на розчини солей Феруму(ІІІ):
Гідроксиди Феруму(ІІ) і (ІІІ) під час нагрівання розкладаються: 2Fe(OH)3 = Fe2O3 + 3H2O Fe(OH)2 = FeO + H2O Подвійний (змішаний) оксид. Підчасвзаємодіїзкислотамиутворюєсумішдвохсолей – Феруму(ІІ) іФеруму(ІІІ): Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O Fe3O4 + 4H2SO4 = Fe2(SO4)3 + FeSO4 + 4H2O Підчасвзаємодіїзнітратноюкислотоюутворюєтьсялишеоднасіль – ферум(ІІІ) нітратвнаслідококисненнясполукФеруму(ІІ) досполукФеруму(ІІІ):
|
||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 724; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.201.71 (0.082 с.) |