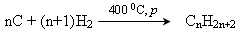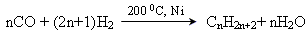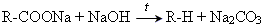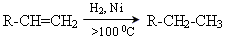Реактивом на йони Феруму(ІІ) є червона кров’яна сіль K3[Fe(CN)6 ] - калій гексаціаноферат(ІІІ), яка під час взаємодії з солями Феруму(ІІ) дає осад синього кольору – турнбулеву синь:
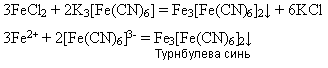
Реактивом на йони Феруму(ІІІ) є жовта кров’яна сіль K4[Fe(CN)6] - калій гексаціаноферат(ІІ), яка під час взаємодії з солями Феруму(ІІІ) дає осад синього кольору – берлінську лазур:
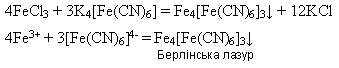
Іншим реактивом на йони Феруму(ІІІ) є амоній тіоціанат NH4SCN або калій тіоціанат KSCN. Утворюється сполука темно-червоного кольору:
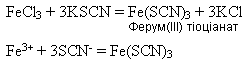
*Напишіть рівняння можливих реакцій між:
1)ферумом і карбоном
2)ферумом і купрум хлоридом
3)оксидом феруму(2) і хлоридною кислотою
4)оксидом феруму (3) і натрій гідроксидом
5)гідроксидом феруму (2) і фосфатною кислотою
6)гідроксидом феруму (3) і сульфатною кислотою
*здійсніть претворення
Fe2O3 → Fe → FeCl2 → Fe(OH)2 → FeO → Fe → FeCl3
ОРГАНІЧНА ХІМІЯ
Вуглеводні
*напишіть гомологічний ряд алканів,алкенів,алкінів
*пригадайте що таке ізомерія та ізомери.
*напишіть по 3 ізомери гексану,гептену,ноніну.
| Насичені (Алкани)
| Етиленові (Алкени)
| Ацетиленові (Алкіни)
| | Будова молекули
| | Тетраедрична
| Плоска
| Лінійна
| | Валентний кут
| | 109,5º
| 120º
| 180º
| | Довжина зв’язку С-С
| | 0,154 нм
| 0,134 нм
| 0,120 нм
| | Тип зв’язків, їх особливості
| | σ-зв'язок: важко поляризується, міцний, можливе вільне обертання атомів навколо σ- зв’язку.
| σ- і π-звязки
| σ- і два π-звязки
| | π-звязки легко поляризуються, неміцні; легко розриваються; відсутнє вільне обертання атомів навколо подвійного й потрійного зв’язків
| | Просторова будова
| | Утворюють просторові форми
| Утворюють цис- і транс-ізомери
| Відсутня геометрична ізомерія
| | Ізомерія (структурна)
| | Ізомерія карбонового скелета
| Ізомерія карбонового скелета й положення подвійного й потрійного зв’язку
| | Методи добування
| Перегонка нафти; Гідрування бурого вугілля; Виділення з коксових газів
З синтез-газу:
СО+2Н2  суміш вуглеводнів +Н2О
З простих речовин
С+2Н2 суміш вуглеводнів +Н2О
З простих речовин
С+2Н2  СН4
Гідрування насичених вуглеводнів
СН3-СН=СН2+Н2 СН4
Гідрування насичених вуглеводнів
СН3-СН=СН2+Н2  СН3-СН2-СН3
Реакція В’юрца
2СН3-СН2Cl+2Na СН3-СН2-СН3
Реакція В’юрца
2СН3-СН2Cl+2Na  CH3-(CH2)2-CH3
CH3-(CH2)2-CH3
| Крекінг нафтопродуктів:
Виділення з коксових газів
Дегідрування насичених вуглеводнів:
CH3-CH2-CH3  CH3-CH=CH2 +H2
З галогенопохідних насичених вуглеводнів:
C2H5-Cl CH3-CH=CH2 +H2
З галогенопохідних насичених вуглеводнів:
C2H5-Cl  CH2=CH2+KCl+H2O
Гідрування ацетиленових вуглеводнів:
CH≡CH+H2 CH2=CH2+KCl+H2O
Гідрування ацетиленових вуглеводнів:
CH≡CH+H2  CH2=CH2 CH2=CH2
| Піроліз нафтопродуктів (як побічний продукт)
Піроліз метану:
2СН4  CH≡CH +3Н2
З галогенопохідних насичених вуглеводнів:
СН3-СНBr-СН2-Br CH≡CH +3Н2
З галогенопохідних насичених вуглеводнів:
СН3-СНBr-СН2-Br  СН3-С≡СH+2KBr+2H2O
З кальцій карбіду
СаС2 + Н2О → НС ≡ СН + Са(ОН)2
СН3-С≡СH+2KBr+2H2O
З кальцій карбіду
СаС2 + Н2О → НС ≡ СН + Са(ОН)2
| | Хімічні властивості
| | Горіння
| Горіння
| Горіння
| повне окиснення
С2Н6 + 7О2 = 4СО2 + 6Н2О
часткове окиснення
СН4  СН3ОН
(метиловий спирт)
С4Н10 СН3ОН
(метиловий спирт)
С4Н10  2СН3СООН
(оцтова к-та) 2СН3СООН
(оцтова к-та)
| 3СН2 = СН2 + 3О2 → СО2 + Н2О
3СН2=СН2+4Н2О+2КMnO4→
3СН2OH – СН2OН +2MnO2 +2KOH
Знебарвлення розчину калій перманганату – якісна реакція на кратний зв'язок.
| 2С2Н2 + 5О2 → 4СО2 + 2Н2О
ацетилен на повітрі горить киптявим полум’ям
часткове окиснення
СН≡СН + [О]  НООС-СООН НООС-СООН
| | Дегідрування
| Гідрування(приєднання)
| Гідрування(приєднання)
| СН3-СН2-СН3  СН3-СН=СН2+Н2
СН3-СН=СН2+Н2
| СН2 = СН2 + Н2  СН3 – СН3 СН3 – СН3
| СН≡ СН + Н2  СН2 = СН2 СН2 = СН2
| | Галогенування(заміщення)
| Галогенування(приєднання)
| Галогенування(приєднання)
| | СН4+Cl2→CH3Cl + HCl
| СН2 = СН2 + Br2 → СН2Br – СН2Br
Знебарвлення бромної води – якісна реакція н кратний зв'язок
| Н–С≡ С–Н + Br2  CHBr = CHBr CHBr = CHBr
| |
| Гідрогалогенування(приєднання)
| Гідрогалогенування(приєднання)
| | -
| CH3-CH2=CH2+HBr→
CH3-CH2Br-CH3
Відбувається за правилом Марковнікова
| CH3-C≡CH + HBr → CH3-CBr=CH2
Відбувається за правилом Марковнікова
| |
| Гідратація(приєднання)
| Гідратація(р-я Кучерова)(приє-ня)
| | -
| СН2 = СН2 + Н2О  СН3 – СН2 – ОН
СН3 – СН2 – ОН
| Н–С ≡ С–Н +Н2О  
| | Нітрування (р-я Коновалова) (зам)
| Нітрування
| З солями Аргентуму
| С2Н6 + НNO3  C2H5NO2 + H2O
C2H5NO2 + H2O
| CH3 –C=CH – CH3 + HNO2 →
О NO2
→СН3– С – CH2 – CH3
CH3
| НС-С≡СН+2Ag[(NH3)2]→
→Ag-C≡C-Ag↓ + 4NH3 + 2H2O
(аргентум ацетеленіл-білий осад)
| | Сульфування
| Сульфування
| З солями Купруму (І)
| С2Н6+Н2SO4  C2H5SO3H + H2O
C2H5SO3H + H2O
| СН2 = СН2 + Н2SO4 →
→СН3 – СН2 – ОSO3Н
| НС-С≡СН+[Cu(NH3)2]OH→
→Cu-C≡C-Cu↓ + 4NH3 + 2H2O
(купрум ацетеленіл-черв.-кор. осад)
| | Ізомеризація
| Полімеризація
| Полімеризація
| С2Н10  СН3–СН–СН3
│
СН3 СН3–СН–СН3
│
СН3
| n СН3–СH=СН2  (–СН –СН2–) n
│
СН3 (–СН –СН2–) n
│
СН3
| 3СН≡СН  C6H6
2СН≡СН C6H6
2СН≡СН  CН2 = СН – С ≡ СН CН2 = СН – С ≡ СН
|
| Алкани
(Насичені вуглеводні)
| Алкени
(Ненасичені вуглеводні з подвійним звязком)
| Алкіни
(Ненасичені вуглеводні з потрійним звязком)
| Арени (Ароматичні вуглеводні)
| Загальна формула алканів 
| СnН2n.
| СnН2n-2
| С6Н2n-6
| 
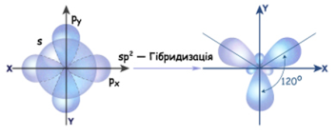
| 
| 
| 
| Кут 109,5  
| 
| 
|
| | Фізичні властивості.
Насичені вуглеводні нормальної (нерозгалуженої) будови мають вищі температури плавлення і кипіння порівняно з ізомерами.
Густина насичених вуглеводнів збільшується зі збільшенням розмірів молекул, проте всі вони легші за воду.
Пропан і бутан легко скраплюються за підвищеного тиску.
Алкани – неполярні або слабкополярні сполуки, практично не розчинні у воді.
Газуваті й тверді алкани не мають запаху, рідкі – мають характерний "бензеновий" запах.
| Фізичні властивості.
Алкени легші за воду й не розчинні у воді, але розчиняються в неполярних органічних розчинниках. Так само, як у алканів, їхні температури плавлення і кипіння підвищуються зі збільшенням довжини карбонового ланцюга. Алкени з розгалуженою будовою молекул мають нижчі температури плавлення порівняно зі сполуками з нормальною будовою молекул
| Фізичні властивості.
Температури плавлення і кипіння алкінів закономірно змінюються зі зростанням числа атомів Карбону в молекулах
Ацетилен – безбарвний газ, без запаху, мало розчинний у воді, трохи легший за повітря.
У природі ацетиленові вуглеводні не трапляються через високу хімічну активність цих сполук.
| Фізичні властивості.
За звичайних умов бензен – рідина зі специфічним запахом, температура кипіння – 80оС, у воді практично нерозчинний, хоча є розчинником багатьох органічних речовин.
| | Застосування.
Метан. як відносно дешеве паливо у побуті та багатьох промислових процесах (доменному, скловарному). Продукт хімічної переробки метану – вуглець (у вигляді сажі) - використовують для виготовлення гуми, друкарської фарби; водень – для синтезу амоніаку та гідрогенхлориду. Продукти неповного окиснення метану є вихідними речовинами для виготовлення пластмас, використовують їх і в органічному синтезі. З метану добувають ацетилен. Пропан і бутан– гази, що легко скраплюються. Це зумовлює їх використання у побуті як палива. Ці алкани є сировиною для добування багатьох органічних речовин, з яких, у свою чергу, отримують інші сполуки.
Парафін– суміш твердих вуглеводніввикористовують у медицині, виробництві мийних засобів, пластмас, свічок, жувальної гумки.
Озокерит, або гірський віск, що є сумішшю вуглеводнів нафтового походження, використовують у медицині.
| Застосування. З етиленових вуглеводнів добувають багато різних продуктів, насамперед поліетилен і поліпропілен, які використовують для виробництва пластмас.
| Застосування.
Газове зварювання і різання металів
Добування хлоропохідних (розчинників)
Добування хлоровінілу (для добування поліхлорвінілу)
Добування оцтового альдегіду та оцтової кислоти
Добування хлоропрену (для виробництва синтетичного каучуку)
| Бензен є вихідною речовиною для синтезу величезної кількості органічних речовин. Серед них – барвники, лікарські препарати, пахучі речовини, полімери, отрутохімікати, вибухові речовини. Бензен – базова сировина для промислового органічного синтезу. Використовується і як розчинник.
Однією з важливих галузей застосування похідних бензену є сільське господарство. Тут використовують речовини, що захищають рослини від комах-шкідників, паразитичних грибів, бур'янів, тобто пестициди
| |
*дайте назву сполукам:
| СН3
│
а) СН3 – С – СН2- СН3
│
СН3
| б) СН3 – СН – СН2–СН3
│
СН3
| | С2Н5
│
в) СН3 – С – СН– СН3
│ │
СН3СН3
| г) СН3 – СН –СН2–СН3
│
СН2 – СН3
|
*запишіть за назвами формулу сполук:
а)3,3-диметил-4-етилгептан
б)4,4,6-триметил-3,5-диетилнонен-1 |
Отримання алканів
Промислові методи
1. У промислових умовах насичені вуглеводні з довжиною ланцюга до одинадцяти атомів Карбону отримують звичайно наступними методами:
• фракційна перегонка нафти;
• переробка природного газу;
• гідрогенізація вугілля:
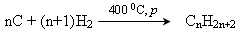
2. Синтез Фішера – Тропша
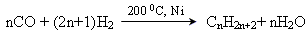
Лабораторні методи
1. Гідроліз карбіду алюмінію
Al4C3 +12H2O → 4Al(OH)3+3CH4
2. Декарбоксилювання
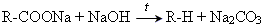
Синтез Вюрца
2СН3Сl+2Na → C2H6+2NaCl;
2R-Br+2Na → R-R+2NaBr
3. Гідрування (гідрогенізація) алкенів
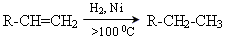


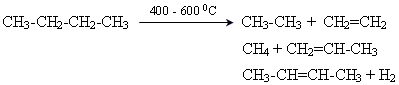

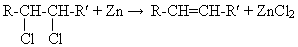

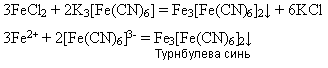
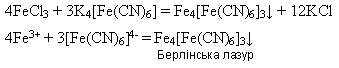
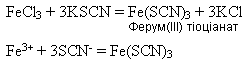
 суміш вуглеводнів +Н2О
З простих речовин
С+2Н2
суміш вуглеводнів +Н2О
З простих речовин
С+2Н2  СН3-СН2-СН3
Реакція В’юрца
2СН3-СН2Cl+2Na
СН3-СН2-СН3
Реакція В’юрца
2СН3-СН2Cl+2Na  CH3-(CH2)2-CH3
CH3-(CH2)2-CH3
 CH2=CH2+KCl+H2O
Гідрування ацетиленових вуглеводнів:
CH≡CH+H2
CH2=CH2+KCl+H2O
Гідрування ацетиленових вуглеводнів:
CH≡CH+H2  CH≡CH +3Н2
З галогенопохідних насичених вуглеводнів:
СН3-СНBr-СН2-Br
CH≡CH +3Н2
З галогенопохідних насичених вуглеводнів:
СН3-СНBr-СН2-Br  СН3-С≡СH+2KBr+2H2O
З кальцій карбіду
СаС2 + Н2О → НС ≡ СН + Са(ОН)2
СН3-С≡СH+2KBr+2H2O
З кальцій карбіду
СаС2 + Н2О → НС ≡ СН + Са(ОН)2
 СН3ОН
(метиловий спирт)
С4Н10
СН3ОН
(метиловий спирт)
С4Н10  НООС-СООН
НООС-СООН

 C2H5NO2 + H2O
C2H5NO2 + H2O
 C2H5SO3H + H2O
C2H5SO3H + H2O
 СН3–СН–СН3
│
СН3
СН3–СН–СН3
│
СН3
 (–СН –СН2–) n
│
СН3
(–СН –СН2–) n
│
СН3