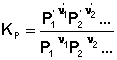Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос 14: Обратимые, необратимые и практически необратим. Реакции
Обратимые реакции – хим. р-ции протекающие в заданных условиях во взаимообратных направлениях Необратимые хим. р-ции – р-ции в которых в смеми после установления равновесия не обнаруживается хотя бы одно из исх. В-в Почти необратимые р-ции- когда в насыщенном растворе смеси можно обнаружить исходные вещества Ag+ +Cl- → AgCl↓ Условия: 1)система должна быть закрытой чтобы ни один из ее компонентов не мог уходить из сферы р-ции 2)колва в-ва должны быть достат. Чтобы они не могли полностью израсход. до наступления равновесия Вопрос 15:константа равновесия хим. реакции./ Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации Сi, парциальные давления Pi или мольные доли Xi реагирующих веществ. Для некоторой реакции
соответствующие константы равновесия выражаются следующим образом:
(1)
(3)
Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от природы реагирующих веществ и температуры. ПРИМЕР N2+3H2 →2NH3 Равновесие – Vпрям=V обр Vпрям. = kC(N2)C3(H2); Vобр=k2C2(NH3 ) kC(N2)C3(H2)=k2C2(NH3 ) K=k1/k2= C2(NH3 )/ C(N2)C3(H2) Если К=1 равновесие не смещено, если К>1 то смещено вправо, если 0<K<1 то влево При равновесии отношение произведения концентраций продуктов к произведению концентраций реагентов(в степенях равных стехиом. коэф) есть величина постоянная называемая константой равновесия. Вопрос 16: Принцип Ле-Шателье Если на систему находящуюся в равновесии оказывается какое либо внешнее воздействие то оно способствует протеканию той реакции которая ослабляет воздействие Гомогенные: N2+3H2 ↔2NH3 + Q А) ↑С(N2); ↑C(H2); ↓C(NH3) равновесие смещено вправо Б) ↑Р В)↓Т Гетерогенные: 2Fe + 3H2O↔Fe2O3 + 3H2 Равновесие смещено вправо А)↑(H2O); ↓C(Fe2O3); ↓C(H2) Б) ↓t B) P Принцип Ле-Шателье неприменим к системам которые не находятся в равновесном состоянии Принцип является следствием второго закона термодинамики.
Вопрос 17: Влияние температуры на хим. равновесие Повышение или понижение температуры системы находящейся в равновесном состоянии, значит приобретение или соотв. потерю энергии системой, т.е. изменение ее энергетич или, что то же, термодинамич., состояния.
Повышение темп. Происходящее при поглощении системой энергии извне.смещает равновесие в сторону процесса поглощающего теплоту, т.е. эндотермич,а понижение темп. соответственно способствует большей степени протекания экзотермич. р-ции. Пример: N2+3H2 ↔2NH3 + Q ↑t влево; ↓t вправо 2Fe + 3H2O↔Fe2O3 + 3H2 + Q ↑t влево; ↓t вправо
|
|||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 43; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.172.224 (0.006 с.) |

 (2)
(2)