Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие о теории переходного состояния.
1. Зависимость скорости реакции от температуры описывается законом Вант-Гоффа: При повышении температуры на 10° скорость химической реакции возрастает в два-четыре раза.
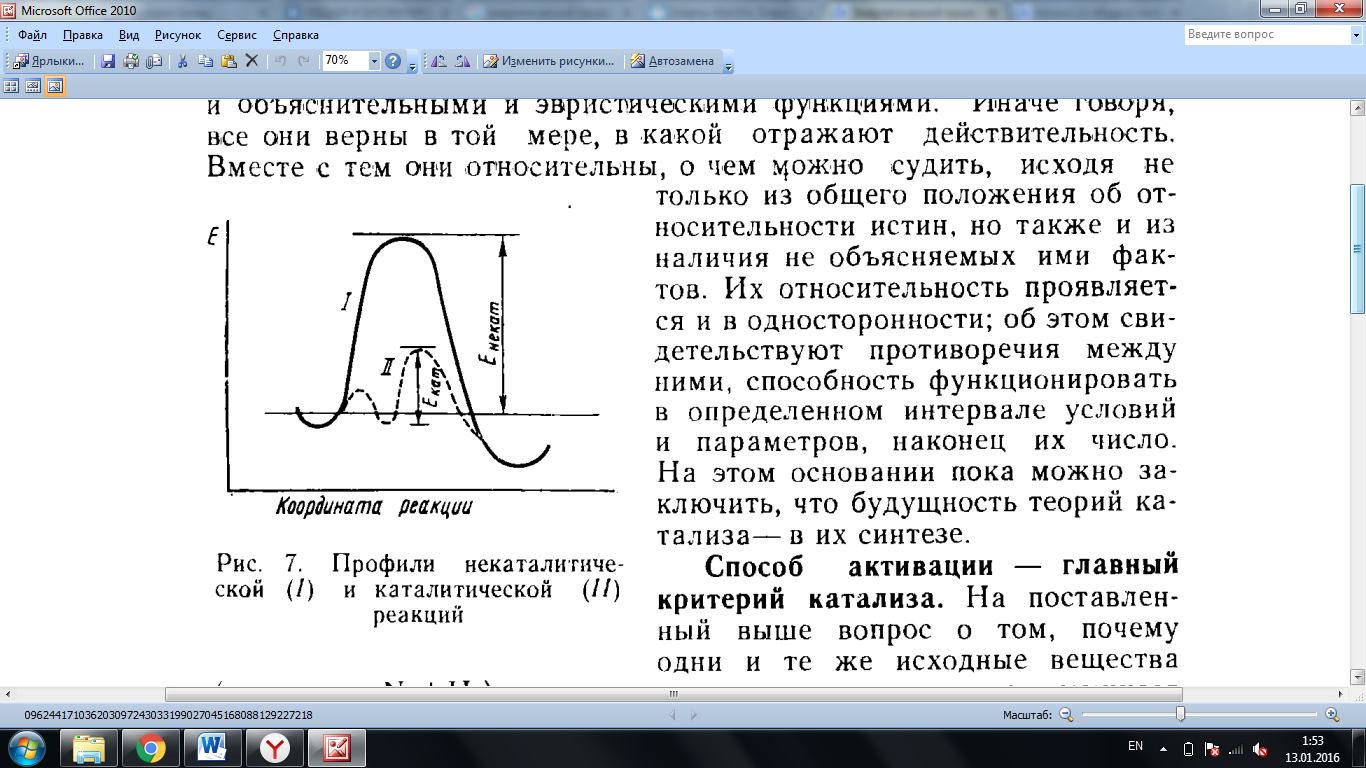
2. 3. Теория активных соударений: · Реакционноспособными являются не все молекулы, а только те, которые находятся в особом активном состоянии · Активные молекулы образуются из обычных в результате поглощения энергии. · Активные молекулы превращаются в молекулы конечного продукта со скоростью, не зависящей от температуры. Влияние температуры на скорость химической реакции сводится к смещению равновесия в сторону активных молекул
Уравнение Аррениуса: дает точную зависимость константы скорости от температуры k = A·e –Ea/RT, А — множитель Аррениуса, величина которого объясняется теорией столкнове- ний, Ea — энергия активации, R — универсальная газовая постоянная (8,31 Дж/моль·К), Т — абсолютная температура в градусах Кельвина. 5. В теории столкновений величину константы скорости k описывают как произведение трех составляющих факторов: k = Z•P•E Z — частота столкновений частиц, Р — стерический фактор, вероятность столкновения частиц, обладающих необходимой траекторией полета, Е — вероятность столкновения частиц, обладающих необходимой энергией, большей, чем энергия активации Рассмотрим стерический (геометрический) фактор Р на примере получения уголковой молекулы нитрозилхлорида NOCl в газофазной реакции (рис. 3.8): NO + Cl2 → NOCl + Cl·
Как видно из рис. 3.8, для того чтобы при столкновении молекулы NO и Cl2 произошло образование целевого продукта NOCl, необходима определенная геометрия взаимного рас- положения частиц. Необходимо, чтобы произошло столкновение атома хлора с атомом азота (рис. 8, схема А), а не с атомом кислорода (рис. 3.8, схема В) и траектории сталкивающихся
частиц пересекались бы в определенном диапазоне углов (примерно 120º). Чем сложнее гео- метрия самих сталкивающихся частиц, тем меньше вероятность их столкновения с необхо- димыми траекториями, тем меньше множитель Р (стерический фактор) в уравнении теории столкновений. Оба фактора, Z и Р, учитываются в уравнении Аррениуса в значении множи- теля А=ZP. 6. Теория переходного состояния: Переходное состояние это такое состояние, когда химические связи между атомами еще не до конца разрушены, а новые связи еще не образовались 1) частицы реагентов при взаимодействии теряют свою кинетическую энергию, которая превращается в потенциальную, и для того чтобы реакция свершилась, необходимо преодолеть некий барьер потенциальной энергии; 2) разница между потенциальной энергией частиц и упомянутым энергетическим барьером и есть энергия активации; 3) переходное состояние находится в равновесии с реагентами; 1.Катализ. Гомогенный и гетерогенный катализ. 2. Энергетический профиль каталитической реакции. 3. Особенности каталитической активности ферментов. 4. Уравнение Михаэлиса - Ментен и его анализ.
Гомогенный катализ – каталитические реакции, в которых реагенты и катализатор находятся в одной фазе. В случае гомогенно-каталитических процессов катализатор образует с реагентами промежуточные реакционноспособные продукты. Пример: СН3СНО ––> СН4 + СО В присутствии паров йода этот процесс протекает в две стадии: СН 3СНО + I2 ––> СН 3I + Н I + СО СН 3I + Н I ––> СН 4 + I2 Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами.
Отличия от химического катализа · Высокая каталитическая активность, в миллионы раз превосходящая активность химических катализаторов.
· Высокая химическая специфичность. Каждый из ферментов действует лишь на строго определенную реакцию или группу реакций, протекающих в организме ·
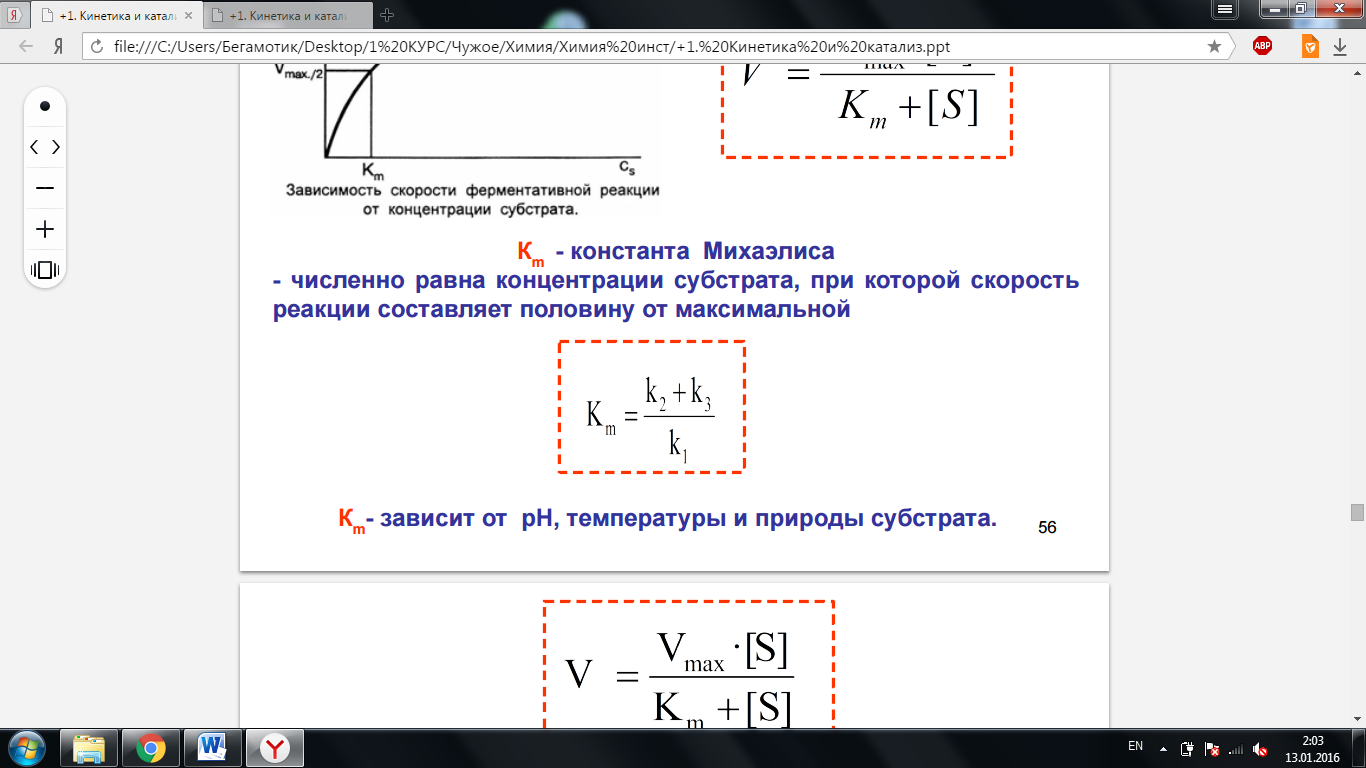
Кm - константа Михаэлиса. Численно равна концентрации субстрата, при которой скорость реакции составляет половину от максимальной. Зависит от рН, температуры и природы субстрата
1. Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обусловливающие ее уникальную роль как единственного биорастворителя. 2. Автопротолиз воды. Константа автопротолиза воды. 3. Зависимость растворимости веществ в воде от соотношения гидрофильных и гидрофобных свойств; влияние внешних условий, на растворимость. 4. Термодинамика растворения. 5. Понятие об идеальном растворе. 1. Свойства: · Вода – самая полярная жидкость. Она приводит к распаду ионных кристаллических решеток, растворению ионных веществ и к полной диссоциации ионных связей. · Высокий дипольный момент (константа, характеризующая электрическую симметрию молекулы)=1,82(Дебай) обуславливает интенсивное ионно-дипольное взаимодействие. · Способность к образованию водородных связей обусловливается наличием двух атомов водорода в молекуле воды и двух неподеленных электронных пар на атоме кислорода. Водородные связи образуются под углом в 109º друг относительно друга, что определяет тетраэдрическую структуру как льда, так и жидкой воды. · Вода- слабый амфотерный электролит подвергается незначительной диссоциации в соответствии с уравнением:
Это приводит к тому, что вода хорошо растворяет и основания и кислоты. · Вода обладает широким температурным диапазоном жидкого состояния (от 0 до100 ºС), что является уникальным по сравнению с другими растворителями · Вода обладает высоким значением теплоемкости (75,3 Дж/моль·К) и высоким значением теплоты испарения (40,8 кДж/моль), что обеспечивает хорошее термостатирование живых организмов 2. Автопротолиз – самодиссоциация воды. Обратимая передача протона H от одной молекулы к другой.
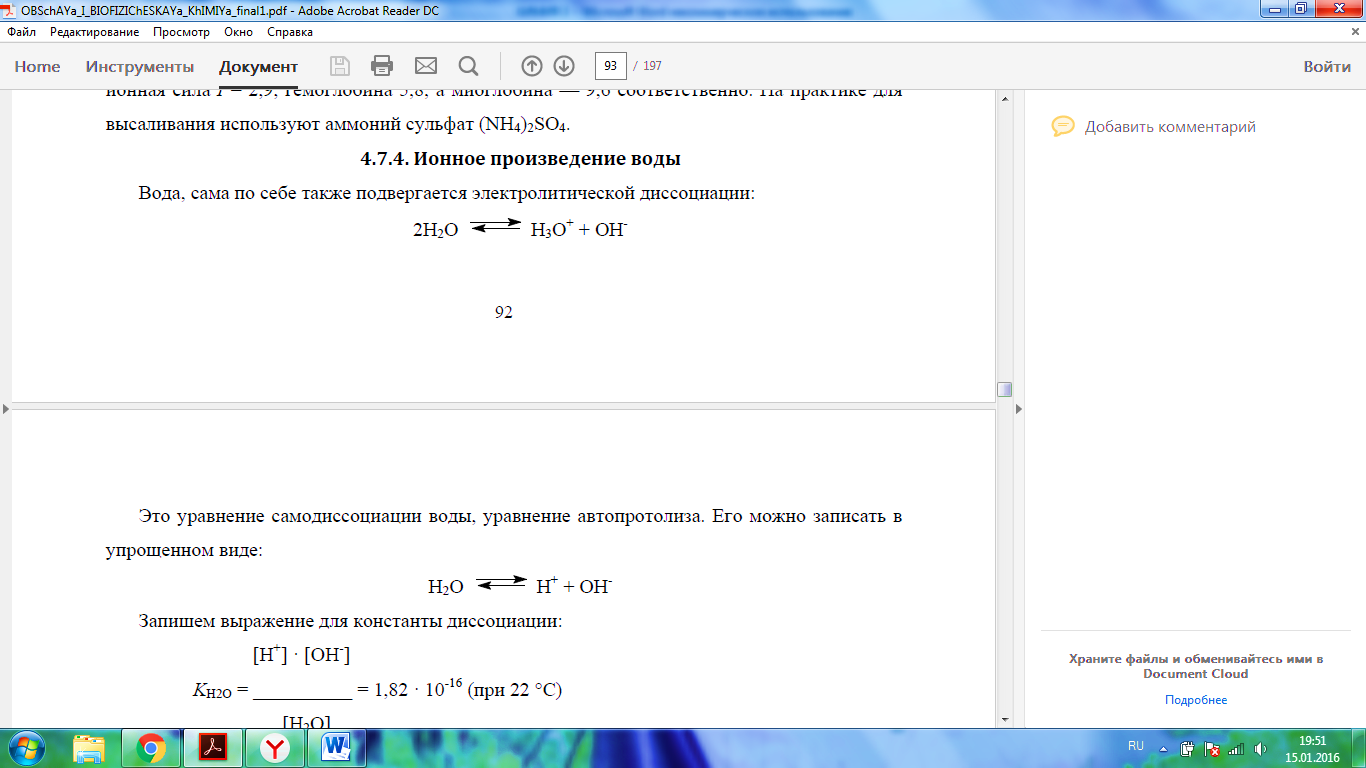
Константа автопротолиза воды - ионное произведение воды, обозначается, как правило Kw и при стандартных условиях составляет 10 ^− 14. 3. Гидрофильные - вещества имеющие полярную молекулу, включающую электроотрицательные атомы (кислород, азот, фосфор и др.). Отдельные атомы таких молекул образуют водородные связи с молекулами воды. Примеры: сахара, аминокислоты, органические кислоты. Гидрофобные – вещества, молекулы которых неполярны и не смешиваются с полярным растворителем, каковым является вода, но хорошо растворимы в органических растворителях, например, в эфире. Примером могут служить углеводороды (бензин, керосин, парафин), животный жир, растительное масло. Зависимость растворимости в воде от температуры: При увеличении температуры растворимость увеличивается 4. При растворении жидких и твердых веществ энтропия системы обычно возрастает (S > 0 При растворении газов в жидкости энтропия системы обычно уменьшается (S < 0)
В процессе образования раствора энтальпия системы также может как увеличиваться (NaCI), так и уменьшаться (КОН). Изменение энтальпии процесса растворения нужно рассматривать в соответствии с законом Гесса
5. Идеальный раствор – раствор, в котором соблюдается равенство всех сил межмолекулярного взаимодействия
1. Общая характеристика растворов как гомогенных систем. 2. Виды растворов. 3. Растворимость. 4. Ненасыщенные, насыщенные и пересыщенные растворы. 5. Растворимость газов. Законы Генри, Дальтона, Сеченова. 6. Растворимость жидких и твердых веществ. 7. Тепловые эффекты и термодинамика растворения веществ. 8. Сольватная теория растворов. 9. Коллигативные свойства растворов. 10. Осмос. Осмотическое давление. Закон Вант-Гоффа и его аналогия с газовыми законами. 11. Осмолярность. 12. Роль осмоса в биологических системах. 13. Гипо-, гипер-, изотонические растворы. 14. Тургор, плазмолиз, лизис клеток. 1. Характеристики: · Концентрация - число, граммов растворенного вещества, содержащимся в 100 граммах раствора.
· Молярная концентрация – число моль вещества в 1 л раствора
· Нормальная концентрация – число моль-экв вещества в 1 л раствора
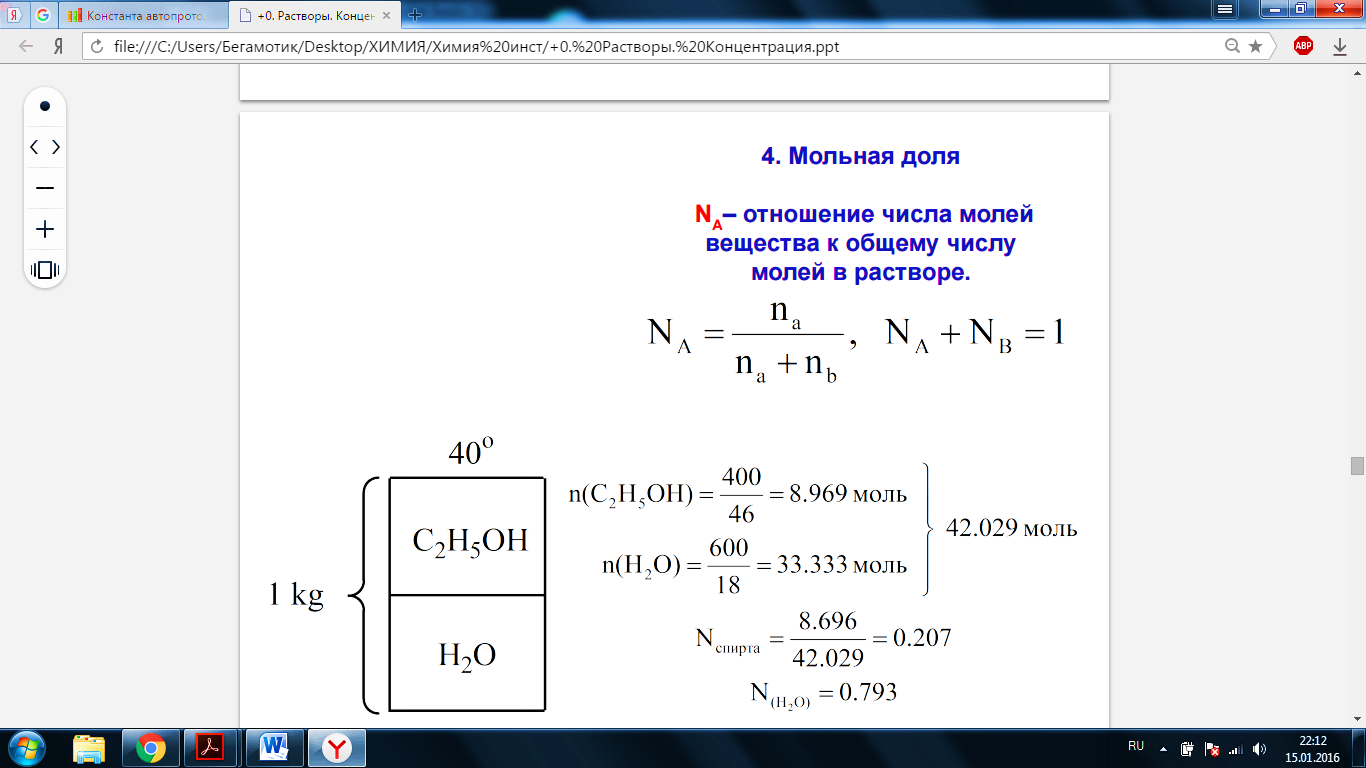
· Мольная доля - отношение числа молей вещества к общему числу молей в растворе.
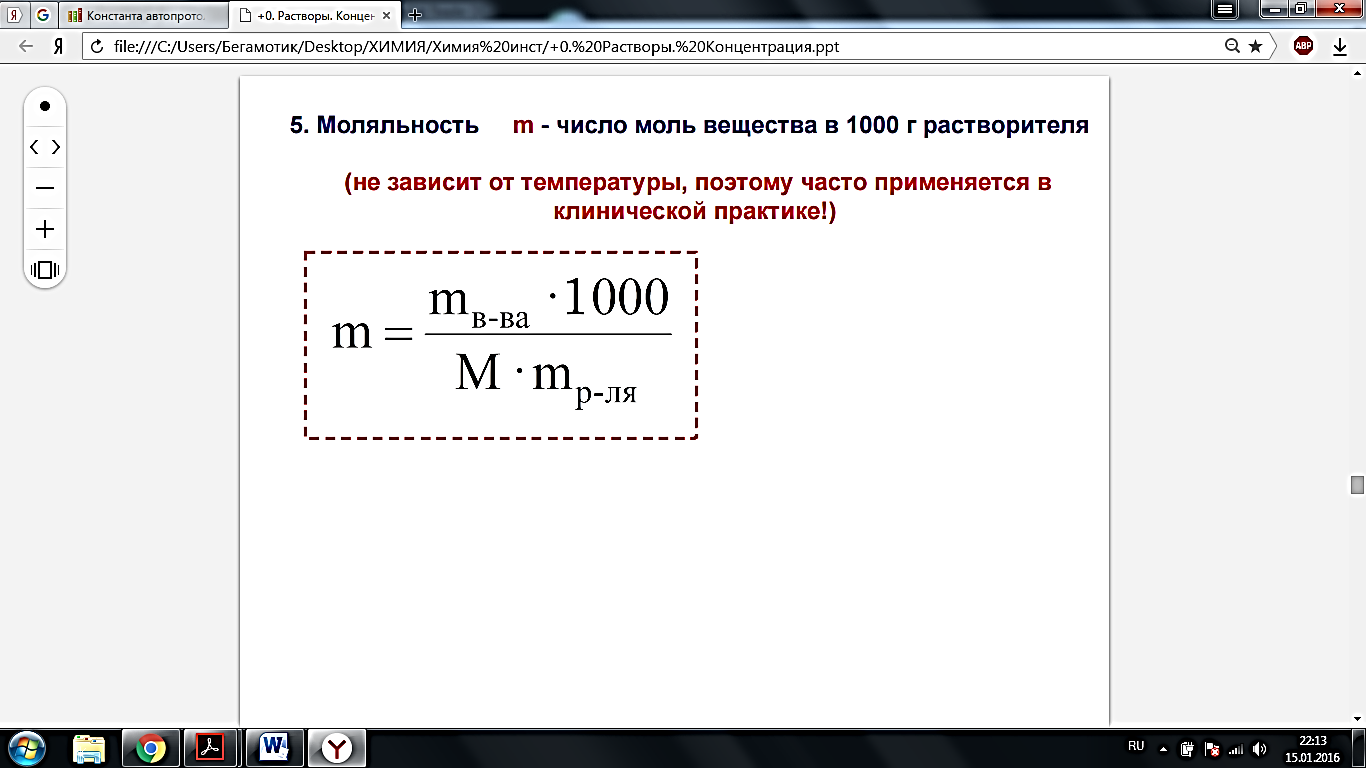
· Моляльность m - число моль вещества в 1000 г растворителя
· Титр раствора Т – число грамм вещества в 1 мл раствора (г/мл). См = 1000 Т/ М ω% = 100 Т · Миллиграмм процент мг % - масса вещества в миллиграммах на 100 мл раствора (мг/ 100 мл)
2. Виды растворов: · По молярной массе растворенного вещества а) истинные растворы – растворы низкомолекулярных соединений. М < 5000 г/моль - б) М > 5000 г/моль - растворы высокомолекулярных соединений (ВМС) · По наличию или отсутствию электролитической диссоциации а) Растворы электролитов – в-ва диссоциируют на ионы б) Растворы неэлектролитов – в-ва практически не диссоциируют в воде в) Растворы амфолитов – в-ва которые могут диссоциировать и по кислотному и по основному типу · По концентрации а) Разбавленные (до 10%) б) Средней концентрации (10-30%) в) Концентрированные (50% и выше) 3. Растворимость(S) –способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе 4. а) Ненасыщенный - раствор, в котором еще можно растворить добавочное количество данного вещества. б) Насыщенный - раствор, в котором данное вещество при данной температуре больше не растворяется
в) пересыщенные – содержащие значительно больше растворенного вещества чем его требуется для насыщения при данной температуре 5. Растворимость газов зависит от природы газа и растворителя, от температуры и давления. а) Растворимость повышается, если между газом и растворителем возможно химическое взаимодействие. б) С повышением температуры растворимость газов уменьшается, а при понижении увеличивается. в) Растворимость газа в жидкости при постоянной температуре прямо пропорциональна его давлению над раствором: ЗАКОН ГЕНРИ С=kp · Закон Генри
· Закон Дальтона
· Закон Сеченова
6. Растворимость газов отличается от растворимости твердых и жидких веществ; с повышением температуры она понижается, а с повышением давления - возрастает. 7. При растворении жидких и твердых веществ энтропия системы обычно возрастает (S > 0 При растворении газов в жидкости энтропия системы обычно уменьшается (S < 0)
В процессе образования раствора энтальпия системы также может как увеличиваться (NaCI), так и уменьшаться (КОН). Изменение энтальпии процесса растворения нужно рассматривать в соответствии с законом Гесса 8. Сольватная теория: Сольвация – процесс взаимодействия растворенных веществ с растворителем. · Растворы – жидкие диссоциированные системы, образованные частицами растворителя, растворенного тела и тех нестойких соединений, которые они образуют · Растворение происходит под влиянием притяжения молекул или ионов кристалла полярными молекулами растворителя. 9. Коллигативные свойства - свойства, которые зависят от количества имеющихся молекул или ионов растворенного вещества, а не от природы растворенных частиц · Понижение давления пара растворителя. · Повышение температуры кипения растворителя. · Понижение температуры замерзания растворителя. · Явление осмотического давления 10. Осмос – самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану Причина осмоса – притяжение молекул воды к молекулам глюкозы, образование водородных связей. Осмотическое давление – минимальное гидравлическое давление, которое нужно приложить к раствору, чтобы осмос прекратился Количественно величина осмотического давления π описывается по закону Вант-Гоффа: π = i сRT где с — молярная концентрация растворенного вещества (моль/л), R — универсальная газо- вая постоянная (831 Дж/моль·К), T — абсолютная температура (К). i =1 для неэлектролитов i >1 для электролитов и диссоциирующих веществ i <1 для веществ, подверженных ассоциации Осмотическое давление плазмы крови человека - 7.4-7.8 атм (740 – 780 кПа)
11. Осмолярность – суммарное молярное количество всех активных частиц, содержащихся в 1 литре раствора 12. Роль осмоса: · Движение соков в растениях · Распределение воды между вне- и внутриклеточной жидкостью · Распределение воды между сосудистым руслом и внесосудистым пространством 13. Изотонические - с одинаковым осмотическим давлением (0.9%)
Гипертонические - с большим осмотическим давлением (>0.9%) Гипотонические - с меньшим осмотическим давлением (<0.9%) 14. Тургор – внутреннее осмотическое давление в живой клетке, вызывающее напряжение клеточной оболочки. Лизис - разрыв клетки при введении гипотонического по отношению к крови раствора Гемолиз - разрыв эритроцитных оболочек при введении гипотонического по отношению к крови раствора Плазмолиз - обезвоживание эритроцитов при введении гипертонического по отношению к крови раствора
1. Криометрия и эбулиометрия, использование их для определения молекулярной массы веществ, значение их в медико-биологических исследованиях. Криоскопия – понижение Т замерзания. Присутствие растворенного вещества понижает температуру замерзания раствора. Причина - молекулам растворителя сложней образовать гомогенные кристаллы твердой фазы
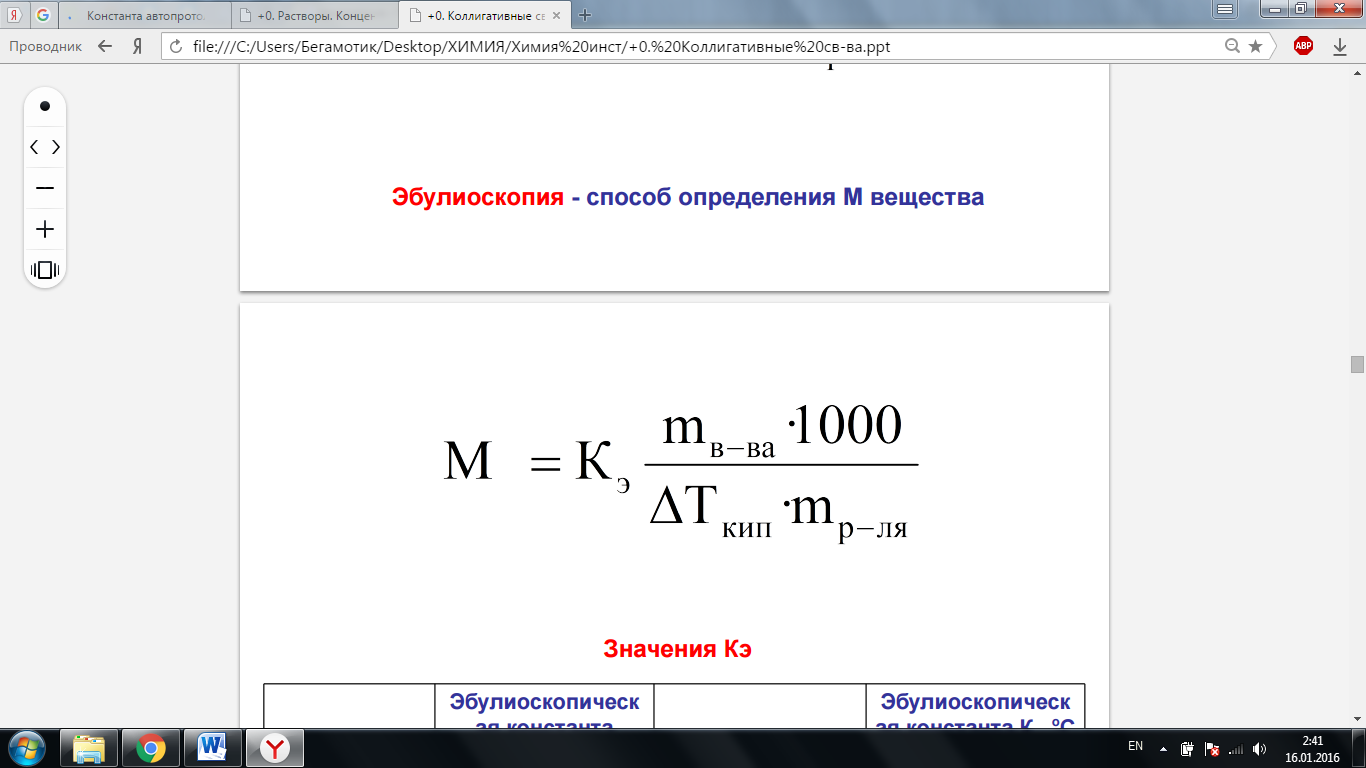
Эбулиоскопия – повышение Ткип. Присутствие растворенного вещества повышает температуру кипения раствора
.
1.Теория электролитической диссоциации. Основные положения. 2.Причина и механизм диссоциации. 3.Влияние природы химической связи растворяемого вещества и растворителя на процесс диссоциации. · Основные положения: · Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные. · Под действием электрического тока ионы приобретают направленное движение: положительно заряженные частицы движутся к катоду, отрицательно заряженные – к аноду. Поэтому положительно заряженные частицы называются катионами, а отрицательно заряженные – анионами. · Направленное движение происходит в результате притяжения их противоположно заряженными электродами (катод заряжен отрицательно, а анод – положительно). · Ионизация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов в молекулы (ассоциация). · Причина: уменьшения сил взаимодействия частиц между собой в растворе по сравнению с их взаимодействием в чистом веществе из-за высокой диэлектрической проницаемости растворителя. Механизм: Вследствие большой диэлектрической постоянной воды (ε = 78,5), ионные связи ослабляются, затем ионы гидратируются. Выделившейся энергии достаточно для распада ионной решетки, поэтому в растворе оказываются свободные заряженные частицы. · Лучше диссоциации подвергаются вещества с ионным типом связи. В случае ковалентных соединений, диссоциации подвергаются только такие связи, которые являются сильно полярными.
1.Теплота гидратации ионов. Факторы, влияющие на теплоту гидратации (размер иона, заряд иона). 2. Активность и коэффициент активности. 3. Ионная сила растворов электролитов
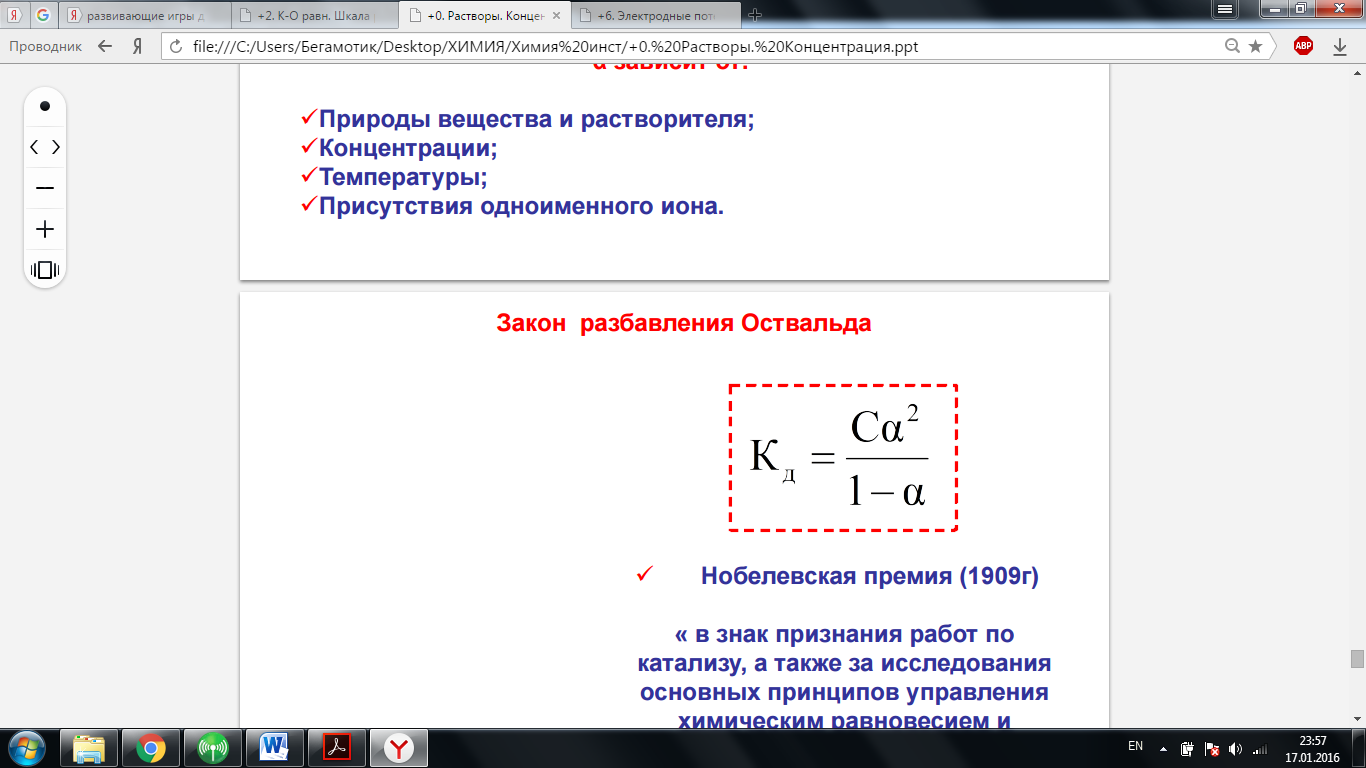
1. В процессе гидратации ионов участвует множество молекул воды, которые, благодаря электростатическим силам, окружают ионы со всех сторон гидратной «шубой», при этом лишь несколько молекул воды образуют первый, наиболее прочно связанный с центральным ионом слой. В целом же при гидратации ионов выделяется значительная энергия, так, при гидратации катионов Н+ выделяется 1076 кДж/моль – это в 2,5 раза больше энергии диссоциации молекул Н2 на атомы. Энергия гидратации тем больше, чем меньше размер иона и чем больше его заряд. 2. Активность иона α(Хi) — это реальная экспериментальная концентрация, в соответствии с которой ион Хi участвует в химических и электрохимических процессах. Активность иона связана с молярной концентрацией следующим соотношением: α(Хi) = γ(Хi)· с Коэффициент активности γ(Хi) показывает долю свободных подвижных ионов от исходного количества электролита. 3. Ионная сила I раствора характеризует интенсивность ион-ионных электростатических взаимодействий в растворах электролитов, где сi — концентрация иона (моль/л), а zi — заряд этого иона, проводится суммирование по всем ионам, находящимся в растворе. Ионная сила существенно возрастает при увеличении заряда ионов. Самой простой теорией, связывающей значение коэффициента активности γi и ионной силы I является теория Дебая–Хюккеля для разбавленных растворов. Уравнение Дебая–Хюккеля: 1. Диссоциация слабых электролитов. 2. Степень диссоциации, константа диссоциации как константа равновесия. 3. Связь степени и константы диссоциации (закон разведения Оствальда). 4. Влияние одноименного иона на диссоциацию слабого электролита. 5. Расчет концентраций ионов в растворах слабых электролитов. 1. Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе): α = cд / cB всегда меньше единицы, но больше нуля (0 < α < 1). 2. Степень диссоциации α равна доли диссоциированного электролита от его исходного количества. Константа диссоциации К — это константа равновесия. Kд=[H+]*[OH-]/[H2O] 3. Закон Оствальда
4. Добавление одноименных ионов уменьшает степень диссоциации 5. Концентрации ионов в растворах слабых электролитов качественно характеризуют степенью и константой диссоциации. Степень диссоциации (a) - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N): a = n / N и выражается в долях единицы или в % (a = 0,3 – условная граница деления на сильные и слабые электролиты).
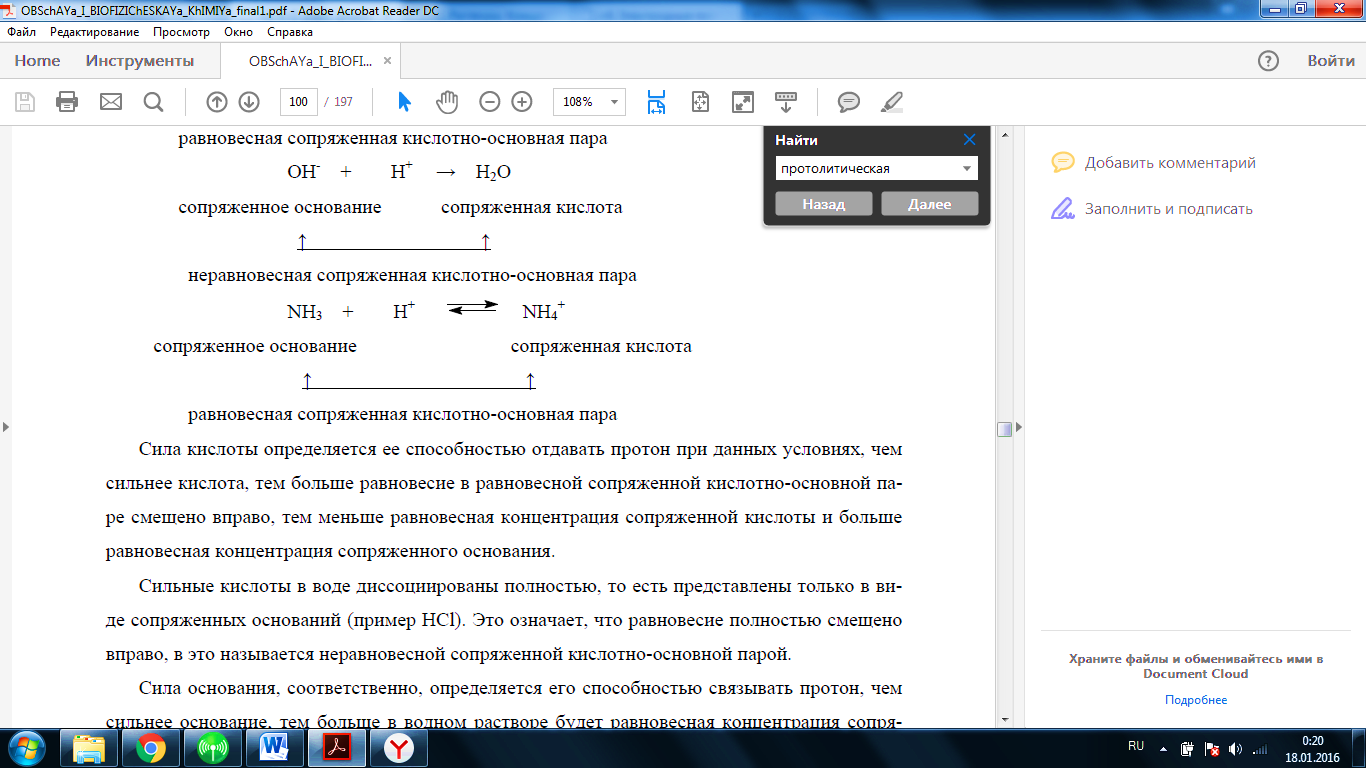
1.Теории кислот и оснований. Протолитическая теория кислот и оснований (теория Бренстеда-Лоури). 2. Сила кислот и оснований. 3. Водные растворы кислот и оснований. 4. Ионное произведение воды. Диссоциация воды - равновесный процесс. Ионное произведение воды как разновидность константы равновесия. 5. Условия нейтральности среды. Кислая и щелочная среда в водных растворах. 6. Расчет концентрации ионов Н+ и ОН- в растворах сильных и слабых кислот и оснований. 7. Водородный и гидроксильный показатели. 8. Расчет рН в растворах сильных и слабых электролитов. 9. Границы изменения рН водных растворов в зависимости от температуры, концентрации электролитов. 1. Кислота — это донор иона водорода Н+, то есть это частица, которая способна отдавать протон. Основание — это акцептор иона водорода Н+, то есть это частица, которая способна связывать протон. 2. · Сила кислоты определяется ее способностью отдавать протон при данных условиях, чем сильнее кислота, тем больше равновесие в равновесной сопряженной кислотно-основной па- ре смещено вправо, тем меньше равновесная концентрация сопряженной кислоты и больше равновесная концентрация сопряженного основания. · Сила основания, соответственно, определяется его способностью связывать протон, чем сильнее основание, тем больше в водном растворе будет равновесная концентрация сопря- женной кислоты и меньше концентрация самого основания, то есть тем больше равновесие в сопряженной паре будет смещено вправо, в сторону сопряженной кислоты. 4. Для количественной характеристики силы кислоты в водных растворах можно использовать константу кислотно-основного равновесия обратимой реакции данной кислоты с водой:
5. Ионное произведение воды: [H+] · [OH-] = 10-14 6. Для сильных электролитов
Для слабых электролитов (кислот) Для слабых электролитов (оснований) 7. ионное произведение воды: [H+] · [OH-] = 10-14 На практике удобнее использовать не степени, а обычные числа, поэтому следует перейти к логарифмам. Вводится водородный показатель: рН = - lg [H+] и гидроксильный показатель (как вспомогательная величина): рОН = –lg [ОH-] В логарифмических единицах то же самое ионное произведение воды: рН + рОН = 14 8. Для сильных Для слабых кислот Для слабых оснований
9. Границы значений рН от 0 до 14 являются экспериментальными, а не следуют из какой бы то ни было теории. В концентрированных растворах сильных кислот концентрация кислоты может быть очень большой, но как было описано выше, в таких растворах существует сильное ион-ионное взаимодействие, поэтому коэффициент активности γ(Н+) стремится к нулю, то есть минимальное значение рН, которое может быть измерено при комнатных температурах составляет –0,16 (округленно 0). А максимальное значение рН, которое может быть зафиксировано в концентрированных растворах щелочей составляет 14,2 (округленно 14). С другой стороны, эти границы рН определяются также и температурой.
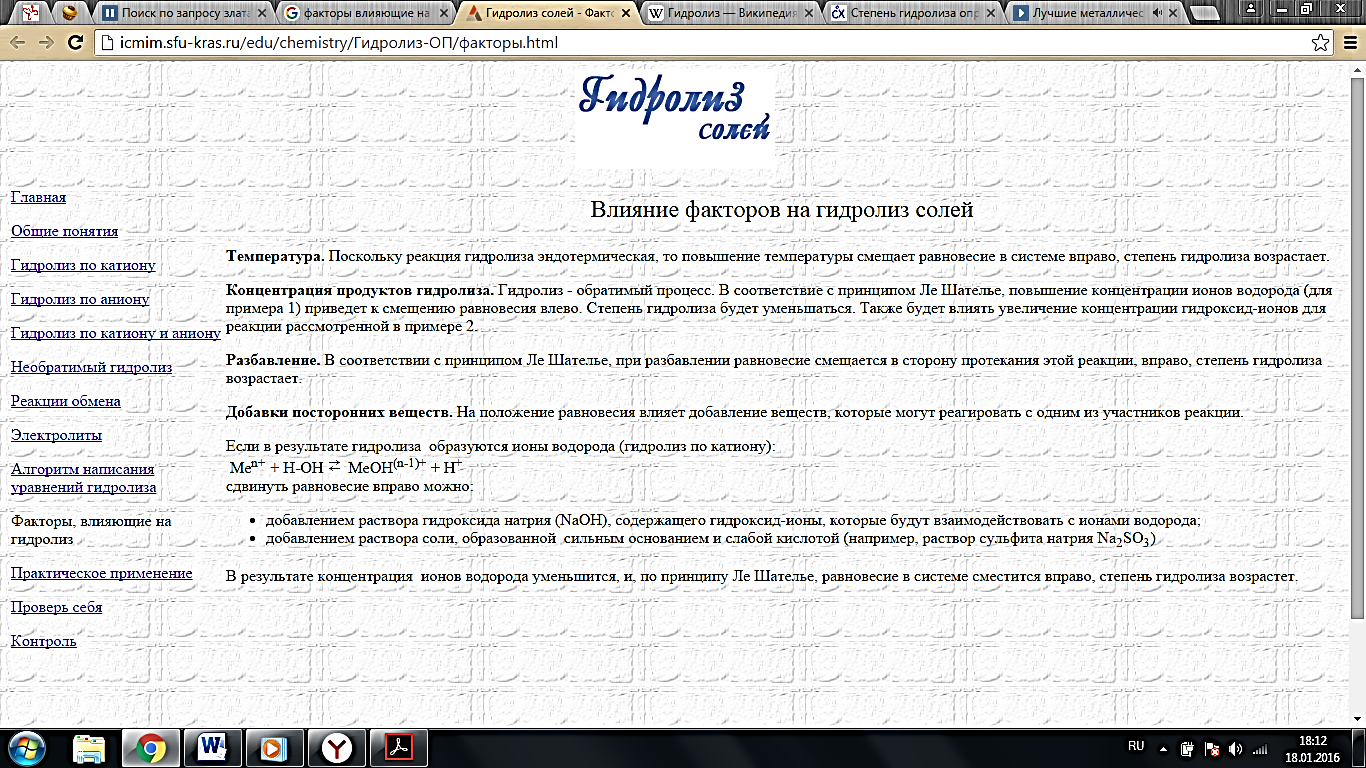
1.Гидролиз солей. Причина и следствие гидролиза. Механизм гидролиза солей. 2. Степень гидролиза и факторы, влияющие на нее. 3. Константа гидролиза как разновидность константы равновесия. Вывод константы гидролиза и связи ее со степенью гидролиза солей. 4. Случаи гидролиза: соли слабой кислоты и сильного основания, соли слабого основания и сильной кислоты, соли слабой кислоты и слабого основания. 5. Реакции среды во всех случаях гидролиза и расчет рН. 6. Гидролиз солей многовалентных ионов. 7. Образование кислых и основных солей при гидролизе. 8. Случаи необратимого гидролиза солей. 9. Роль гидролиза в биохимических процессах (гидролиз АТФ - универсальный источник энергии в организме). 1. Гидролиз солей – процесс взаимодействия ионов соли с составными частями воды. Причина: образование малодиссоциированных соединений Следствие: сдвиг равновесия диссоциации воды, который сопровождается изменением кислотности среды вследствие накопления H+ или OH- ионов Механизм: Процесс гидролиза заключается в переходе протона от молекулы воды к данному иону или от данного иона, в том числе от гидратированного катиона металла, к молекуле воды.
2. Под степенью гидролиза(h) понимается отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. h = (cгидр/cобщ)·100 % При повышении температуры степень гидролиза увеличивается
При повышении концентрации ионов водорода степень гидролиза будет уменьшаться При разбавлении степень гидролиза увеличивается
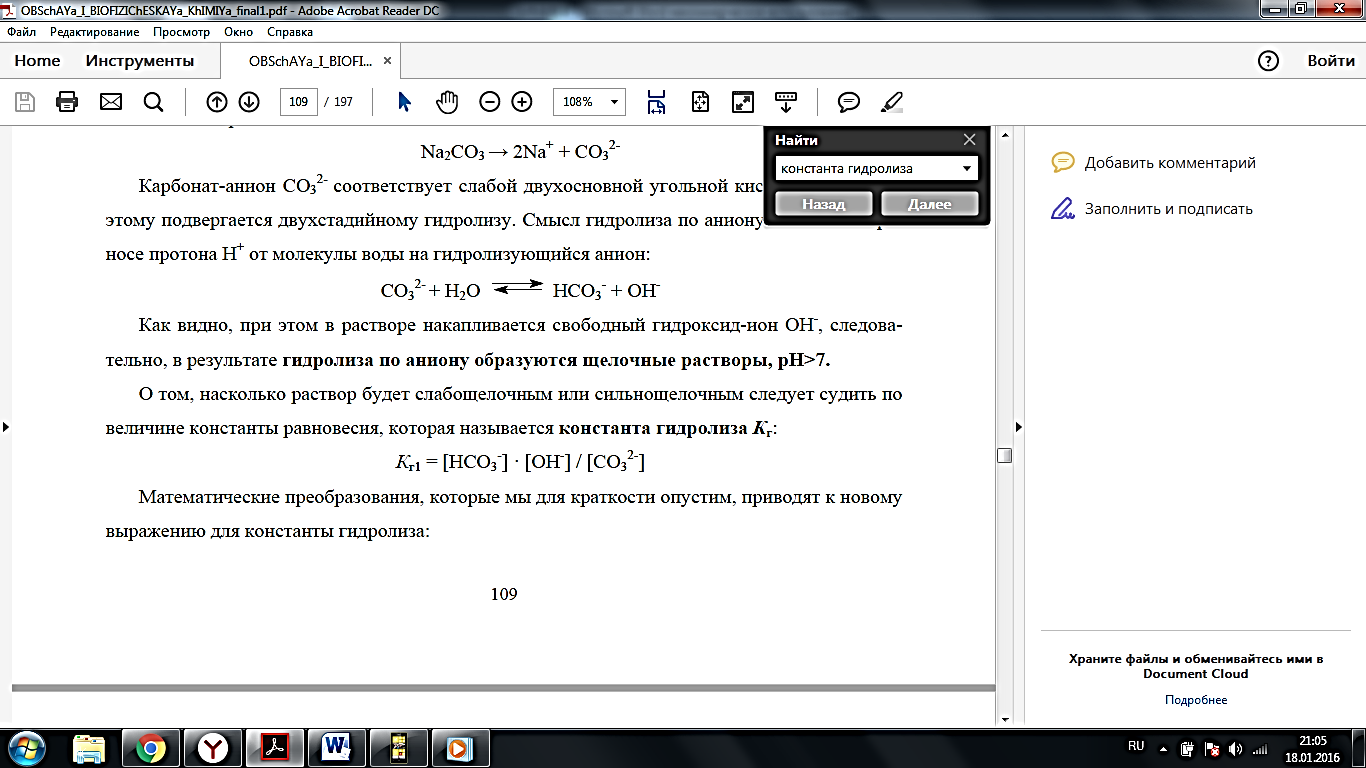
3. константа гидролиза Кг: Кг1 = [НСО3-] · [ОН-] / [СО32-]
4. Случаи гидролиза: · Слабая кислота, сильное основание – среда щелочная
· Сильная кислота, слабое основание – среда кислая Kг = K(H2O)/Kд(H2O)
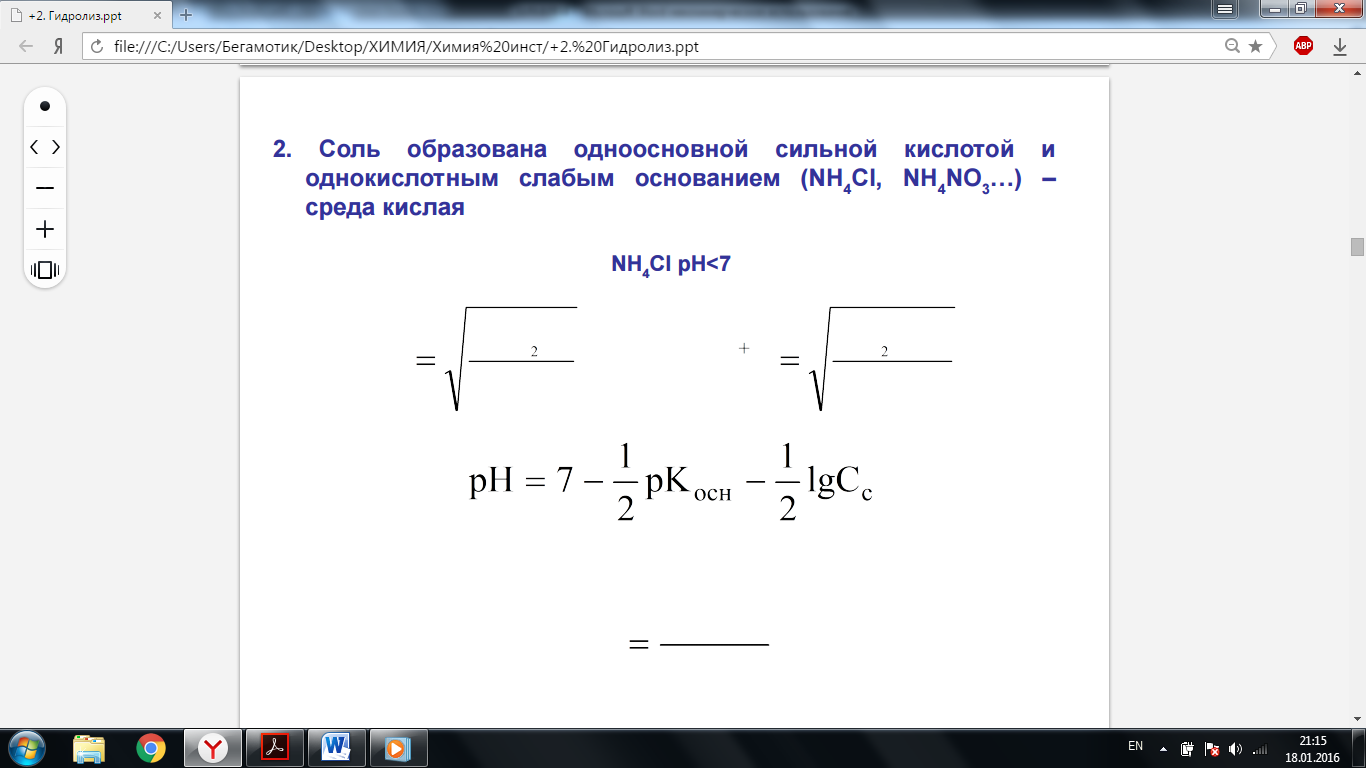
· Слабая кислота, слабое основание – нейтральная среда
Kг= K(H2O)/K(NH4OH)*K(HCN) 5. Щелочная среда Кислая среда Нейтральная среда
6. Ступенчатый гидролиз
7. Образование кислых и основных солей при гидролизе Кислые соли — это соли многоосновных кислот, в анионах которых содержится ион во- дорода Н+, например: калий гидрофосфат К2НРО4 или калий дигидрофосфат КН2РО4. При гидролизе солей образованных слабой кислотой и сильным основанием: Например гидролиз карбоната натрия: Na2CO3 + Н2О = NaHCO3 + NaOH В результате гидролиза образовалась кислая соль NaHCO3 (гидрокарбонат натрия) Основные соли — соли многокислотных оснований (Са(ОН)2), которые в своем составе содержат один или несколько гидроксид-ионов: кальций гидроксохлорид Ca(OH)Cl. · Гидролиз солей, образованных слабым основанием и сильной кислотой ZnCl2 + H2O = Zn(OH)Cl + HCl · Гидролиз солей слабых оснований с солями слабых кислот: 2MgCl2 + 2Na2CO3 + H2O = (MgOH)2CO3 + CO2 + 4NaCl
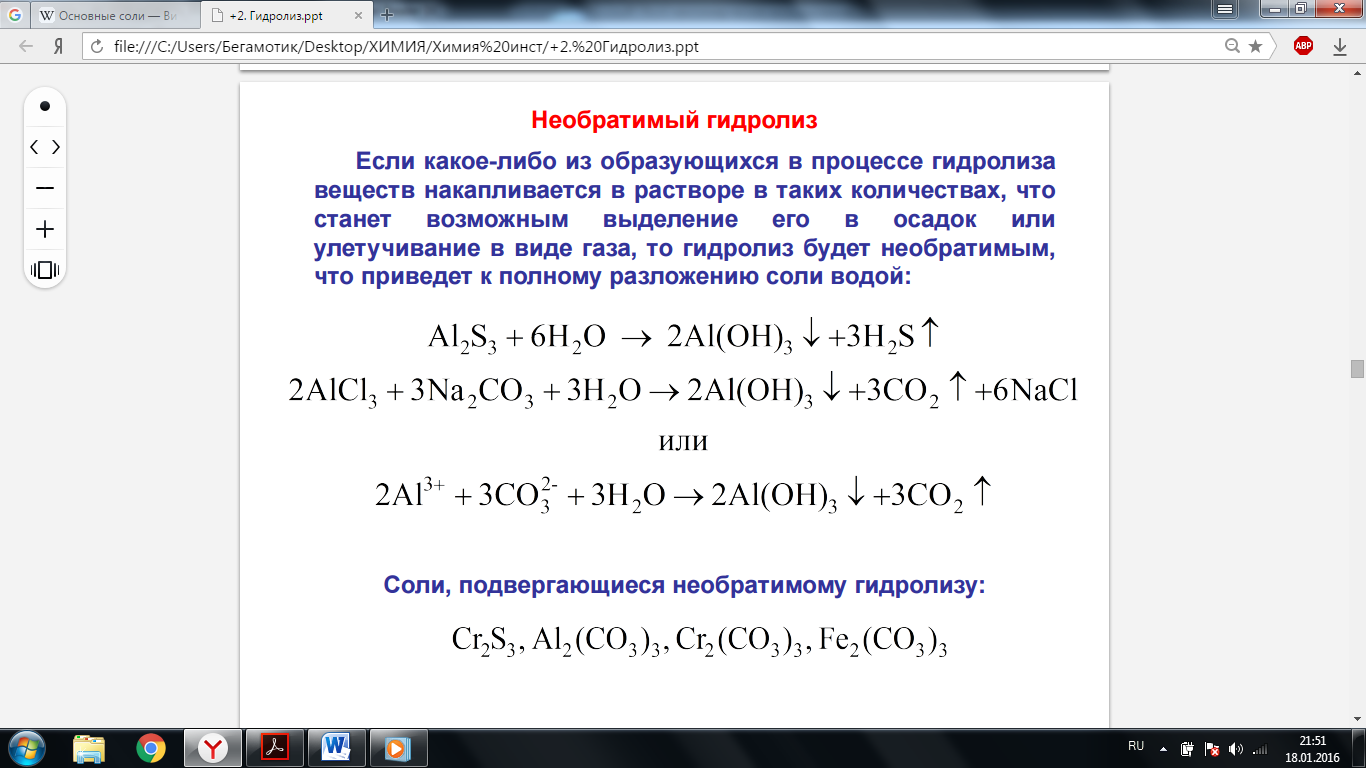
8. Необратимый гидролиз
9. Роль гидролиза: · Каждый из ферментов активен при строго определенных значениях рН · Ионы водорода катализируют гидролиз сложных жиров, сахарозы. · Без ферментативного гидролиза невозможно усвоение пищевых продуктов (жиры, углеводы, белки), так как всасываться в кишечнике способны только относительно небольшие молекулы. · Гидролиз АТФ - источник энергии в организме. Человек получает энергию как за счет многостадийного процесса окисления пищи — белков, жиров и углеводов, так и за счет гидролиза некоторых сложных эфиров, амидов, пептидов и гликозидов. · Гидролиз –один из важнейших путей метаболизма лекарственных препаратов и пищевых продуктов
1.Электролиты в организме человека. Понятие об электролитном составе крови и водно-солевом обмене в организме. 2. Роль рН в биологических жидкостях организма. 1. Состав крови Определение электролитного состава плазмы крови проводится в клинико-химических лабораториях. По сравнению с составом цитоплазмы в плазме крови обращают внимание относительно высокие концентрации ионов Na+, Са2+ и Cl-. Напротив, концентрации ионов К+, Mg2+ и фосфата ниже, чем в клетках. Концентрация белков также ниже, чем в клетках. Электролитный состав плазмы напоминает морскую воду, что указывает на эволюцию форм жизни из моря. Водно-солевой обмен Как было показано, между водой и растворенными веществами существуют различные взаимодействия, особенно интенсивные в случае электролитов. Поэтому в практической ме- дицине часто используется термин водно-электролитный баланс. Концентрация ионов в биологических жидкостях поддерживается примерно постоянной (ионный гомеостаз) за счет баланса между поступлением ионов с пищей и их естественной потерей. При нарушении обмена веществ возникают такие патологические состояния как де- гидратация организма или гипергидратация. Причиной дегидратации организма могут быть избыточная потеря жидкости с мочеотделением, через кожу или легкие при их травмирова- нии, через желудочно-кишечный тракт (понос, рвота) и, естественно, при недостаточном по- ступлении воды в организм. Причиной гипергидратации является введение чрезмерных объ- емов водных растворов как перорально, так и внутривенно. 2. Роль pH Ферменты наиболее активны в пределах узкой зоны рН и соответствуют области физиологических значений.
Подсчитано, что в процессе метаболизма ежесуточно в организме образуется большое количество кислых продуктов. Это может привести к сдвигу рН крови, различных тканевых жидкостей мозга, печени, почек и др., что резко отразится на активности ферментов. Например, сдвиг рН крови на 0,4 единицы приводит к летальному исходу, рН слюны меньше 5 единиц способствует развитию кариеса. Постоянство рН различных биологических жидкостей обеспечивается благодаря наличию в организме многочисленных регулирующих систем: легкие, кишечник, почки, кожа и др.
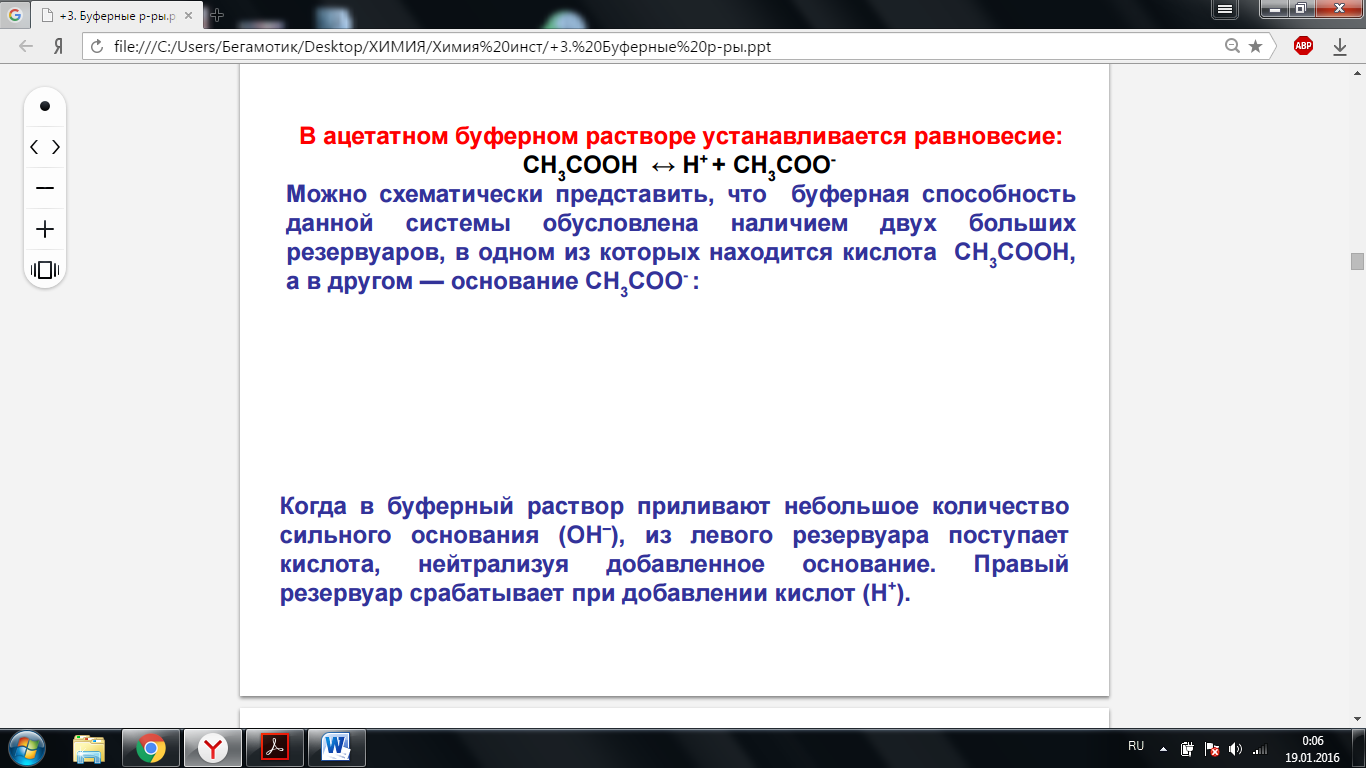
1.Понятие о буферных растворах. 2. Типы буферных растворов. 3. Механизм действия буферных систем. 4. Расчет рН буферных систем, влияние концентрации компонентов, разбавления на рН этих систем. 5. Буферная емкость. 6. Расчет буферных систем и приготовление буферных растворов с заданным значением рН. 7. Буферные системы крови. Бикарбонатный буфер, уравнение Гендерсона-Гассельбаха. 1. Буферные растворы - растворы, величина рН которых практически не изменяется при добавлении к ним сильных кислот или щелочей или при разбавлении. 2. Буферные растворы делятся на кислотные (ацетатный и бикарбонатный) и основные (фосфатный и аммиачный). 3.
4. Расчет pH
При разбавлении (уменьшении концентрации) pH увеличивается 5. Буферная емкость – B - число моль-экв сильной кислоты или щелочи, которое нужно добавить к 1 л буферной системы, чтобы изменить рН на единицу
6. Приготовление
7. Буферные системы крови · Бикарбонатная
Уравнение для расчета pH крови Гендерсона-Гассельбаха.
При увеличении в крови концентрации ионов Н+ происходит выделение СO2, который выводится из организма в процессе дыхания через легкие:
При поступлении в кровь оснований, они связываются угольной кислотой, и равновесие смещается в сторону образования НСО3–:
Нарушение кислотно-основного равновесия в организме компенсируется бикарбонатной буферной системы (за 10-15 мин) Бикарбонатный буфер – основная буферная система плазмы крови и содержится также в эритроцитах, межклеточной жидкости и в почечной ткани.
1. Фосфатный, белковый и гемоглобиновый буферы крови. Механизмы их действия. 2. Роль буферных систем крови в организме человека. 3. Понятие о кислотно-основном состоянии организма. 4. Щелочной резерв крови. 5. Ацидоз и алкалоз. 1. Буферы · Фосфатная
· Белковая
Белковая буферная система поддерживает постоянство рН в клетках и тканях В крови работает анионный белковый буфер. Попадающие на кожу человека небольшие количества кислоты или щелочи довольно быстро нейтрализуются белковой буферной системой. · Гемоглобиновая
2. Роль буферных систем: · Благодаря наличию буферных систем, рН крови остается постоянным (белковая) 7.4 ± 0.04 · Компенсация нарушения кислотно-основного равновесия бикарбонатной системой · Выведение компонентов с мочой фосфатной системой 3. Кислотно-основное состояние организма
4. Щелочной резерв крови - Число мл СО2, содержащееся в 100 мл крови (главным образом в виде гидрокарбонатов НСО3-) Норма: 50-70 % (по объему) или 25-30 ммоль/л 5. Ацидоз – накопление в организме кислых продуктов уменьшение рН крови в сравнении с нормой (уменьшение кислотной буферной емкости в сравнении с нормой) Дыхательный ацидоз - Избыток СО2 (вследствие понижения легочной вентиляции по сравнению с нормой) Алкалоз – накопление в организме щелочных продуктов увеличение рН крови в сравнении с нормой (увеличение кислотной буферной емкости в сравнении с нормой) Дыхательный алкалоз – Недостаток СО2 в связи с повышением легочной вентиляции, в сравнении с нормой
1. Применение реакции нейтрализации в фармакотерапии: лекарственные средства с кислотными и основными свойствами (гидрокарбонат натрия, оксид и пероксид магния, трисамин и др.). Лечение ацидоза Лечение алкалоза
1. Гетерогенные реакции в растворах электролитов. Константа растворимости (произведение растворимости - ПР). 2. Конкуренция за катион или анион: изолированное и совмещенное гетерогенные равновесия в растворах электролитов. 3. Условия образования и растворения осадков. 4. Реакции, лежащие в основе образования неорганического вещества костной тк
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 369; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.220.114 (0.269 с.) |
 Температурный коэффициент
Температурный коэффициент 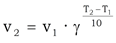 изменяется от 2 до 4.
изменяется от 2 до 4.



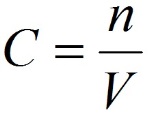







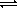 А
А 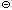 + H3O
+ H3O 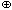 .
.