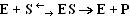Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярность элементарного акта реакции.
1. Химическая кинетика – наука о скоростях и закономерностях протекания химических процессов во времени. Химическая кинетика изучает промежуточные стадии, состоящие из элементарных актов, через которые система переходит из начального состояния в конечное. Химическая кинетика изучает скорости этих стадий и факторы, влияющие на их скорость. 2. Скорость химической реакции - количество элементарных актов реакции, совершающихся в единицу времени Средняя скорость реакции в интервале - количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы. Количество вещества выражают в МОЛЯХ, а объем в ЛИТРАХ. В этом случае мы получаем удобную для работы величину - КОНЦЕНТРАЦИЮ вещества в моль/л, которая ИЗМЕНЯЕТСЯ в ходе реакции.Отсюда другое определение скорости реакции: Средняя скорость реакции в интервале - ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или продукта в единицу времени.
Истинная скорость - Предельная величина Δc/Δt, когда Δt стремится к нулю как к своему пределу (Δt → 0) υ = lim (± Δc/Δt) = ± dc/dt, 3. По числу фаз реакции делятся на три типа: гомогенные, гетерогенные и микрогетерогенные Гомогенные реакции - реакции, которые идут в какой-нибудь одной фазе – газовой или жидкой Гетерогенные реакции – реакции, происходящие на границах раздела фаз – между газообразным веществом и раствором, между раствором и твердым веществом, между твердым и газообразным веществами.
Микрогетерогенная (ферментативная) реакция - фермент (Е) взаимодействует с субстратом (S), в результате образуется фермент-субстратный комплекс, который затем распадается с высвобождением фермента и продукта (Р) реакции:
По механизму реакции бывают простые и сложные. Простые реакции- те, которые протекают только в одну стадию. Например, разложение галогенов: I2 = 2I.
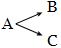
Если же реакция протекает в несколько стадий, то она является сложной. Например, реакция разложения пероксида водорода записывается суммарным уравнением: 2Н2О2 = 2Н2О + О2 Однако эта реакция протекает в две стадии и является сложной: Н2О2 = Н2О + О Сложные реакции в свою очередь делят на последовательные, параллельные и сопряженные. Последовательные - реакции с промежуточными стадиями типа А → В → С. Параллельные - исходные вещества реагируют сразу в нескольких направлениях: Сопряженные - реакции, из которых одна протекает лишь совместно с другой. Цепные - реакции, состоящие из ряда взаимосвязанных стадий, когда частицы, образующиеся в результате каждой стадии, генерируют последующие стадии.
4. В основе классификации по числу частиц лежит молекулярность реакции - это минимальное число молекул, принимающих участие в акте химического взаимодействия. Выделяют мономолекулярные, бимолекулярные и тримолекулярные. Для того, чтобы молекулы прореагировали, они должны сблизиться на расстояние порядка атомных размеров, когда электроны атомов одной молекулы попадут в сферу действия электронов атомов другой молекулы. Такое сближение молекул называют столкновением. Но не при любом столкновении молекулы взаимодействуют. Столкновения, при которых молекулы реагируют, называют элементарными актами. Мономолекулярные реакции - реакции разложения молекул: I2 = 2I. К бимолекулярным реакциям относятся взаимодействия двух одинаковых или различных молекул: Н2 + I2 = 2НI,. К тримолекулярным относятся реакции вида: 2NO + Н2 = N2O+Н2O (a) или Н2 + 2О2 = 2Н2O, (b)
1.Кинетические уравнения. Порядок реакции. Период полупревращения.
|
|||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 103; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.227.194 (0.006 с.) |
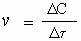 где v - скорость реакции, ΔC - изменение концентрации (в моль/л), а Δτ - интервал времени, в течение которого это изменение произошло (сек). Следовательно, размерность у скорости реакции такая: "моль/л · сек". Скорость реакции всегда считается величиной положительной, но отношение Δc/Δt может быть отрицательным, если υ изучается по изменению концентрации исходных веществ.
где v - скорость реакции, ΔC - изменение концентрации (в моль/л), а Δτ - интервал времени, в течение которого это изменение произошло (сек). Следовательно, размерность у скорости реакции такая: "моль/л · сек". Скорость реакции всегда считается величиной положительной, но отношение Δc/Δt может быть отрицательным, если υ изучается по изменению концентрации исходных веществ.