
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предмет и методы химической термодинамики.Стр 1 из 14Следующая ⇒
Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики. 1. Термодинамика – наука о превращении одних веществ в другие.
Термодинамический метод (Феноменологический) Для описания процессов обмена энергией и свойств различных тел в термодинамике используются физические понятия и величины. Такие величины называются феноменологическими или термодинамическими. Термодинамическими величинами, например, являются температура, давление, плотность. Недостаток этого метода заключается в том, что для его применения требуется знание физических свойств конкретных рабочих тел, которые не могут быть определены методами термодинамики и требуют экспериментального исследования. Но если известны некоторые данные о свойствах веществ или систем, то термодинамический метод позволяет получить интересные и важные выводы.
Статистический метод Поведение элементарных частиц описывается методами классической либо квантовой механики Статистический метод исследований обладает преимуществом перед феноменологическим при описании свойств веществ при предельно низких или максимально высоких температурах и давлениях, когда непосредственное измерение термодинамических величин становится весьма трудным и неточным.
Таким образом, термодинамика и статистическая физика как науки о свойствах вещества и энергии взаимно дополняют друг друга.
2. Термодинамической системой называется всякий объект природы, состоящий из достаточно большого числа молекул (структурных единиц) и отделенный от других объектов природы реальной или воображаемой гра–ничной поверхностью (границей раздела).
Объекты природы, не входящие в систему, называют–ся средой.
Наиболее общими характеристиками систем являются – масса вещества, содержащегося в системе, и Е – внутренняя энергия системы. Масса вещества системы определяется совокупностью масс молекул, из которых она состоит. Внутренняя энергия системы представляет собой сумму энергий теплового движения молекул и энергии взаимодействия между ними.
Системы по характеру обмена веществом и энергией с окружающей средой подразделяют на три типа: изолированные, закрытые и открытые.
Изолированной системой - нет обмена ни веществом ни энергией Закрытой системой – обмен только энергией Открытой системой называется такая система, которая может обмениваться со средой как веществом, так и энергией (живая клетка)
3. Теоретической базой биоэнергетики является химическая термодинамика. В основе жизни лежит обмен веществ, который сопровождается процессами превращения энергии. Для понимания этих процессов необходимы знания основ биоэнергетики и термодинамики.
Биоэнергетика – наука, изучающая трансформацию энергии в живых системах.
Первый закон биоэнергетики Живая клетка избегает прямого использования энергии внешних ресурсов для совершения полезной работы. Она сначала превращает ее в одну из трех форм энергии. А именно в АТФ, натриевый потенциал (Δ μNa+), протонный потенциал (Δ μН) Второй закон биоэнергетики Любая живая клетка всегда располагает как минимум двумя формами энергии: энергией макроэргических связей АТФ и энергией, связанной с мембраной (Δ μН+ либо Δ μNa+). Третий закон биоэнергетики Энергетические формы могут превращаться одна в другую. Поэтому получение хотя бы одной из них за счет внешних ресурсов достаточно для поддержания жизнедеятельности.
1. Основные понятия термодинамики. 2. Интенсивные и экстенсивные параметры. 3. Функция состояния. 4. Внутренняя энергия. 5. Работа и теплота - две формы передачи энергии. 6. Типы термодинамических систем (изолированные, закрытые, открытые). 7. Типы термодинамических процессов (изотермические, изобарные, изохорные). 8. Стандартное состояние. 9. Теплота - неупорядоченная форма передачи энергии в результате контакта непрерывно движущихся микрочастиц.
1. Основные понятия Работа - форма передачи энергии, связанная с преодолением внешнего сопротивления. Энергия - мера перехода одной формы движения в другую; Система - это тело или совокупность тел, выделенных из пространства. Все, что окружает систему, называют средой. Часть системы, имеющая одинаковые во всем объеме физические и химические свойства и отделенная от других частей поверхностью раздела, называется фазой.
2. Физические величины, характеризующие какое-либо свойство системы, называются термодинамическими параметрами. Они могут быть микроскопическими и макроскопическими.
Макроскопические параметры - Величины, характеризующие всю систему в целом (давление, объем, температура, масса, плотность и т.д.) Макроскопические параметры делятся на 2 группы: экстенсивные и интенсивные параметры. · Экстенсивными называются такие параметры, значения которых для всей системы равны сумме значений этих же параметров для отдельных частей системы (например, масса, объем). · Значения интенсивных параметров одинаковы как для всей системы в целом, так и для любой ее части (например, температура, давление, плотность).
3. Функция состояния – функция, зависящая от нескольких независимых параметров, которые определяют состояние системы Термодинамические функции: Внутренняя энергия(U), Энтальпия(H), Энтропия(S), Свободная энергия Гиббса(G)
4. Внутренняя энергия – такая энергия тела, за счет которой может совершаться механическая работа, не вызывая пот этом убыли механической энергии этого тела
5. Работа – количественная мера направленного движения молекул в одностороннем направлении Теплота – количественная мера хаотического движения молекул в данной системе
6. Системы по характеру обмена веществом и энергией с окружающей средой подразделяют на три типа: изолированные, закрытые и открытые.
Изолированной системой - нет обмена ни веществом ни энергией Закрытой системой – обмен только энергией Открытой системой называется такая система, которая может обмениваться со средой как веществом, так и энергией (живая клетка)обратимым, если его можно провести и в прямом, и в обратном направлении через одни и те же промежуточные стадии, без каких-либо энергетических изменений в окружающей среде.
7. Типы термодинамических процессов: изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермический, происходящий при постоянной температуре;
8. Состояние стандартное (с.с.) – состояние термодинамической системы, при котором значения некоторых термодинамических функций принимаются за начало отсчета для этих функций. P=101,325 кПа(1 атм) t=298 K
Энтальпия. 3. Стандартная энтальпия образования вещества Энтропия. Энергия Гиббса. Примеры экзергонических и эндергонических процессов, протекающих в организме. Энтропия
1. В изолированных системах самопроизвольно протекают только процессы, не сопровождающиеся уменьшением энтропии.
2. Обратимый процесс – процесс, в котором энтропия в замкнутой системе, включающей все участвующие в процессе тела, сохраняется. Этот процесс связан с изменением внешних условий.
3. Энтропия – мера беспорядка системы, состоящей из многих элементов
4. Энергия Гиббса(свободная) – функция, учитывающая оба фактора G = H - TS (TS-характеризует ту часть энергии, которую нельзя превратить в работу)
5. Энергия Гельмгольца – критерий направленности самопроизвольного протекания процесса. ▲ F =▲ U - T ▲ S ▲F<0 самопроизвольный ▲F=0 равновесный ▲F>0 несамопроизвольный
6. Условия равновесия: В изолированной системе – максимум энтропии, ▲G<0
7. Стандартная Энергия Гиббса образования вещества - ΔG°, изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии Для простых веществ равна нулю
8. Стандартная Энергия Гиббса реакции – разность между суммой энергий образования продуктов реакции и суммой энергий образования исходных веществ, умноженных на соответствующее количество вещества
9. Экзергонические реакции –системой совершается работа (гидролиз АТФ): Эндергонические реакции – над системой совершается работа (фосфорилирование глюкозы) 10. Принцип энергетического сопряжения, заключается в том, что энергия, необходимая для протекания эндергонической реакции, поступает за счет осуществления экзергонической реакции
Химическое равновесие. Период полупревращения. Роль стерического фактора. Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Поверхностная энергия Гиббса и поверхностное натяжение. Адсорбция. Уравнение Гиббса. Поверхностно-активные и поверхностно-неактивные вещества. Изменение поверхностной активности в гомологических рядах (правило Траубе). Изотерма адсорбции. Ориентация молекул в поверхностном слое и структура биомембран. 1) Адсорбция Абсорбция Абсорбция – поглощение вещества всей массой адсорбента. Причиной адсорбции на поверхности твердых тел является нескомпенсированность силовых полей молекул, находящихся в зонах деформации кристаллических структур. Такие зоны называют активными центрами. Различают физическую и химическую адсорбцию (хемосорб). Физическая адсорбция обусловлена силами межмолекулярного взаимодействия (силами Вандер-Ваальса; в ряде случаев – водородными связями); она происходит, как правило, на активных центрах, находящихся во впадинах микрорельефа поверхности.
Центры химической адсорбции (хемосорбции) находятся в основном на выступах микрорельефа; при хемосорбции возникают химические связи между атомами, входящими в состав активного центра, и атомами адсорбирующего вещества. 2) Поверхностная энергия Гиббса и поверхностное натяжение
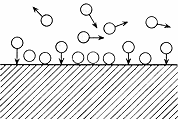
Поверхностное натяжение σ –величина, измеряемая энергией Гиббса. Причина адсорбции – уменьшение поверхностного натяжения (энергии) σ численно равна работе, которую необходимо совершить в данной системе для образования в ней единицы поверхности раздела фаз при постоянной температуре. Каждая из «глубинных» молекул жидкости притягивается друг к другу.Молекулы, находящиеся на поверхности, испытывают особенно сильное притяжение друг к другу. Каждая жидкость с поверхности как бы покрыта особой самостягивающейся пленкой, состоящей из слоя толщиной в одну молекулу.Эти силы, стягивающие поверхность жидкости, и называются поверхностным натяжением. Чем больше силы сцепления между молекулами, тем больше σ. 3) Адсорбция Адсорбция – процесс, самопроизвольного накопления одного вещества на поверхности другого (экзотермический) Обратный процесс – десорбция (эндотермический)
Адсорбент – вещество, на поверхности которого происходит адсорбция. ü гидрофильные: силикагель, глины, пористое стекло ü гидрофобные: активированный уголь, графит, тальк Адсорбтив – вещество, которое накапливается на поверхности. 4) Уравнение Гиббса
5) Поверхностно-активные и поверхностно-неактивные вещества Изотерма поверхностного натяжения при добавлении к чистому растворителю различных веществ Поверхностно инактивные вещества Поверхностно неактивные вещества Поверхностно активные вещества ПИВ ∆σ/∆С > 0 - кислоты, основания, соли ПНВ ∆σ/∆С = 0 глюкоза, сахароза ПАВ ∆σ/∆С < 0 - соли высших карбоновых кислот (мыла), - высшие предельные спирты, - ЧАО (четвертичные аммониевые основания) -основания тетраалкиламмония, а также его соли Антимикробное действие ПАВ связывают с их влиянием на проницаемость клеточных мембран, а также ингибирующим действием на ферментативные системы микроорганизмов. Четвертичные аммониевые основания (ЧАО) обладают ярко выраженной антифаговой активностью. Они приблизительно в 300 раз эффективнее фенола по губительному действию в отношении микроорганизмов и применяются в в хирургии в качестве антисептиков.
К неиногенным ПАВ, применяемым в медицине, относятся твины (сложные эфиры ангидросорбита и жирных кислот, алкилированных окисью этилена),
и спаны (сложные эфиры сорбита и жирных кислот), имеющие общую формулу В качестве примера ЧАО, применяемых в медицине, можно привести цетилтриметил – аммония бромид
анионных ПАВ – натрия лаурилсульфат
6) Изменение поверхностной активности в гомологических рядах (правило Траубе)
Правило Дюкло–Траубе. Увеличение радикала на одну –СН2– группу увеличивает адсорбцию органических веществ в полярном растворителе в 3-3,5 раза. 7) Изотерма адсорбции 1. Изотерма Ленгмюра
ü гладкие адсорбенты; ü концентрации адсорбтива большие и малые; ü границы раздела фаз: тв – г, тв – ж, ж – ж; ü слой мономолекулярный. Г∞ - предельная величина адсорбции; К - константа адсорбционного равновесия (отношение констант скоростей процессов десорбции и адсорбции); Ср - равновесная концентрация адсорбтива,
2. S-образная изотерма БЭТ (Брунауэр, Эммет, Теллер) ü поверхность гладкая; ü концентрации средние и высокие; ü границы раздела фаз: тв-г, тв-ж, ж-г, ж-ж; ü слой полимолекулярный. 3. Изотерма Фрейндлиха
концентрации средние; границы раздела фаз: тв-г, тв-ж.
8) Ориентация молекул в поверхностном слое и структура биомембран Представления об ориентации молекул ПАВ в насыщенном адсорбционном слое сыграло важную роль в развитии учения о структуре биологических мембран В 1925 году Е.Горшнер и Г.Грендел установили, что площадь мономолекулярного слоя липидов вдвое больше суммарной поверхности эритроцитов. Используя этот факт, Ф.Даниэли и Г.Давсон предложили (1933) модель биологической мембраны основным элементом которой является бимолекулярный слой из липидов. Полярные группировки липидов направлены наружу, неполярные - внутрь. Макромолекулы интегральных белков, пронизывающих мембрану, образуют ионные каналы, обладающие избирательной проницаемостью для различных ионов.
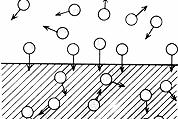
Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция. Адсорбция газов на твёрдых телах. Адсорбция из растворов. Уравнение Ленгмюра. Зависимость величины адсорбции от различных факторов. Правило выравнивания полярностей. Избирательная адсорбция. Значение адсорбционных процессов для жизнедеятельности. Физико-химические основы адсорбционной терапии, гемосорбции, применения в медицине ионитов. Хроматографические методы. Применение тонкослойной, бумажной, газо-жидкостной, высокоэффективной жидкостной, молекулярно-ситовой хроматографии в медико-биологических исследованиях. 1) Адсорбционные равновесия на неподвижных границах раздела фаз Особенности адсорбции на твердых поверхностях (теории И. Ленгмюра и М. Поляни): 1. Адсорбция происходит на активных центрах поверхности
Рис. 1. Поглощенные частицы на активных центрах 2. Процесс адсорбции динамический. Одновременно происходит десорбция. 3. Радиус действия адсорбционных (межмолекулярных) сил мал. 2) Физическая адсорбция и хемосорбция Причиной адсорбции на поверхности твердых тел является нескомпенсированность силовых полей молекул, находящихся в зонах деформации кристаллических структур. Такие зоны называют активными центрами. Различают физическую и химическую адсорбцию (хемосорб). Физическая адсорбция обусловлена силами межмолекулярного взаимодействия (силами Вандер-Ваальса; в ряде случаев – водородными связями); она происходит, как правило, на активных центрах, находящихся во впадинах микрорельефа поверхности. Центры химической адсорбции (хемосорбции) находятся в основном на выступах микрорельефа; при хемосорбции возникают химические связи между атомами, входящими в состав активного центра, и атомами адсорбирующего вещества. Различия между физической адсорбцией и хемосорбцией заключается в следующем: 1) теплоты хемосорбции (80 – 800 кДж/моль) значительно больше теплот физической адсорбции (8 – 20 кДж/моль); по своим значениям теплоты хемосорбции близки теплоты обычных химических реакций; 2) хемосорбция является специфическим процессом, в то время как физическая адсорбция – процесс неспецифический. 3) с увеличением температуры величина физической адсорбции уменьшается, а хемосорбции увеличивается. Явление поглощения газов на границе твердое тело – газ (адсорбция газов твердыми телами) было открыто в конце XVIII в. независимо шведским химиком и фармацевтом К. Шееле (1773) и итальянским проф. Ф. Фонтана (1777). Фонтана обнаружил, что свежепрокаленный древесный уголь обладает способностью поглощать различные газы в объемах, значительно превосходящих его собственный объем. К. Шееле установил, что в ряде случаев этот процесс обратим: при изменении условий поглощенный газ может выделяться. Адсорбцию из растворов случайно открыл фармацевт Т. Ловиц (1785). Термин адсорбция ввел Г. Кайзер в 1881 г. У адсорбции на твердых поверхностях совсем иная область применения, чем у адсорбции на подвижных поверхностях. Там главное значение имеет снижение поверхностного натяжения. С помощью адсорбции на твердой поверхности производится очистка газов и растворов, разделение и анализ смесей (хроматография), изучение пористой структуры материалов. 3) Адсорбция газов на твёрдых телах. Под адсорбцией на твердых поверхностях подразумевается поглощение газов и компонентов жидких растворов на этих поверхностях. Явление поглощения газов на границе твердое тело – газ (адсорбция газов твердыми телами) было открыто в конце XVIII в. независимо шведским химиком и фармацевтом К. Шееле (1773) и итальянским проф. Ф. Фонтана (1777). Фонтана обнаружил, что свежепрокаленный древесный уголь обладает способностью поглощать различные газы в объемах, значительно превосходящих его собственный объем. К. Шееле установил, что в ряде случаев этот процесс обратим: при изменении условий поглощенный газ может выделяться. Адсорбцию из растворов случайно открыл фармацевт Т. Ловиц (1785). Термин адсорбция ввел Г. Кайзер в 1881 г. У адсорбции на твердых поверхностях совсем иная область применения, чем у адсорбции на подвижных поверхностях. Там главное значение имеет снижение поверхностного натяжения. С помощью адсорбции на твердой поверхности производится очистка газов и растворов, разделение и анализ смесей (хроматография), изучение пористой структуры материалов. Твердое вещество, на поверхности которого идет адсорбция, называется адсорбент. Вещество, которое адсорбируется на твердой поверхности, называется адсорбат. Адсорбент должен иметь большую удельную поверхность, без чего не возможно его эффективное действие. Это материалы, состоящие из мелких частиц (силикагель, каолин), или пористые и пронизанные трещинами материалы (уголь, активированный уголь). Активированный уголь марки БАУ – расшифровывается как березовый активированный уголь. Принципиально важные для адсорбции особенности твердых поверхностей – это их шероховатость, наличие трещин, пор, царапин. Идеально гладкие твердые поверхности это редкость, и в процессах адсорбции они не применяются. Непосредственно измерить истинную площадь твердой поверхности невозможно, и для ее определения применяются сложные методы, основанные на все той же адсорбции. Наблюдаемые неровности – микродефекты превышают атомные размеры в десятки и сотни раз (десятки нанометров). Наличие таких микродефектов обусловливает некоторый избыточный запас поверхностной энергии Гиббса системы. Адсорбция а на твердой поверхности выражается не количеством адсорбированного вещества на единицу площади, а количеством вещества на единицу массы адсорбента: 4)
Адсорбция обусловлена силами, действующими на поверхности адсорбента. Эти силы имеют ту же природу, что и силы молекулярного притяжения (ван-дер-ваальсовы силы), обусловливающие, например, конденсацию пара в жидкость. Силовое поле частиц адсорбента, расположенных на его поверхности, компенсированы частично. Поэтому на поверхности адсорбента действуют остаточные силы, способные притягивать молекулы веществ, находящихся в контакте с поверхностью адсорбента. В энергетическом отношении участки поверхности твердого тела неравноценны. Адсорбция в первую очередь происходит на участках поверхности с наибольшим локальным запасом поверхностной энергии Гиббса. В зависимости от характера действующих сил различают физическуюи химическуюадсорбцию. Для физической адсорбции характерны небольшая теплота (∆H от –4 до –40 кДж/моль) и обратимость процесса. Адсорбция газов твердыми телами протекает с большой скоростью, поэтому адсорбционное равновесие устанавливается практически мгновенно: А X АХ
Теплоты химической адсорбции находятся в пределах от –40 до –400 кДж/моль и по своему характеру процесс является необратимым. При взаимодействии газа с адсорбентом наряду с адсорбцией, представляющей собой типично поверхностный процесс, может происходить поглощение газа или пара всем объемом твердого тела, а также их конденсация в узких порах (капиллярная конденсация). В реальных условиях эти процессы протекают совместно. Разделить или идентифицировать их в большинстве случаев трудно. Поэтому для характеристики взаимодействия адсорбента с адсорбтивом применяется более общий термин – сорбция. Под сорбцией понимаются все виды поглощения вещества на адсорбенте. 5) Адсорбция из растворов Явление адсорбции поверхностью твердого тела вещества из раствора сложнее адсорбции газов, паров и чистых жидкостей, так как в этом случае наряду с адсорбатом будет наблюдаться и конкурентная адсорбция растворителя. Кроме того имеет место взаимодействие молекул адсорбата с молекулами среды. Обычно различают адсорбцию электролитов и неэлектролитов.
Количество вещества, адсорбированного 1 г адсорбента из раствора, определяют по формуле а = m – масса адсорбента, г, 1000 - переводной множитель в ммоль/г. Концентрационная зависимость адсорбции из растворов характеризуется обычной изотермой адсорбции. Для достаточно разбавленных растворов можно пользоваться уравнением Фрейндлиха или уравнением Ленгмюра. Величина гиббсовской адсорбции определяется экспериментально. Если общее число молей в растворе равно n, мольная доля адсорбата до адсорбции N0, при равновесии N, то Г = n(N0–N)/msуд, (4.2) где m – масса адсорбента, sуд – удельная поверхность адсорбента. Так как природа среды влияет на адсорбцию, то для оценки поведения растворителя можно пользоваться рядом критериев. Чем больше поверхностное натяжение среды, тем хуже ее молекулы адсорбируются на твердом теле. Другой критерий пригодности растворителя как среды для адсорбции – теплота смачивания адсорбента растворителем. Она определяется по формуле 6)
Q = sуд(E1 – E2), (6.3)
где Е1 и Е2 – полная поверхностная энергия на границе адсорбент–воздух и адсорбент–жидкость. Обычно теплота составляет 1–20 кал/г адсорбента. Чем выше теплота адсорбции, тем лучше растворитель взаимодействует с адсорбентом, тем худшей средой он будет для адсорбции. Можно принять, что чем лучше среда растворяет адсорбат, тем хуже в этой среде идет адсорбция. Адсорбенты бывают полярные и неполярные. Считается, что неполярные адсорбенты лучше адсорбируют неполярные вещества и наоборот. При увеличении пористости адсорбента возрастает адсорбция малых молекул адсорбата из раствора. Крупные молекулы не попадают в узкие поры, и адсорбция уменьшается. Это может привести к обращению правила Дюкло–Траубе. При оценке свойств адсорбента пользуются правилом Ребиндера: вещество С может адсорбироваться на поверхности раздела фаз А и B, если его наличие в поверхностном слое приводит к уравниванию разности полярностей этих фаз. Для примера можно взять диэлектрическую проницаемость. Для выполнения правила необходимо соблюдение соотношения e A > eC > eB, или eA < e C < eB. Из правила следует, что чем больше разность полярностей между растворимым веществом и раствором, т. е. меньше растворимость вещества, тем лучше оно будет адсорбироваться. Согласно правилу, дифильные молекулы ПАВ адсорбируются на границе так, что полярная часть обращена к полярной фазе и наоборот. Исходя из этого можно утверждать, что все полярные гидрофильные поверхности должны хорошо адсорбировать ПАВ из неполярных или слабо полярных жидкостей, а неполярные гидрофобные поверхности хорошо адсорбировать ПАВ из полярных жидкостей. С увеличением молекулярного веса адсорбата его способность адсорбироваться возрастает. Ароматические соединения адсорбируются лучше алифатических. Из-за транспортных ограничений адсорбция в растворах идет медленно. Время установления адсорбционного равновесия возрастает с увеличением молекулярного веса кислоты. С ростом температуры адсорбция из раствора снижается, но в меньшей степени, чем адсорбция газов. 7) Уравнение Ленгмюра (описано выше) 8) Зависимость величины адсорбции от различных факторов Адсорбция зависит от природы и концентрации адсорбата, температуры, природы адсорбента и растворителя, удельной поверхности адсорбента. 9) Правило выравнивания полярностей Возможность молекулярной адсорбции какого-либо вещества можно определять на основеправила уравнивания полярностей (П. А. Ребиндер, 1927 г.): вещество С может адсорбироваться на поверхности раздела фаз А и В, если адсорбционный слой уменьшает разность полярностей на границе раздела этих фаз. Правило уравнивания полярностей широко используется для управления многими поверхностными явлениями, в том числе смачиванием. АДСОРБЦИЯ ИЗБИРАТЕЛЬНАЯ — процесс, основанный на неодинаковой способности отдельных компонентов газовой или жидкой смеси поглощаться из данного растворителя данным адсорбентом. Она является основой метода разделения многокомпонентных смесей, называемого хроматографией. 10) Избирательная адсорбция Избирательнаяадсорбция ( специфическаяадсорбция ) –необратимая адсорбция ионов, имеющихся в составе кристаллической решетки твердого тела илиизоморфных им. Явление избирательной адсорбции токсинов тканями и клетками наблюдаются в организме человека: ü токсины возбудителей столбняка и ботулизма поражают ЦНС; ü токсины возбудителей дизентерии – вегетативную нервную систему. 11) Значение адсорбционных процессов для жизнедеятельности Живые организмы представляют собой системы с очень развитыми поверхностями раздела, к которым относят кожные покровы, поверхность стенок кровеносных сосудов, слизистые оболочки, клеточные мембраны, мембраны ядер, митохондрий, лизосом. 12) Физико-химические основы адсорбционной терапии, гемосорбции, применения в медицине ионитов Разделение и очистка аминокислот и белков (пепсин (рI=2), химотрипсин (рI=8.6) помещаются в аммиачный буфер с рН = 8.4. Пепсин заряжается отрицательно (рН>рI) и при пропускании смеси через катионит не вступает в реакцию обмена. Положительно заряженный химотрипсин (рН<рI) будет адсорбироваться на катионите 2. Консервирование крови 3. Изменение солевого состава молока 4. Лечение отеков и ацидоза 5. Очистка сточных вод 6. Удаление ионов металлов (Fe3+, Cu2+ и Ca2+), вызывающих помутнение вин 13) Хроматографические методы Хроматография - динамический метод анализа, основанный на многократно повторяющихся процессах адсорбции и десорбции. Тонкослойная хроматография Метод тонкослойной хроматографии (ТСХ), получивший в настоящее время широкое распространение, был разработан Н.А. Измайловым и М.С. Шрайбер в 1938 г. В методе ТСХ неподвижная твердая фаза тонким слоем наносится на стеклянную, металлическую или пластмассовую пластинку. В 2–3 см от края пластинки на стартовую линию вносят пробу анализируемой жидкости и край пластинки погружают в растворитель, который действует как подвижная фаза жидкостной адсорбционной хроматографии. Под действием капиллярных сил растворитель движется вдоль слоя сорбента и с разной скоростью переносит компоненты смеси, что приводит к их разделению. Диффузия в тонком слое происходит в продольном и поперечном направлениях, поэтому процесс следует рассматривать как двумерный. Сорбционные свойства системы в ТСХ характеризуются подвижностью, т.е. величиной Rf, которая рассчитывается из экспериментальных данных по уравнению: Rf = Х i / Xf где Х i - расстояние от стартовой линии до центра зоны i -го компонента; Xf - расстояние, пройденное за это же время растворителем.
Основные элементы установок ТСХ Подложки для сорбента (пластинки) обычно изготавливают из стекла, алюминиевой фольги или полиэфирной пленки. В качестве сорбента в ТСХ применяют силикагели, оксид алюминия, крахмал, целлюлозу. Выбор растворителя зависит от природы сорбента и свойств анализируемых соединений. Часто применяют смеси растворителей из двух или трех компонентов. По окончании хроматографирования непроточным методом зоны на хроматограмме проявляют химическим или физическим способом. При химическом способе пластинку опрыскивают раствором реактива, взаимодействующего с компонентами смеси. В физических способах проявления используется способность некоторых веществ флуоресцировать под действием ультрафиолетового излучения, часто при добавлении флуоресцирующего индикатора, взаимодействующего с компонентами смеси. После проявления хроматограммы приступают к идентификации веществ и дальнейшему анализу.
Качественный анализ в ТСХ Наиболее общий подход к качественному анализу основан на значениях Rf. Хроматографическая подвижность является чувствительной характеристикой вещества, однако она существенно зависит от условий определения. При соблюдении стандартных условий получаются воспроизводимые значения Rf, которые можно использовать в аналитических целях при сравнении с табличными, если они получены в тех же условиях опыта. Самым надежным является методом свидетелей, когда на стартовую линию рядом с пробой наносятся индивидуальные вещества, соответствующие предполагаемым компонентам смеси. Влияние различных факторов на все вещества будут одинаковым, поэтому совпадение Rf компонента пробы и одного из свидетелей дает основание для отожествления веществ с учетом возможных наложений. Несовпадение Rf интерпретируется более однозначно: оно указывает на отсутствие в пробе соответствующего компонента. На практике стандартное вещество (свидетель) в том же растворителе наносится на стартовую линию вместе с анализируемой пробой и хроматографируется в тех же условиях.
Количественный анализ в ТСХ Количественные определения в ТСХ могут быть сделаны непосредственно на пластинке, либо после удаления вещества с пластинки. При непосредственном определении на пластинке измеряют тем или иным методом площадь пятна (например, с помощью миллиметровой кальки) и по заранее построенному градуировочному графику находят количество вещества. Наиболее точным считается метод, в котором вещество после разделения удаляется с пластинки и анализируется спектрофотометрическим или иным методом. Удаление вещества с пластинки обычно производят механическим путем, хотя иногда применяют вымывание подходящим растворителем.
Ионообменная хроматография Ионообменная хроматография основана на обратимом стехиометрическом обмене ионов, находящихся в растворе, на ионы, входящие в состав ионообменника. Применяемые в настоящее время синтетические ионообменники обладают рядом важных достоинств: они имеют высокую обменную емкость и воспроизводимые ионообменные и другие свойства, устойчивы к действию кислот и оснований, не разрушаются в присутствии многих окислителей и восстановителей. Обычно синтетический ионообменни
|
||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 117; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.219.65 (0.154 с.) |


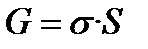
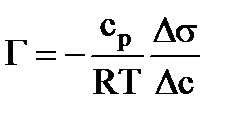

 ,
, .
.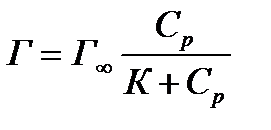
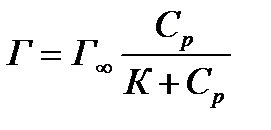 Жидкость-газ
Жидкость-газ
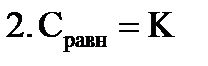
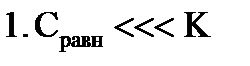
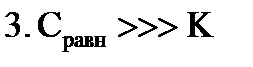
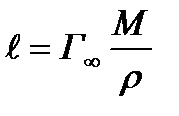 Определение длины молекул ПАВ.
Определение длины молекул ПАВ.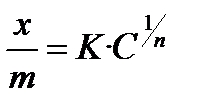 адсорбент пористый;
адсорбент пористый;
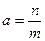
 Адсорбент + Адсорбат Адсорбционный комплекс.
Адсорбент + Адсорбат Адсорбционный комплекс.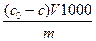 , (4.1) где Со и С – начальная и равновесная концентрации, моль/л, V – объем раствора, л,
, (4.1) где Со и С – начальная и равновесная концентрации, моль/л, V – объем раствора, л,


