
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Факторы, влияющие на устойчивость лиозолей
Факторы устойчивости коллоидных растворов: наличие электрического заряда коллоидных частиц. Частицы несут одноименный заряд, поэтому при встрече частицы отталкиваются; способность к сольватации (гидратации) ионов диффузного слоя. Чем более гидратированы ионы в диффузном слое, тем толще общая гидратная оболочка, тем стабильнее система. Упругие силы сольватных слоев оказывают расклинивающее действие на дисперсные частицы и не дают им сближаться; адсорбционно-структурирующие свойства систем. Третий фактор связан с адсорбционными свойствами дисперсных систем. На развитой поверхности дисперсной фазы легко абсорбируются молекулы поверхностно-активных веществ (ПАВ) и высокомолекулярных соединений (ВМС). Большие размеры молекул, несущих собственные сольватные слои, создают на поверхности частиц адсорбционно-сольватные слои значительной протяженности и плотности. Такие системы по устойчивости близки к лиофильным системам. Все эти слои обладают определенной структурой, создают по П.А. Ребиндеру структурно-механический барьер на пути сближения дисперсных частичек.
2) Коагуляция. Коагуляция — объединение мелких диспергированных частиц в бо́льшие по размеру агрегаты. 3) Порог коагуляции и его определение, правило Шульце-Гарди, явление привыкания. Порог коагуляции – это наименьшая концентрация электролита в миллимолях на один литр, при которой после прибавления этого электролита начинается явная коагуляция коллоидного раствора. Если для коагуляции взято 10 мл золя, то порог коагуляции можно вычислить по формуле: П = 100 ∙ С ∙ V, где П – порог коагуляции, С – молярная концентрация электролита, V – наименьшее число миллилитров раствора электролита, необходимое для начала явной коагуляции, 100 – множитель для перехода к одному литру. Величина, обратная порогу коагуляции, называется коагулирующей способностью (К): К = 1 / П Правило Шульце-Гарди: коагуляцию коллоидных растворов вызывает не весь электролит, а только тот его ион, который противоположен по заряду гранулы. Причем чем выше заряд коагулирующего иона, тем меньше этого вещества необходимо для коагуляции. Явление привыкания было обнаружено более сорока лет тому назад Шпрингом и Фрейндлихом 2 на коагуляции гидрозолей сульфидов. Было замечено, что если для коагуляции AsaSs золя требуется при одновременном приливании определенное количество ВаСЬ, то этого количества недостаточно для коагуляции того же золя, если прибавление раствора ВаСЬ вести постепенно малыми порциями (в течение нескольких часов или даже нескольких дней), в последнем случае, чтобы получить коагуляцию, приходится прибавлять избыток электролита.
4) Взаимная коагуляция. · Взаимная коагуляция золей происходит при взаимодействии друг с другом мицелл противоположно заряженных золей. Так как коагулируют оба золя, коагуляцию называют взаимной. · · Наиболее полной взаимная коагуляция бывает тогда, когда число разноименных электрических зарядов на частицах обоих золей будет одинаково. · · Явление взаимной коагуляции используют при очистке воды от глинистой мути. В воду добавляют алюмокалиевые квасцы, которые, гидролизуясь, образуют положительно заряженный золь гидроксида алюминия. Встречаясь с отрицательно заряженными частицами глины, он заставляет их коагулировать. Коагулят выпадает в осадок, который отфильтровывают или декантируют (сливают воду). Взаимная коагуляция золей широко распространена в природе и играет важную роль в ряде технологических процессов. Так, образование илистых отложений в дельтах рек связано со смешением морской и речной воды. Ионы солей морской воды адсорбируются на заряженных частицах коллоидов речной воды, в результате чего происходит их коагуляция. Это процесс приводит к скапливанию ила на дне. Большую роль играет процесс взаимной коагуляции в образовании почвенных коллоидов.
5 ) Понятие о современных теориях коагуляции. 1. адсорбционная теория коагуляции Фрейндлиха Предполагал, что при коагуляции золей ионы-коагуляторы адсорбируются коллоидными частицами в соответствии с изотермой адсорбции по форме подобной параболе. Коагуляция наступает при одинаковом понижении электрокинетического потенциала (ξ-потенциала), которое достигается при адсорбции эквивалентных количеств различных ионов. 2. электростатическая теория коагуляции Мюллера
Введение электролита в золь не изменяет общего заряда в двойном слое частицы, а вызывает сжатие диффузного слоя. Уменьшение толщины ионной атмосферы приводит к снижению ξ-потенциала что и уменьшает стабильность золя. 3. теория устойчивости гидрофобных дисперсных систем ДЛФО (Дерягин, Ландау, Фервей, Овербек) Между любыми частицами при их сближении возникает расклинивающее давление разделяющей жидкой прослойки в результате действия сил притяжения и отталкивания. Состояние системы зависит от баланса энергии притяжения и отталкивания. Преобладание энергии отталкивания приводит к устойчивости системы. Наблюдается положительное расклинивающее давление. Преобладание энергии притяжения вызывает нарушение агрегативной устойчивости, т.е. коагуляцию за счет создания отрицательного расклинивающего давления. Составляющие расклинивающего давления имеют различную природу: - электростатическую, обусловленную взаимным перекрыванием ДЭС (двойного электрического слоя); - адсорбционную, связанную с адсорбцией молекул стабилизатора; - структурную, возникающую при образовании граничных слоев растворителя и обусловливающую создание адсорбционно-сольватного барьера в лиофильных системах; - молекулярную, обусловленную ван-дер-ваальсовыми силами притяжения. Первые три составляющие вносят положительный вклад в расклинивающее давление, молекулярная составляющая – отрицательное. 7) Коллоидная защита и пептизация Пептизация — процесс перехода коллоидного осадка или геля в коллоидный раствор под действием жидкости или добавленных к ней веществ, хорошо адсорбирующихся осадком или гелем, называемых в этом случае пептизаторами (например, пептизация жиров под действием желчи). Пептизация — разъединение агрегатов частиц гелей (студней) или рыхлых осадков под влиянием определенных веществ — пептизаторов после коагуляции коллоидных растворов. В результате пептизации осадок (или гель) переходит во взвешенное состояние. Пептизаторы, адсорбируясь на частицах геля (или коагулята), увеличивают гидратацию и заряд его частиц, что приводит к ослаблению связи между ними. При долгом хранении гелей или осадков их способность к П. уменьшается. Часто П. вызывается ионами или молекулами добавленных извне веществ, которые, адсорбируясь на поверхности частиц, увеличивают их гидратацию. Иногда П. происходит под действием веществ, образующихся в результате частичного растворения геля. Однако чаще пептизация обусловлена удалением ионов, вызвавших коагуляцию; эти ионы могут быть удалены с поверхности частиц добавлением веществ, образующих с ионами нерастворимые соединения. П. зависит от соотношения количеств пептизатора и осадка. Если пептизатора недостаточно для П., то действие его выражается в разрыхлении структуры геля. П. играет большую роль в живых организмах, среди явлений неживой природы (П. глин и других минералов) и в технике.
Биологически важные коллоидные ПАВ (мыла, детергенты, желчные кислоты). Мицеллообразование в растворах ПАВ. Определение критической концентрации мицеллообразования. Липосомы. Коллоидными ПАВ называют поверхностно-активные вещества, способные в растворах образовывать мицеллы, т.е. ассоциаты, состоящие из большого количества молекул ПАВ (от 20 до 100).
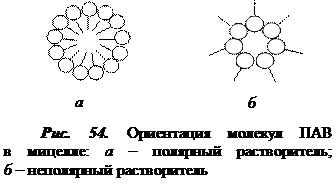
Способностью к мицеллообразованию обладают ПАВ с длинной углеводородной цепью, включающей 10 – 20 атомов углерода. Для коллоидных ПАВ характерно оптимальное соотношение между гидрофобной и гидрофильной частями, т.е ГЛБ» 7. При образовании мицелл в полярном растворителе, например, воде углеводородные цепи молекул ПАВ объединяются в компактное углеводородное ядро, а гидратированные полярные группы, обращенные в сторону водной фазы, образуют гидрофильную оболочку (рис. 54, а). Мицеллы образуются и в неводных растворах ПАВ. Ориентация молекул ПАВ в неполярных растворителях противоположна, т.е. углеводородный радикал обращен к неполярной жидкости (рис. 54, б).
За счет высокой степени ассоциации молекул ПАВ в мицелле между нею и дисперсионной средой существует граница раздела. В связи с этим мицеллярные растворы ПАВ обнаруживают свойства, присущие коллоидно-дисперсным системам: светорассеяние, повышенную вязкость и т.п. Поэтому растворы коллоидных ПАВ относят к дисперсным системам.
Коллоидные растворы ПАВ несмотря на гетерогенность и очень большую межфазную поверхность Одним из характерных свойств растворов коллоидных ПАВ, связанных с их мицеллярным строением является солюбилизация – растворение в растворах коллоидных ПАВ веществ, которые в данной жидкости обычно нерастворимы.
Другим важным свойством растворов коллоидных ПАВ является их моющее действие. Как правило, частицы загрязняющих веществ гидрофобны и не смачиваются водой. Поэтому даже при высокой температуре моющее действие воды очень мало и для его увеличения добавляют коллоидные ПАВ. При контакте моющего средства с загрязненной поверхностью молекулы ПАВ образуют адсорбционный слой на частицах грязи и очищаемой поверхности. Молекулы ПАВ постепенно проникают между частицами загрязнения и поверхностью, способствуя отрыванию частиц грязи (рис. 57). Загрязняющее вещество попадает внутрь мицеллы и больше не может оседать на отмываемой поверхности.
Сущность титриметрического (объёмного) анализа. Основные понятия: титрование, точка эквивалентности, индикаторы, титранты. стандартные вещества и растворы. Требования к стандартным веществам. Требования к реакциям в титриметричсском анализе. Классификация методов. Аналитическая посуда. 1)
2) Титрование- процесс постепенного добавления раствора с известной концентрацией к определенному объему исследуемого раствора до момента окончания реакции, что фиксируется по изменению окраски индикатора.
3) Точка эквивалентности (конечная точка титрования) в титриметрическом анализе- момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце.
4) Индикаторы - органические вещества, изменяющие окраску в зависимости от кислотности среды - рН раствора.
5) Титра́нт (в титриметрическом анализе) — реагент с точно известным титром (концентрацией), добавляемый к исследуемому раствору для количественного анализа содержащихся в нем веществ или их элементов (ионов, функциональных групп).
6) стандартные вещества и растворы- не знаю, что тут писать
7) Требования к стандартным веществам:
1Состав вещества должен соответствовать формуле. 2.Вещество не должно быть гигроскопичным и хорошо растворимым в воде. 3. Должны быть устойчивы при хранении на воздухе 4. Должны быть без примесей, хорошо очищаться 5. Должно иметь большую молярную массу.
8) Требования к реакциям в титриметричсском анализе:
1.Реакция должна протекать в соответствии со стехиометрическим уравнением реакции и должна быть практически необратима. 2. Результат реакции должен отображать количество анализируемого вещества. Константа равновесия реакции должна быть достаточно велика.
3. Реакция должна протекать без побочных реакций, иначе нельзя применить закон эквивалентов. 4. Реакция должна протекать с достаточно большой скоростью, т.е. за 1-3 секунды. Это главное достоинство титриметрического анализа. 5. Должен существовать способ фиксирования точки эквивалентности. Окончание реакции должно определяться достаточно легко и просто.
Если реакция не удовлетворяет хотя бы одному из этих требований, она не может быть использована в титриметрическом анализе!
9) Классификация методов:
1.Нейтрализации Н+ + ОН- = Н2О
2. Окислительно-восстановительные I2 + 2ē = 2I- MnO4- + 8H+ + 5ē = Mn2+ + 4Н2О
3. Комплексообразования
Ag+ + 2CN- → [Ag(CN)2]-
4. Осаждения Ag+ + Cl- = AgCl↓
10) Аналитическая посуда.
Мерная посуда- цилиндры, мерные стаканы, мерные колбы, пипетки, бюретки; Посуда из фарфора- тигель, чашка для выпаривания, ступка с пестиком, кружки, воронки Бюхнера Колбы- плоскодонные, круглодонные, колба Вюрца, конические Стаканы- с носиком, без носика Пробирки- простая, градуированная, микро, центрифужно коническая. Весы Колба Бунзена
Способы выражения концентраций растворов. Понятия: эквивалент, фактор эквивалентности, молярная масса эквивалента, закон эквивалентов и его следствие. Основные способы выражения концентрации растворов: массовая доля, молярная концентрация (молярность) и молярная концентрация эквивалента (нормальность) вещества, титр, моляльная концентрация, молярная доля, титр.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 1203; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.174.174 (0.058 с.) |
 Концентрация ПАВ, при которой в растворе возникают мицеллы, называется критической концентрацией мицеллобразования (ККМ). Изотермы поверхностного натяжения растворов коллоидных ПАВ вместо обычного плавного хода, описываемого уравнением Шишковского, обнаруживают при
Концентрация ПАВ, при которой в растворе возникают мицеллы, называется критической концентрацией мицеллобразования (ККМ). Изотермы поверхностного натяжения растворов коллоидных ПАВ вместо обычного плавного хода, описываемого уравнением Шишковского, обнаруживают при  Механизм солюбилизации заключается в проникновении неполярных молекул веществ, добавленных в раствор ПАВ в неполярное ядро мицеллы (или наоборот: полярных – в полярное ядро) (рис. 56). При этом углеводородные цепи раздвигаются и объем мицеллы увеличивается. В результате солюбилизации в водных растворах ПАВ растворяются углеводородные жидкости: бензин, керосин, а также жиры, которые нерастворимы в воде.
Механизм солюбилизации заключается в проникновении неполярных молекул веществ, добавленных в раствор ПАВ в неполярное ядро мицеллы (или наоборот: полярных – в полярное ядро) (рис. 56). При этом углеводородные цепи раздвигаются и объем мицеллы увеличивается. В результате солюбилизации в водных растворах ПАВ растворяются углеводородные жидкости: бензин, керосин, а также жиры, которые нерастворимы в воде.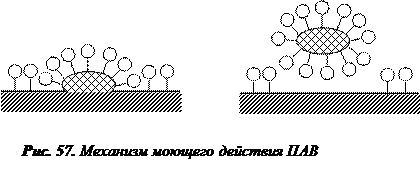
 Титриметрический анализ - метод количественного анализа, основанный на измерении количеств реагента(чаще всего объема растворас точно известной концентрацией), необходимого для взаимодействия с определяемым компонентом в растворе.
Титриметрический анализ - метод количественного анализа, основанный на измерении количеств реагента(чаще всего объема растворас точно известной концентрацией), необходимого для взаимодействия с определяемым компонентом в растворе.


