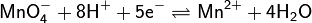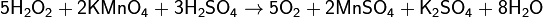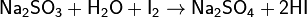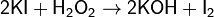Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Перманганатометрия и иодометрия. Значение методов. Определение окислителей и восстановителей. Условия проведения реакций, фиксирование точки эквивалентности.
1) Оксидиметрия — титриметрические методы в аналитической химии, основанные на реакциях окисления-восстановления Оксидиметрию классифицируют в зависимости от применяемого в данной реакции раствора вещества — окислителя или восстановителя. К оксидиметрии относятся: · перманганатометрия · цериметрия · хроматометрия · иодометрия · броматометрия · ванадатометрия 2) Индикация точки эквивалентности- в титриметрическом анализе момент титрования, когда числоэквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. В некоторых случаях наблюдают несколько точек эквивалентности, следующих одна за другой, например, при титровании многоосновных кислот или же при титровании раствора, в котором присутствует несколько определяемыхионов. 3) Крива́я титрова́ния — графическое изображение зависимости определяемой в ходе титрования величины от объёма добавленного стандартного раствора титранта. Построение кривых проводится в инструментальных методах аналитической химии, где отсутствует возможность визуального определения точки эквивалентности (например, по индикатору).
Ординатой (осью Y) в графике зависимости является параметр, который фиксируется (pH, напряжение, температура раствора и так далее), а абсциссой (независимой переменной, осью X) — количество добавленного титранта. Иногда абсциссой выступает степень оттитрованности (обозначается τ или f) — соотношение количества вещества титранта к количеству определяемого вещества. Это показатель может использоваться или в виде абсолютного значения, или же в процентах. 4) Факторы эквивалентности окислителей и восстановителей. При вычислении эквивалентов элементов и их соединений уже указывалось, что их значения определяются характером превращений, которые они претерпевают в химических реакциях. Это положение сохраняет свою силу при вычислении эквивалентов окислителей и восстановителей, поскольку окислительно-восстановительный процесс очень часто протекает различно в зависимости от концентрации окислителя или восстановителя, температуры, среды и т.д. Эквивалентная масса окислителя и восстановителя определяется делением молярной массы на изменение степени окисления (на 1 моль вещества) в рассматриваемой реакции.
5) Перманганатометрия и иодометрия. Перманганатометрия — это титриметрический (объёмный) метод определения веществ, основанный на реакциях окисления с участием перманганат-ионов.
В основе перманганатометрического титрования лежит окислительно-восстановительный процесс с участием парыMn(VII)/Mn(II) (Еo=+1,52 В) в кислой среде:
При использовании раствора перманганата калия в качестве титранта можно определять, например, ионы железа, пероксид водорода, оксалаты:
Конечную точку титрования определяют без индикатора по появлению собственной фиолетовой окраски ионов MnO4-.
Иодометрия — титриметрический (объёмный) метод определения веществ, основанный на реакциях окисления-восстановления (разновидность оксидиметрии) с участием иода или иодида калия:
Стандартный электродный потенциал данной реакции составляет +0,5355 В. Прямое иодометрическое титрование непосредственно раствором I2 может быть использовано, в частности, для титрования восстановителей в присутствии избытка KI: Этим способом определяют концентрацию As(III), Sn(II), Sb(III), сульфидов, сульфитов, тиосульфатов и др.:
Возможно также определение восстановителей с избытком иода, непрореагировавшее количество которого определяется титрованием тиосульфата натрия. Косвенное иодометрическое титрование используется для титрования окислителей; в этом случае определяемые вещества взаимодействуют с избытком KI с образованием иода, который оттитровывается раствором тиосульфата натрия. Этот способ используется для определения концентрации Cu(II), H2O2, Br2, BrO3-, ClO-
Иодометрический метод анализа используется также для определения концентрации ионов H+:
Иодометрический метод анализа является также основой метода Фишера по определению воды в органических растворителях.
|
|||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 207; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.109.151 (0.006 с.) |