Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизмы развития злокачественных опухолей
Выделяют два механизма развития злокачественных опухолей: 1. Внутриклеточные механизмы 2. Внеклеточные механизмы Внутриклеточные механизмы (механизм опухолевой трансформации) Опухолевая трансформация клетки — внутриклеточные механизмы образования опухолевой клетки из нормальной в результате молекулярных изменений генома (экспрессия онкогена). Наиболее чувствительны к действию канцерогенов клетки в период деления на стадии G2. Соматическая клетка наиболее уязвима в фазе предмитоза G2, когда происходит “раскручивания цепей ДНК” и затем синтез РНК и белка. Пусковую роль в развитии опухолей играют онковирусы. В 50-х годах XX века Л.А. Зильбером с сотрудниками в опухолях были обнаружены вирусные и клеточные антигены. В 1945 году Л.А. Зильбер сформулировал вирусно-генетическую теорию происхождения опухолей. Он показал, что злокачественная трансформация обусловлена способностью онковирусов интегрировать, т.е. внедряться и встраиваться в клеточный геном, приводя к опухолевой трансформации клетки. В качестве носителя генетической информации у онкогенных вирусов может выступать как ДНК, так и РНК. В 1964 году Х. М. Теминым с соавторами была выдвинута мутационно-вирусогенетическая теория, раскрывающая роль в развитии опухолей РНК-содержащих вирусов. К образованию опухолей могут быть причастны: вирус саркомы Рауса (РНК-вирус) и особенно РНК-вирусы – ретровирусы, в частности ретровирусы типа С. Они относятся к икосаэдрическим вирусам с оболочкой и содержат одноцепочечную РНК. Название "ретровирусы" связано с тем, что в их размножении участвует обратная транскриптаза (РНК-зависимая ДНК-полимераза). РНК этих вирусов не может воспроизводиться путем простой репликации – необходима ее предварительная транскрипция в ДНК с последующей интеграцией этой ДНК в одну их хромосом клетки-хозяина с образованием интегрированной вирусной ДНК. Интеграция – необходимый этап репродукции вируса; только интегрированная вирусная ДНК будет транскрибироваться (происходить биосинтез молекул и-РНК на матрице ДНК). Так как интеграция в клеточную ДНК входит в жизненный цикл вируса, частота интеграции очень велика. Вероятно, синтезированная вирусная ДНК может включаться в клеточную в любом месте. Размножение вируса не приводит к лизису клетки. Нуклеокапсид образуется внутри клетки, перемещается затем к плазматической мембране и выходит наружу, одетый в оболочку из этой мембраны. Интегрированная ДНК ретровируса реплицируется (копируется, воспроизводится) вместе с геномом клетки-хозяина и поэтому содержится в каждой клетке опухоли. Опухолевый рост клеток обусловлен экспрессией вирусного гена src.
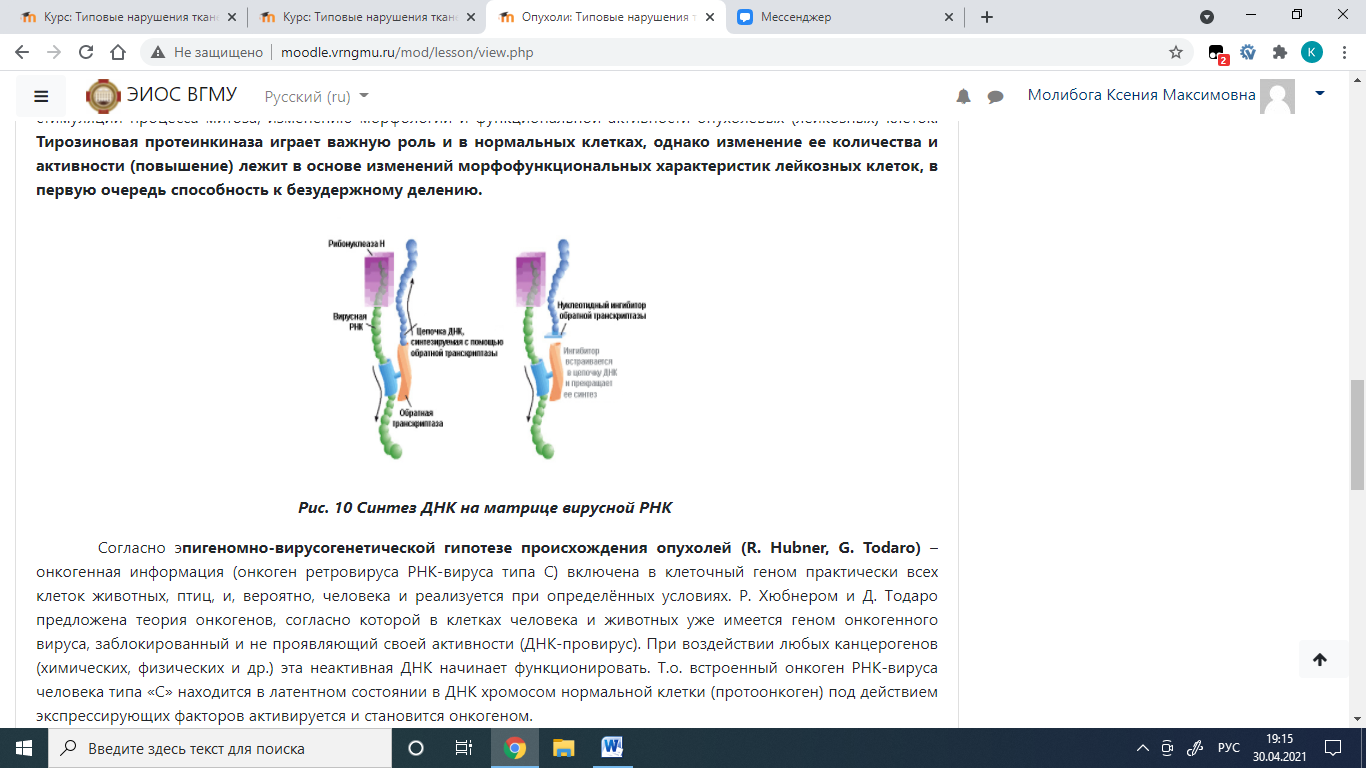
Таким образом, РНК-вирус с участием ферментов ревертазы/ транскриптазы (РНК-зависимая ДНК-полимераза) образует вирусную сначала одноцепочечную ДНК и далее двухцепочечную ДНК, затем вирусная ДНК встраивается в ДНК-клетки хозяина. Образуется интегрированный геном. В дальнейшем происходит транскрибирование и-РНК и трансляция (перенос, передача генетической информации и-РНК на синтез белка) что приводит к избыточному синтезу регуляторных белков и появлению качественно новых белков (онкобелков, тумор-протеинов) и изменению функции клетки. Src ген кодирует белок, который представляет собой тирозиновую протеинкиназу, фосфорилирующую белки. Мишенями тирозиновой протеинкиназы, кодируемой геном src являются некоторые гликолитические (более высокий уровень гликолиза) и другие ферменты, фосфорилируются белковые компоненты ионных насосов, происходит фосфорилирование тирозина и образуется фосфотирозин. Тем самым продукт гена src может оказывать влияние на целый ряд клеточных процессов, путем фосфорилирования различных белковых мишеней и ферментов, что приводит к стимуляции процесса митоза, изменению морфологии и функциональной активности опухолевых (лейкозных) клеток. Тирозиновая протеинкиназа играет важную роль и в нормальных клетках, однако изменение ее количества и активности (повышение) лежит в основе изменений морфофункциональных характеристик лейкозных клеток, в первую очередь способность к безудержному делению.
Согласно э пигеномно-вирусогенетической гипотезе происхождения опухолей (R. Hubner, G. Todaro) – онкогенная информация (онкоген ретровируса РНК-вируса типа С) включена в клеточный геном практически всех клеток животных, птиц, и, вероятно, человека и реализуется при определённых условиях. Р. Хюбнером и Д. Тодаро предложена теория онкогенов, согласно которой в клетках человека и животных уже имеется геном онкогенного вируса, заблокированный и не проявляющий своей активности (ДНК-провирус). При воздействии любых канцерогенов (химических, физических и др.) эта неактивная ДНК начинает функционировать. Т.о. встроенный онкоген РНК-вируса человека типа «С» находится в латентном состоянии в ДНК хромосом нормальной клетки (протоонкоген) под действием экспрессирующих факторов активируется и становится онкогеном.
Существует гипотеза, что «все мы несём в хромосомах “спящие“ неэкспрессируемые, онкогены, которые попали в геном наших предков в виде РНК-содержащих вирусов, возможно, тысячи или миллионы лет назад…такие онкогены не транскрибируются, но если их активировать, например, воздействием канцерогенных агентов, то они транскрибируются и транслируются с образованием продуктов, вызывающих трансформацию нормальных клеток человека в злокачественные» (А.Ленинджер). В 70-х годах XX века было высказано предположение, что изменения генетического аппарата клетки нарушают ее реакцию на регуляторные воздействия. Гены, мутации которых способствуют появлению злокачественных клеток, были названы онкогенами. Происходит мутация протоонкогенов, т.е. генов нормального генома человека, участвующих в регуляции пролиферации клеток. Протоонкогены идентифицировали с трансформирующими ретровирусами, РНК-содержащими вирусами, которые в далеком прошлом интегрировались в геном клетки и включили в генетический аппарат животной клетки (гены, участвующие в регуляции клеточного деления) свой собственный геном. Эти онкогены находятся в любой клетке в неактивном, депрессированном состоянии. Это - протоонкоген или регуляторный ген X («икс»). Этот ген X обеспечивает синтез нормальных регуляторных белков. Под влиянием мутагенов (физических, химических, биологических) происходит экспрессия, активация регуляторного гена X. Это приводит к нарушению структуры ДНК и синтезируются качественно новые, онкобелки (тумор-протеины). Таким образом, при мутациях регуляторный ген X теряет контроль над синтезом нормальных белков и в клетке наблюдаются метаболические и функционально-структурные изменения аналогичные тем, что и при действии РНК-вирусов, описанные выше. Промоторами протоонкогенов (регуляторного гена X) могут становиться и некоторые гены из онковирусов. Одним из механизмов активации онкогена является «точечные мутации», в основе которого лежит мутация связанная с аминокислотной заменой в онкогене, что сопровождается изменением структуры и конформации белка. Данный механизм приводит не к количественным изменениям продуктов экспрессированного онкогена, а к качественным – появлению нового онкобелка (туморпротеина) с измененными свойствами, определяющими свойства опухолевой клетки.
|
||||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 39; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.221.113 (0.006 с.) |