Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Регенерация может быть физиологическая, репаративная и патологическая.Стр 1 из 6Следующая ⇒
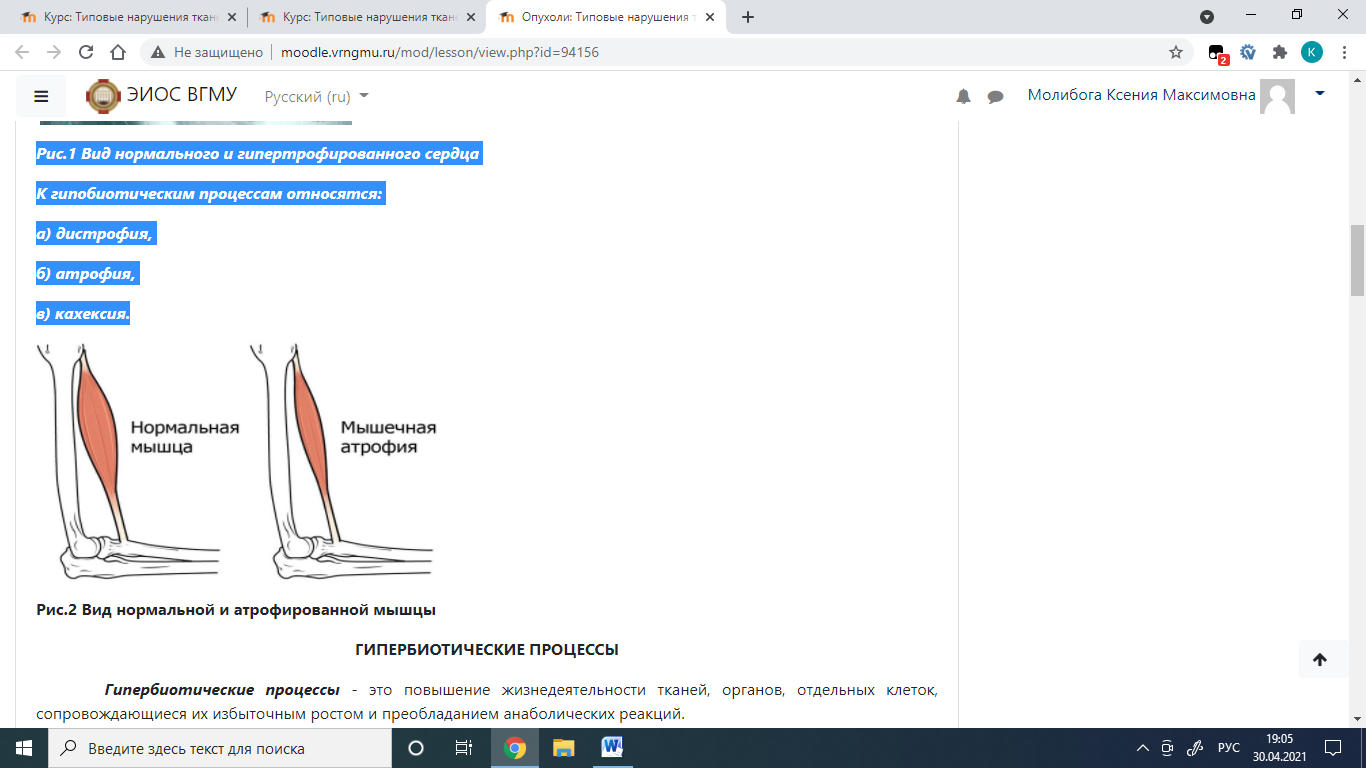
Рис.1 Вид нормального и гипертрофированного сердца К гипобиотическим процессам относятся: а) дистрофия, б) атрофия, в) кахексия.
ГИПЕРБИОТИЧЕСКИЕ ПРОЦЕССЫ Гипербиотические процессы - это повышение жизнедеятельности тканей, органов, отдельных клеток, сопровождающиеся их избыточным ростом и преобладанием анаболических реакций. Некоторые гипербиотические процессы имеют важное приспособительное значение для организма. Так регенерацию и гипертрофию относят к важным приспособительным и компенсаторным реакциям организма. Однако многие изменения тканевого роста имеют выраженное отрицательное значение для организма, особенно ярким примером этого является опухолевый рост. а) Гипертрофия - это процесс увеличения объема органа или его части без увеличения числа клеток. Иными словами, гипертрофированный орган не содержит каких-либо новых клеток, а имеет только более крупные прежние клетки. Увеличение их объема обусловлено более выраженным по сравнению с нормой синтезом структурных компонентов клеток. Гипертрофия поддерживается гиперфункцией органа, но вместе с тем этот процесс обратимый – гипертрофия исчезает при ликвидации причины, вызвавшей эту гиперфункцию. Различают два вида гипертрофий: ложную и истинную гипертрофию. Ложная гипертрофия - это увеличение органа, вызванное чрезмерным разрастанием межуточной и жировой ткани при атрофии его паренхиматозных элементов (например, разрастание в мышце жировой ткани при одновременной атрофии мышечных волокон). Ложная гипертрофия не является компенсаторной. Истинная гипертрофия - это увеличение объема специфически функционирующих паренхиматозных элементов органа. К истинной гипертрофии относится компенсаторная гипертрофия, обусловленная увеличением функции ткани или органа физиологического характера (физиологическая). Физиологическая гипертрофия развивается у здоровых людей как приспособительная реакция на повышенную функцию тех или иных органов, например, увеличение соответствующих групп скелетных мышц или сердца при занятии спортом, увеличение массы тела матки при беременности и др. Так, при беременности гипертрофия клеток стимулируется эстрогенными гормонами через рецепторы этих гормонов на гладкомышечных клетках матки. Рецепторы обеспечивают взаимодействие гормонов с ядерной ДНК, приводя к повышению синтеза белков и увеличению объема гладкомышечных клеток.
Истинная гипертрофия может возникать и при каком-либо патологическом процессе – патологическая гипертрофия (например, гипертрофия миокарда при пороках сердца). Патологическая гипертрофия – это увеличение объема и массы органа, которое не является компенсаторной реакцией, так как не только не компенсирует утраченную функцию, но нередко извращает ее. Патологическая гипертрофия сама служит проявлением болезни и требует лечения. Примером такой гипертрофии является нейро-гуморальная гипертрофия. Эта гипертрофия возникает при нарушении функций эндокринных желез: акромегалия при гиперфункции передней доли гипофиза, железистая гиперплазия эндометрия при дисфункции яичников. И акромегалия и железистая гиперплазия эндометрия не несут в себе ни приспособительного, ни компенсаторного смысла, а являются симптомами заболеваний, которые требуют лечения. Так же, например, гипертрофические разрастания тканей в области длительно текущих воспалительных процессов или увеличение объема тканей в области нарушенного лимфообращения (например, слоновость нижней конечности) не имеют компенсаторного значения, так как не компенсируют нарушенную функцию того органа, в котором они развиваются. Викарная гипертрофия – это гипертрофия при гибели или выключении из функции одного из парных органов (например, почки, легкого). При викарной гипертрофии сохранившийся орган берет на себя функцию утраченного. Корреляционная гипертрофия возникает в органах, функционально связанных между собой (например, после удаления щитовидной железы происходит увеличение гипофиза). Регенерационная гипертрофия развивается после повреждения органа или его частичной резекции (например, печени). Примером патологической рабочей гипертрофии служит гипертрофия миокарда, которая развивается при артериальной гипертензии или пороках аортального клапана, т.е. при хронической гемодинамической перегрузке. Рабочая гипертрофия – процесс обратимый при условии, что причина вовремя устранена. Например, если больному своевременно сделана реконструктивная операция при врожденном или приобретенном пороке сердца, то изменения сердца могут иметь обратное развитие, и происходит возврат к норме. Часто исходом является декомпенсация гипертрофированного сердца, одной из причин которой является то, что процесс гипертрофии ограничен возможностью кровоснабжения органа. У гипертрофированных кардиомиоцитов возрастает потребность в кислороде, и несоответствие между потребностью в кислороде и способностью транспортных систем обеспечить им кардиомиоциты может привести к возникновению гипоксии миокарда. В условиях гипоксии возможно развитие жировой дистрофии миокарда, что сопровождается расширением полостей сердца и снижением его сократительной способности. Таким образом, в формировании рабочей гипертрофии миокарда можно выделить стадию компенсации, при которой повреждения структур миоцитов не происходит, и стадию декомпенсации, для которой характерны жировая дистрофия миокарда и клинически – сердечная недостаточность.
б) Гиперплазия - увеличение объема органа или ткани за счет увеличения числа клеток и внутриклеточных структур вследствие повышенной функции органа (функциональная гиперплазия) или в результате патологического новообразования (патологическая гиперплазия). Примером может служить гиперплазия ряда эндокринных желез: тимуса, надпочечников и др. Этот процесс нельзя путать с гипертрофией (увеличением объема клеток). Оба процесса тесно связаны между собой и часто развиваются как сопутствующие друг другу. Однако при гипертрофии не происходит пролиферации клеток, в то время как гиперплазия наблюдается лишь в том случае, когда клеточная популяция способна к синтезу ДНК, обеспечивающему митоз. Гиперплазия бывает физиологической и патологической. Физиологическая гиперплазия подразделяется на гормональную и компенсаторную. Гормональная гиперплазия возникает в органах – мишенях под действием гормонов, например пролиферация эпителиальных структур в молочной железе или матке во время беременности. Компенсаторная гиперплазия встречается при удалении или поражении части органа. Например, при частичной гепатэктомии митотическая активность оставшихся клеток обнаруживается уже через 12 ч, и они постепенно восстанавливают структуру печени. Имеются существенные признаки того, что пролиферация клеток в этом случае зависит от воздействия полипептидных факторов роста. В качестве важнейших рассматриваются два фактора: ТФРα и фактор роста гепатоцитов. Прекращение роста клеток по достижении прежней массы печени вызывается местными (органными) ингибиторами роста. Одним из них является ТФРβ, вырабатываемый непаренхиматозными клетками печени. Патологическая гиперплазия. Большинство ее форм служат примером избыточной гормональной стимуляции или воздействия факторов роста на клетки – мишени. Типичным примером дисгормонального процесса служит железистая гиперплазия эндометрия. в) Регенерация - это восстановление организмом участков органов или тканей, поврежденных или погибших в результате какого-либо патологического процесса.
Без регенерации сама жизнь невозможна и поэтому регенерация в организме протекает непрерывно. Она контролируется и регулируется различными системами организма (нервной, иммунной, эндокринной). ГИПОБИОТИЧЕСКИЕ ПРОЦЕССЫ ГИПОБИОТИЧЕСКИЕ ПРОЦЕССЫ Гипобиотические процессы - это процессы, характеризующиеся снижением жизнедеятельности тканей, обусловленные преобладанием катаболических процессов. К ним относятся дистрофия, атрофия и кахексия. а) Дистрофия - это типовой патологический процесс, в основе которого лежит нарушение тканевого метаболизма. б) Атрофия - типовой патологический процесс, сопровождающийся значительным нарушением метаболизма, уменьшением массы и объема органа или ткани и ослаблением или прекращением их функции. В большинстве случаев атрофия – процесс обратимый. Различают физиологическую и патологическую атрофию. С помощью физиологической атрофии организм приспосабливается к меняющимся условиям своего функционирования. Физиологическая атрофия наблюдается на протяжении всей жизни человека. Так, после рождения атрофируются и облитерируются пупочные артерии, артериальный (боталлов проток). Например, в определенном возрасте происходит атрофия вилочковой железы, яичников и молочных желез у женщин, сперматогенного эпителия яичек у мужчин; в старости в связи со снижением уровня обмена веществ и выключением многих функций организма наступает атрофия всего тела человека (старческая, или инволюционная кахексия). Патологическая атрофия возникает при различных заболеваниях. Она может быть общая, связанная, например, с истощением при голодании, при различных заболеваниях головного мозга - церебральная, гипофизарная, посттравматическая кахексия, злокачественных опухолях и др. Местная атрофия представляет собой атрофию отдельного органа (тимуса, яичников и др.). Местная атрофия. Различают следующие виды местной патологической атрофии в зависимости от причины и механизма развития: атрофия от бездействия (дисфункциональная атрофия); атрофия, вызванная недостаточностью кровоснабжения; атрофия при денервации; атрофия в результате недостатка трофических гормонов; атрофия вследствие длительного сдавливания органа или ткани; атрофия под действием физических и химических факторов. Атрофия от бездействия (дисфункциональная атрофия) развивается в результате снижения функции органа. Она наблюдается, например, в скелетных мышцах и костях при иммобилизации (при лечении переломов). При длительном постельном режиме и гиподинамии скелетная мускулатура атрофируется достаточно быстро вследствие бездействия. Первоначально наблюдается быстрое уменьшение размеров клеток, которые так же быстро восстанавливают объем при возобновлении активности. При более длительной иммобилизации мышечные волокна уменьшаются и в размерах, и в количестве. Так как скелетная мускулатура может регенерировать в ограниченном объеме, восстановление размеров мышц после потери мышечных волокон происходит в основном путем компенсаторной гипертрофии оставшихся в живых волокон, на что требуется длительный период восстановления. Атрофия кости заключается в том, что резорбция кости происходит быстрее, чем ее формирование; это проявляется уменьшением размеров трабекул (уменьшение массы), что приводит к остеопорозу от бездействия. Кроме того, примерами дисфункциональной атрофии могут служить: атрофия зрительного нерва после удаления глаза; атрофия краев зубной ячейки, лишенной зуба.
Атрофия, вызванная недостаточностью кровоснабжения, развивается вследствие сужения артерий, питающих данный орган. Уменьшение кровотока (ишемия) в тканях приводит к гипоксии, вследствие чего возникает уменьшение объема клеток, их количества – деятельность паренхиматозных органов снижается, размер клеток уменьшается. Гипоксия стимулирует пролиферацию фибробластов, развивается склероз. Такой процесс наблюдается в миокарде, когда на почве прогрессирующего атеросклероза венечных артерий развиваются атрофия кардиомиоцитов и диффузный кардиосклероз; при склерозе сосудов почек развивается атрофия и сморщивание почек; болезни сосудов головного мозга проявляются атрофией коры, включающей в себя и гибель нейронов. Атрофия при денервации: известно, что нервы оказывают на органы и ткани троякое влияние: регулируют кровоснабжение органов через вазомоторные нервы, оказывают трофическое влияние на ткани (активируют обмен веществ) и вызывают возбуждение деятельности (сокращение, секреция и др.). Перерезка нерва лишает ткань нормального кровоснабжения и трофического влияния нервной системы. Вследствие этого в денервированном органе или ткани возникает угнетение обмена веществ и уменьшение объема, развивается денервация. Атрофия в результате недостатка трофических гормонов: эндометрий, молочная железа и большое количество эндокринных желез зависят от трофических гормонов, необходимых для нормального клеточного роста, и уменьшение количества этих гормонов ведет к атрофии. При уменьшении секреции эстрогена в яичниках (опухоли, воспалительные процесс) наблюдается атрофия эндометрия, влагалищного эпителия и молочной железы. Болезни гипофиза, сопровождающиеся уменьшенной секрецией гипофизарных тропных гормонов, приводят к атрофии щитовидной железы, надпочечников и половых желез. Лечение кортикостероидами надпочечников в высоких дозах, которое иногда используется для иммуносупрессии, вызывает атрофию надпочечниковых желез из-за подавления секреции гипофизарного кортикотропина (АКТГ). Такие пациенты быстро теряют способность к секреции кортизола и становятся зависимыми от экзогенных стероидов. Отмена стероидной терапии у таких пациентов должна быть достаточно постепенной, чтобы успела произойти регенерация атрофированных надпочечников.
Атрофия вследствие длительного сдавливания органа или ткани: при этом нарушаются нормальное кровоснабжение и обмен веществ. Например, опухоль, надавливая на кость, может вызвать истончение кости и последующее ее разрушение. При закупорке мочеточника моча скапливается в нем и в почечной лоханке и вызывает атрофию ткани почки от давления мочи на нее со стороны лоханки (гидронефроз). Атрофия под воздействием физических и химических факторов. Под действием лучевой энергии атрофия особенно выражена в костном мозге и половых органах. Йод и тиоурацил подавляют функцию щитовидной железы, что ведет к ее атрофии. в) Кахексия - крайняя степень истощения организма, характеризующаяся глубокими нарушениями обмена веществ, резким исхуданием, физической слабостью, снижением физиологических функций. По происхождению кахексия бывает: - алиментарная (дефицит белка, авитаминозы); - раневая, возникающая вследствие раневого истощения и развития гипопротеинемии; - раковая, возникающая вследствие формирования в организме отрицательного азотистого баланса (злокачественная опухоль является «ловушкой» азота); - кахексия при лучевой болезни, вызванная блокадой тиоловых ферментов и нарушением синтеза ДНК. В итоге все вышеперечисленные механизмы нарушений приводят к распаду тканевого белка и собственно формированию кахексии. ОПУХОЛЕВЫЙ РОСТ Опухоль – типовой патологический процесс, в основе которого лежит неограниченный, неконтролируемый рост клеток с преобладанием процессов пролиферации над явлениями нормальной клеточной дифференцировки. Физические факторы Доказано, что ионизирующая радиация, ультрафиолетовые лучи, рентгеновское облучение, электромагнитные волны могут быть причиной опухолевого перерождения клетки. Существует достаточно доказательств того, что УФ – облучение является фактором риска возникновения различных злокачественных образований кожи: плоскоклеточного рака, базальноклеточной карциномы и меланомы. Степень риска зависит от длины волны УФ лучей, интенсивности экспозиции, количества клеток, поглотивших эти лучи, а также от конституциональных особенностей облученного организма. Также установлена канцерогенность рентгеновский лучей, альфа, бета, гамма лучей, протонов и нейтронов. Химические факторы Открытие химических канцерогенов началось с исследования на животных влияния полициклических углеводородов – продуктов переработки каменноугольной смолы. Первым был 3,4-бензпирен, более сильным в этом отношении оказался его синтетический аналог – диметилбензантрацен (ДМБА), однако в настоящее время более широко в эксперименте на животных используется метилхолантрен. Эти вещества обладают как выраженными местными эффектами (при втирании в кожу и слизистые оболочки), так и общерезорбтивными эффектами, вызывая рак в областях, удаленных от места их нанесения. Другая группа – ароматические амины и некоторые красители. Это вещества с органотропным эффектом, т.е они вызывают рак определенных органов. Так, аминоацетофлоурен в эксперименте вызывает рак печени у крыс, а β-нафтиламин вызывал рак мочевого пузыря у лиц, занятых в его производстве (Германия, 1920-е гг.). К природным канцерогенам, потенциально вызывающим рак печени у человека, относят афлотаксин В-1, продуцируемый некоторыми штаммами грибка аспергилус флавус. Его содержат некоторые виды земляных орехов. Нитрозамины, асбест, винилхлорид, мышьяк, хром и никель – профессиональные вредности, зарегистрированы так же, как потенциальные канцерогены. Другую группу веществ составляют эндогенные канцерогены – вещества, являющиеся нашими естественными метаболитами и природными стероидами. К первой группе веществ относят производные триптофана (5-ОИК-оксииндолуксусную кислоту). Так, инъекции высоколейкозным линиям мышей экстракта мочи больных лейкозами, содержащими высокую концентрацию 5–ОИК, практически в 100% случаев вызывали у мышей лейкоз – опухоль кроветворной системы. Подобными свойствами обладает и 3 –оксиантраниловая кислота (производное тирозина). Что касается стероидов, то канцерогенными свойствами в опытах на животных обладали облученный холестерин, желчные кислоты (ЖК) и эстрогены. Эстрогены после длительной аппликации на слизистую оболочку матки мышей-самок, находящихся в определенной фазе цикла овуляции, вызывали у них рак матки. Биологические факторы Все онковирусы делятся на ДНК- и РНК-содержащие. ДНК- содержащие вирусы животных, такие как аденовирусы и вирус полиомы, могут вызывать опухоли только в лабораторных условиях. Другие вирусы, например, бычий вирус папилломы, вызывают как доброкачественные, так и злокачественные опухоли у их природных хозяев. ДНК-содержащие вирусы человека участвуют в формировании злокачественных опухолей у человека; их можно разделить на 4 группы: - вирусы, вызывающие папиллому (папилломавирусы); - вирус Эпштейна – Барр вызывает лимфому Беркитта; - вирус гепатита В способен вызывать рак печени; - вирус герпеса – саркому Капоши. К РНК-содержащим вирусам животных относят вирус куриной саркомы Рауса, а также вирусы лейкозов (Молони, Графи) у мышей. Эти модели наиболее часто используются для изучения патогенеза лейкозов в эксперименте. Из РНК-содержащих онковирусов человека нам известен вирус Т-лейкоза человека (HTLV – 1) Существуют три формы рака, связанные с наследственностью:
Наследственно- аутосомные доминантные формы. К таким опухолям относятся семейная ретинобластома, синдромы множественных эндокринных опухолей, семейный аденоматозный полипоптоз толстого кишечника. При аутосомно-доминантном пути наследования одного единственного мутантного гена в высокой степени повышает риск заболеваемости злокачественной опухолью. Семейные раки (рак молочной железы, рак яичников, рак толстого кишечника, не связанный с аденоматозным полипозом). Пути передачи семейных раков не выяснены. Их характерными чертами являются: раннее начало; опухоли, как правило, встречаются у двух и более ближайщих родственников, чаще поражают парные органы, для них не характерны предраковые состояния. Аутосомно-рецессивные синдромы, связанные с нарушением репарации ДНК. Опухолевые процессы выступают и в роли осложнения основной патологии. Например, множественные пороки развития тканей, в том числе и аплазия костного мозга при анемии Фанкони являются главным звеном патогенеза этого синдрома. Однако больные с относительно доброкачественным течением этого синдрома чаще погибают от злокачественных опухолей. Примером таких синдромов также служит пигментная ксеродерма. Это аутосомно-рецессивное заболевание, которому свойственно дефекты репарации ДНК. У больных с пигментной ксеродермой отмечается повышенный риск заболеваемости кожными раками в связи с нарушением темновой репарации ДНК в клетках кожи, поврежденной воздействием УФ-света. Способствующие этиологические факторы опухолевых заболеваний Развитию опухолевых заболеваний способствуют:
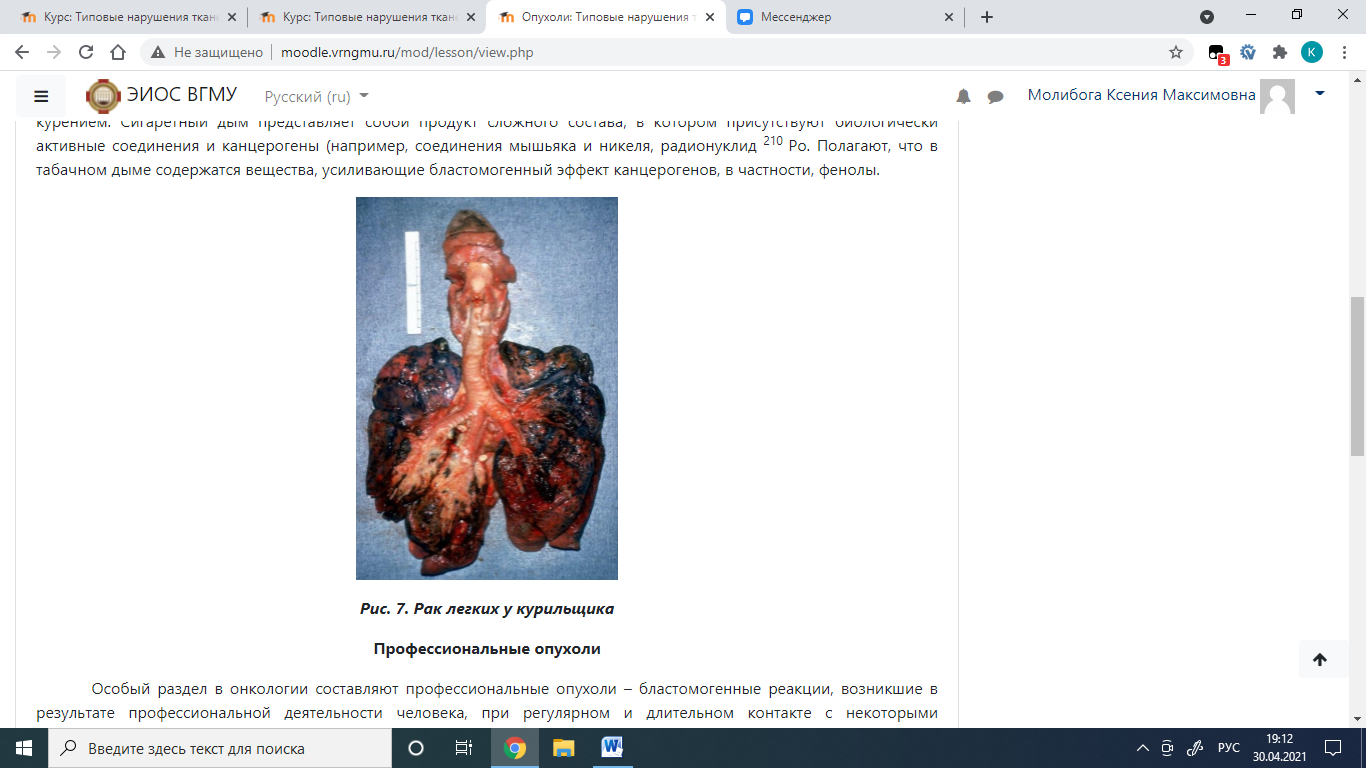
Вредные привычки человека Повышенный риск развития рака достоверно коррелирует с определенными факторами быта. Наиболее типичным примером считается рак легких у курильщиков. Установлено, что порядка 90% случаев рака легкого спровоцировано курением. Сигаретный дым представляет собой продукт сложного состава, в котором присутствуют биологически активные соединения и канцерогены (например, соединения мышьяка и никеля, радионуклид 210 Ро. Полагают, что в табачном дыме содержатся вещества, усиливающие бластомогенный эффект канцерогенов, в частности, фенолы.
Профессиональные опухоли Особый раздел в онкологии составляют профессиональные опухоли – бластомогенные реакции, возникшие в результате профессиональной деятельности человека, при регулярном и длительном контакте с некоторыми экзогенными химическими или физическими факторами. Особенностью этих опухолей считается выявленная связь с профессиональными вредностями и длительный латентный период до клинического их проявления. Примером таких опухолей могут быть ангиосаркомы печени, развивающиеся через 40 лет и более после работы с винилхлоридом; рак мочевого пузыря – спустя 12-15 лет после контакта с ароматическими аминосоединениями; опухоли легких – через 7-21 год после контакта с асбестом. Ятрогенный канцерогенез Ятрогенный канцерогенез связан с применением диагностических процедур и терапевтических воздействий, выполняемых медицинскими работниками. Доказано, что опухоли у людей могут быть обусловлены воздействием ионизирующего излучения, применяемого в диагностических и терапевтических целях. Антибиотик хлорамфеникол вызывает острый лейкоз (миелоидного типа), рак мочевого пузыря выявлен у больных, лечившихся хлорнафтизином. Зафиксированы случаи опухолей у детей, родившихся от женщин, получавших синэстрол или диэтилстильбестрол.
Онкобелки и их свойства. Трансформация нормального генома клетки в опухолевый приводит к синтезу такой клеткой онкобелков. Онкобелки – это продукты онкогенов. Онкобелки играют роль ростовых факторов. С одной стороны, это могут быть белки с измененной функцией, но чаще это нормальные белки, отвечающие за процессы роста. В соответствии с их функциями онкобелки могут играть роли: - факторов роста; - рецепторов к факторам роста; - мембранных G-белков, вовлекаемых в передачу ростовых сигналов с клеточной мембраны на цитоплазму; - вторичных мессенджеров, передающих сигналы с цитоплазмы на ядро и обладающих протеинкиназной активностью; - ДНК-связывающих белков, вовлекающих ДНК в репликацию с последующим входом клетки в митотический цикл; - циклинов и циклинзависимых киназ, наделенных функцией «контрольно-пропускных ворот» (chek point) при входе клетки в митотический цикл. Антибластомная резистентность - свойство организма препятствовать проникновению канцерогенных агентов в клетку, ее ядро и/или их действию на геном; обнаруживать и устранять онкогены или подавлять их экспрессию; обнаруживать и разрушать опухолевые клетки, тормозить их рост. Различают антиканцерогенные, антимутационные и антицеллюлярные механизмы противоопухолевой защиты. Антиканцерогенные механизмы направлены на защиту организма от действия канцерогенных факторов. Существуют различные механизмы, которые удаляют или предупреждают действие физических, химических и биологических канцерогенных факторов. Так, например, эффект различных видов ионизирующего излучения, сопровождающийся усиленным образованием губительных для клетки свободных радикалов кислорода, ткани организма устраняют различными антиоксидантами. Выявлена активация ряда микросомальных ферментов (например, в печени) и антиоксидантов при попадании в организм химических канцерогенов с целью предотвращения образования активного их метаболита и/или ускорения обезвреживания самого бластомогенного фактора. Важное место среди этих антиканцерогенных веществ занимают бета- глюкуронидазы, которые предотвращают распад глюкуронидов и высвобождение канцерогенных соединений. Если химические канцерогены имеют свойства гаптенов, они могут инактивироваться антителами и в последующем фагоцитироваться. Биологические канцерогенные агенты, в частности онкогенные вирусы, могут быть ингибированы специфическими противовирусными антителами и интерфероном. Натуральные киллеры уничтожают комплекс «вирус + клетка» путем продукции активных форм кислорода, перекиси водорода, лизосомальных ферментов, протеаз и фосфолипаз. Кроме того, инактивация канцерогенов осуществляется за счет их выведения из организма почками (в составе мочи), печенью (в составе желчи), кишечником (в составе кала), потовыми железами (в составе пота). Антимутационные механизмы обеспечивают обнаружение, устранение или подавление активности онкогенов. Реализуются антимутационные механизмы при участии онкосупрессоров и систем репарации ДНК. При недостаточности антимутационных механизмов и активации онкогенов нормальная клетка приобретает опухолевый генотип и характерные для него фенотипические признаки. Это служит сигналом для включения антицеллюлярных механизмов противоопухолевой защиты. Антицеллюлярные механизмы направлены на обнаружение и уничтожение уже возникших опухолевых клеток. В ходе опухолевой прогрессии идет селекция АГ- негативных субклонов, т.е. опухолевых клеток с низкой антигенной активностью, плохо распознаваемых системой иммунного надзора. В то же время клоны клеток с выраженной иммуногенностью элиминируются гораздо легче. Это связано с тем, что по мере опухолевой прогрессии опухолевые клетки, будучи менее зрелыми, не приобретают МНС I класса АГ, наличие которых так необходимо для иммунного распознавания при встрече с Т- лимфоцитами. Последние специализируются на иммунном распознавании тумороспецифических – новых АГ опухолевых клеток, которые не всегда экспрессируются должным образом. Трудности распознавания связаны с тем, что опухолевые клетки включают в себя «свое» и «чужое», другими словами, эти клетки и свои, и чужие. Некоторые опухоли, такие как меланома и гепатоцеллюлярная карцинома, способны вызывать апоптоз цитотоксических СД8+ - лимфоцитов, с которыми связана важнейшая функция при уничтожении опухолевых клеток. Наконец, опухолевые клетки не вырабатывают костимулирующие молекулы, необходимые для активации Т – клеток. Принимая во внимание все сказанное, можно заключить, что опухоль, с одной стороны, чаще возникает у лиц с иммунодефицитами, а с другой стороны, она сама вызывает иммуносупрессию. К этому можно добавить, что опухолевый процесс, являясь одним из вариантов острофазового ответа, сопровождается гиперкортизолизмом. Однако известно, что высокие концентрации кортизола в крови также способствуют иммуносупрессии.
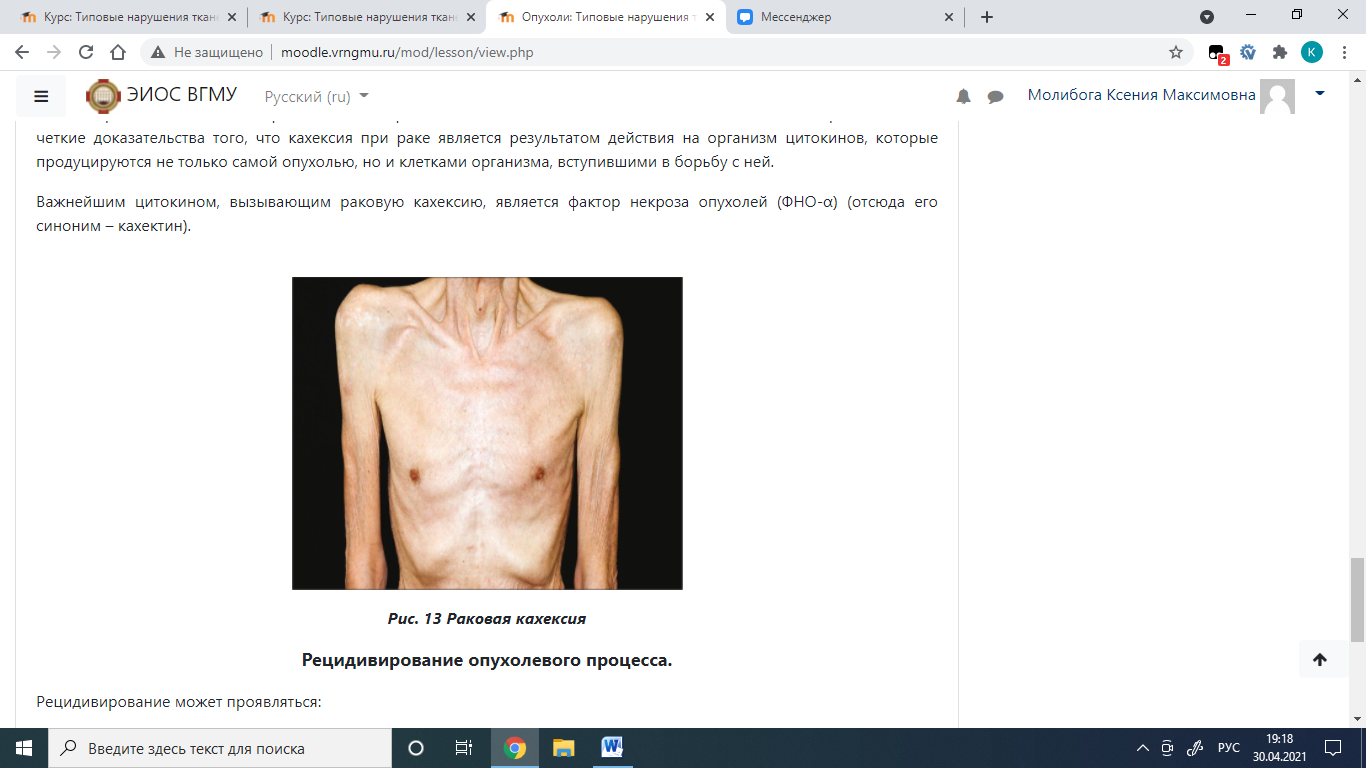
Раковая кахексия Больные раком, даже не страдающие непроходимостью и другими симптомами, нарушающими нормальное пищеварение, как правило, страдают от резчайшего исхудания за счет уменьшения массы сначала жировой, а затем и мышечной ткани. Это состояние называется раковой кахексией. Раковая кахексия возникает вследствие формирования в организме отрицательного азотистого баланса (злокачественная опухоль является «ловушкой» азота). Обычно раковая кахексия сопровождается выраженной слабостью и отказом от еды. В настоящее время имеются четкие доказательства того, что кахексия при раке является результатом действия на организм цитокинов, которые продуцируются не только самой опухолью, но и клетками организма, вступившими в борьбу с ней. Важнейшим цитокином, вызывающим раковую кахексию, является фактор некроза опухолей (ФНО-α) (отсюда его синоним – кахектин).
Рис.1 Вид нормального и гипертрофированного сердца К гипобиотическим процессам относятся: а) дистрофия, б) атрофия, в) кахексия.
ГИПЕРБИОТИЧЕСКИЕ ПРОЦЕССЫ Гипербиотические процессы - это повышение жизнедеятельности тканей, органов, отдельных клеток, сопровождающиеся их избыточным ростом и преобладанием анаболических реакций. Некоторые гипербиотические процессы имеют важное приспособительное значение для организма. Так регенерацию и гипертрофию относят к важным приспособительным и компенсаторным реакциям организма. Однако многие изменения тканевого роста имеют выраженное отрицательное значение для организма, особенно ярким примером этого является опухолевый рост. а) Гипертрофия - это процесс увеличения объема органа или его части без увеличения числа клеток. Иными словами, гипертрофированный орган не содержит каких-либо новых клеток, а имеет только более крупные прежние клетки. Увеличение их объема обусловлено более выраженным по сравнению с нормой синтезом структурных компонентов клеток. Гипертрофия поддерживается гиперфункцией органа, но вместе с тем этот процесс обратимый – гипертрофия исчезает при ликвидации причины, вызвавшей эту гиперфункцию. Различают два вида гипертрофий: ложную и истинную гипертрофию. Ложная гипертрофия - это увеличение органа, вызванное чрезмерным разрастанием межуточной и жировой ткани при атрофии его паренхиматозных элементов (например, разрастание в мышце жировой ткани при одновременной атрофии мышечных волокон). Ложная гипертрофия не является компенсаторной. Истинная гипертрофия - это увеличение объема специфически функционирующих паренхиматозных элементов органа. К истинной гипертрофии относится компенсаторная гипертрофия, обусловленная увеличением функции ткани или органа физиологического характера (физиологическая). Физиологическая гипертрофия развивается у здоровых людей как приспособительная реакция на повышенную функцию тех или иных органов, например, увеличение соответствующих групп скелетных мышц или сердца при занятии спортом, увеличение массы тела матки при беременности и др. Так, при беременности гипертрофия клеток стимулируется эстрогенными гормонами через рецепторы этих гормонов на гладкомышечных клетках матки. Рецепторы обеспечивают взаимодействие гормонов с ядерной ДНК, приводя к повышению синтеза белков и увеличению объема гладкомышечных клеток. Истинная гипертрофия может возникать и при каком-либо патологическом процессе – патологическая гипертрофия (например, гипертрофия миокарда при пороках сердца). Патологическая гипертрофия – это увеличение объема и массы органа, которое не является компенсаторной реакцией, так как не только не компенсирует утраченную функцию, но нередко извращает ее. Патологическая гипертрофия сама служит проявлением болезни и требует лечения. Примером такой гипертрофии является нейро-гуморальная гипертрофия. Эта гипертрофия возникает при нарушении функций эндокринных желез: акромегалия при гиперфункции передней доли гипофиза, железистая гиперплазия эндометрия при дисфункции яичников. И акромегалия и железистая гиперплазия эндометрия не несут в себе ни приспособительного, ни компенсаторного смысла, а являются симптомами заболеваний, которые требуют лечения. Так же, например, гипертрофические разрастания тканей в области длительно текущих воспалительных процессов или увеличение объема тканей в области нарушенного лимфообращения (например, слоновость нижней конечности) не имеют компенсаторного значения, так как не компенсируют нарушенную функцию того органа, в котором они развиваются. Викарная гипертрофия – это гипертрофия при гибели или выключении из функции одного из парных органов (например, почки, легкого). При викарной гипертрофии сохранившийся орган берет на себя функцию утраченного. Корреляционная гипертрофия возникает в органах, функционально связанных между собой (например, после удаления щитовидной железы происходит увеличение гипофиза). Регенерационная гипертрофия развивается после повреждения органа или его частичной резекции (например, печени). Примером патологической рабочей гипертрофии служит гипертрофия миокарда, которая развивается при артериальной гипертензии или пороках аортального клапана, т.е. при хронической гемодинамической перегрузке. Рабочая гипертрофия – процесс обратимый при условии, что причина вовремя устранена. Например, если больному своевременно сделана реконструктивная операция при врожденном или приобретенном пороке сердца, то изменения сердца могут иметь обратное развитие, и происходит возврат к норме. Часто исходом является декомпенсация гипертрофированного сердца, одной из причин которой является то, что процесс гипертрофии ограничен возможностью кровоснабжения органа. У гипертрофированных кардиомиоцитов возрастает потребность в кислороде, и несоответствие между потребностью в кислороде и способностью транспортных систем обеспечить им кардиомиоциты может привести к возникновению гипоксии миокарда. В условиях гипоксии возможно развитие жировой дистрофии миокарда, что сопровождается расширением полостей сердца и снижением его сократительной способности. Таким образом, в формировании рабочей гипертрофии миокарда можно выделить стадию компенсации, при которой повреждения структур миоцитов не происходит, и стадию декомпенсации, для которой характерны жировая дистрофия миокарда и клинически – сердечная недостаточность. б) Гиперплазия - увеличение объема органа или ткани за счет увеличения числа клеток и внутриклеточных структур вследствие повышенной функции органа (функциональная гиперплазия) или в результате патологического новообразования (патологическая гиперплазия). Примером может служить гиперплазия ряда эндокринных желез: тимуса, надпочечников и др. Этот процесс нельзя путать с гипертрофией (увеличением объема клеток). Оба процесса тесно связаны между собой и часто развиваются как сопутствующие друг другу. Однако при гипертрофии не происходит пролиферации клеток, в то время как гиперплазия наблюдается лишь в том случае, когда клеточная популяция спо
|
|||||||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 34; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.81.206 (0.073 с.) |