Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Часть А. Дайте полное решение заданий. Укажите номер правильного ответа:⇐ ПредыдущаяСтр 17 из 17
Укажите номер правильного ответа: 1. Массовая доля уксусной кислоты в растворе, полученном при смешивании 300 г 20%-ного и 600 г 15%- ного раствора, равна ______________________ г
1) 16,7 2) 8,45 3) 33,4 4) 20,5
2. При температуре 20оС давление насыщенного пара бензола равно 100 кПа. Давление насыщенного пара над раствором бензола (М = 78 г/моль) в 83 г которого содержится 12,8 нафталина (М = 128 г/моль) составляет _____ кПа 1) 100 2) 99 3) 90 4) 80
3. Уравнению реакции Zn (OH)2 + H 2 SO 4 → ZnSO 4 + 2 H 2 O соответствует сокращенное ионное уравнение 1) 2) 3) 4)
4. Кислая среда образуется при растворении в воде каждой из двух солей 1) MgSO4 и Zn(NO3)2 3) BaCl2 и AlCl3 2) K2S и K3PO4 4) CuCl2 и LiCl
5. В уравнении реакции, схема которой Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO + H2O сумма коэффициентов 1) 45 2) 50 3) 60 4) 52 Дайте полное решение задания, используя ионно-электронный метод.
Часть В. Выполните тестовые задания Дополните: 1. Моляльная концентрация раствора (Смоляльная) показывает ______________ 2. Закон эквивалентов имеет следующее математическое выражение ______ 3. Насыщенный пар – это ___________________________________________ 4. Давление насыщенного пара над чистым растворителем (ро) больше, чем давление растворителя над раствором неэлектролита (р1), так, как: 1) _________ 2) _________ 5. Электролиты – это __________________________________________________ 6. Кислые, основные и комплексные соли диссоциируют ___________________
7. Гидролиз соли протекает по катиону, если соль образована _____, рН = ____
8. Раствор гидроксида бария имеет рН = 12. Концентрация основания в растворе при 100 % диссоциации равна ________________________ моль/л
9. Окислитель в ходе реакции ____________________, поэтому его алгебраическая величина степени окисления ___________________________
10. В кислой среде: а) избыток кислорода в частице связываем ______________ с образованием _____________________________________ б) недостаток кислорода в частице берём из ____________ с образованием _________________________________________
Укажите номер правильного ответа:
11. Объём 0,1Н раствора КОН, необходимый для нейтрализации 20 мл 0,15Н раствора азотной кислоты, равен __________________________________ мл 1) 30 2) 25 3) 50 4) 40 12. При температуре 20оС давление насыщенного пара бензола равно 100 кПа. Давление насыщенного пара над раствором бензола (М = 78 г/моль) в 83 г которого содержится 12,8 нафталина (М = 128 г/моль) составляет ______ кПа 1) 100 2) 99 3) 90 4) 80 13. Диссоциация по трём ступеням возможна в растворе: 1) гидроксида алюминия 3) нитрата алюминия 2) хлорида алюминия 4) ортофосфата калия 14. Наиболее слабым электролитом является: 1) HF 2) HCl 3) HBr 4) HI 15. Уравнение реакции практически осуществимой в водном растворе имеет вид 1) CuSO4 + 2KOH → K2SO4 + Cu(OH)2 2) Fe2(SO4)3 + 6HNO3 → 2Fe(NO3)3 + 3H2SO4 3) NaNO3 + HCl → NaCl + HNO3 4) Ba(NO3)2 + 2NaOH → 2NaNO3 + Ba(OH)2
16. Одним из продуктов гидролиза нитрата железа (ΙΙΙ) по второй ступени является 1) Fe(OH)2NO3 3) FeOH(NO3)2 2) FeOH(NO3) 4) Fe(OH)3
17. Метилоранж желтый при растворении в воде каждой из двух солей 1) K2SO3 и Na3PO4 3) ZnCl2 и CuSO4 2) CaCl2 и FeCl3 4) Mn(NO3)2 и NaCl 18. В уравнении для расчета константы гидролиза хлорида аммония не учитывается значение концентраций 1) 19. Только восстановительные свойства проявляют вещества 1) KIO3 2) KIO2 3) KI 4) I2 20. Окислительно-восстановительную двойственность проявляют (два варианта ответа) 1) N2 2) NH3 3) NaNO2 4) NaNO3 СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Глинка, Н. Л. Задачи и упражнения по общей химии: учеб. пособие / Н. Л. Глинка. - Изд. стер. - М.: КноРус, 2012. - 240 с. 2. Глинка, Н. Л. Общая химия: [учеб. пособие] / Н. Л. Глинка. - М.: КноРус, 2011. - 746 с. 3. Егоров, В. В. Неорганическая и аналитическая химия. Аналитическая химия: учебник / В. В. Егоров, Н. И. Воробьева, И. Г. Сильвестрова. - Санкт-Петербург; Москва; Краснодар: Лань, 2014. - 139 с. 4. Задачи и упражнения по общей химии: учеб. пособие для вузов / [Адамсон Б. И. и др.]; под ред. Н. В. Коровина. - Изд. 2-е, испр. - М.: Высш. шк., 2004. - 255 с.
5. Князев, Д. А. Неорганическая химия: учеб. для вузов / Д. А. Князев, С. Н. Смарыгин. - 3-е изд., испр. - М.: Дрофа, 2005. - 587 с. 6. Коровин, Н. В. Общая химия: учебник / Н. В. Коровин. - Изд. 10-е, доп. - М.: Высш. шк., 2008. - 557 с. 7. Неорганическая химия: Биогенные и абиогенные элементы: учеб. пособие / [В. В. Егоров и др.]; под ред. В. В. Егорова. - СПб.; М.; Краснодар: Лань, 2009. - 307 с. 8. Попков, В. А. Общая химия. Биофизическая химия. Химия биогенных элементов: учебник для вузов / В. А. Попков, Ю. А. Ершов, А. С. Берлянд; под ред. Ю. А. Ершова. - 9-е изд. - Москва: Юрайт, 2012. - 556 с. 9. Саргаев, П. М. Неорганическая химия / П. М. Саргаев. - М.: КолосС, 2004. - 267 с. 10. Хомченко, Г. П. Неорганическая химия: учебник / Г. П. Хомченко, И. К. Цитович. - Изд. 2-е, перераб. и доп., репр. - СПб.: Квадро, 2009. - 460 с. 11. Цитович, И. К. Курс аналитической химии: учебник / И. К. Цитович. - Изд. 9-е, стер. - СПб.; М.; Краснодар: Лань, 2007. - 485 с
Катион | Pb2+ | М | М | Н | Р | Р | Н | Н | Р | Н | Н | Н | Н | Н | (Р – растворимое вещество, М – малорастворимое, Н- труднорастворимое; черта означает, что вещество не существует или разлагается водой | |||||||
| Sn2+ | Р | Р | Р | - | - | Н | - | Р | - | - | - | Н | Н | ||||||||||
| AI3+ | Р | Р | Р | Р | Р | - | - | Р | - | Н | - | Н | Н | ||||||||||
| Hg2+ | Р | М | Н | Р | Р | Н | Н | - | - | - | Н | Н | - | ||||||||||
| Zn2+ | Р | Р | Р | Р | Р | Н | М | Р | Н | Н | Н | Н | Н | ||||||||||
| Ba2+ | Р | Р | Р | Р | Р | Р | Н | Н | Н | Н | Н | Н | Р | ||||||||||
| Sr2+ | Р | Р | Р | Р | Р | Р | Р | Н | Н | Н | М | Н | М | ||||||||||
| Ca2+ | Р | Р | Р | Р | Р | Р | Н | М | Н | Н | М | Н | М | ||||||||||
| Mg2+ | Р | Р | Р | Р | Р | - | Н | Р | Н | Н | Р | Н | Н | ||||||||||
| Ag+ | Н | Н | Н | Р | Р | Н | Н | М | Н | - | Н | Н | - | ||||||||||
| Cu2+ | Р | Р | - | Р | Р | Н | Н | Р | - | - | Н | Н | Н | ||||||||||
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | Р | ||||||||||
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ||||||||||
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ||||||||||
| Li+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | ||||||||||
|
Анион | CI− | Br− | J− | NO3− | CH3COO− | S2− | SO32 | SO42- | CO32- | SiO32- | Cr042- | PO43- | OH− | ||||||||||
ПРИЛОЖЕНИЕ В
Таблица В.1 - Стандартные электродные потенциалы металлов (ряд активности
металлов)
| Металл | Электродный процесс | φ0 298, В |
| Li | Li ↔ Li+ + ē | -3,045 |
| Rb | Rb ↔ Rb+ + ē | -2,925 |
| K | K ↔ K+ + ē | -2,924 |
| Cs | Cs ↔ Cs+ + ē | -2,923 |
| Ra | Ra ↔ Ra2+ + 2ē | -2,92 |
| Ba | Ba ↔ Ba2+ + 2ē | -2,905 |
| Sr | Sr ↔ Sr2+ + 2ē | -2,888 |
| Ca | Ca ↔ Ca2+ + 2ē | -2,886 |
| Na | Na ↔ Na+ + ē | -2,714 |
| La | La ↔ La3+ + 3ē | -2,522 |
| Ce | Ce ↔ Ce3+ + 3ē | -2,48 |
| Mg | Mg ↔ Mg2+ + 2ē | -2,363 |
| Sc | Sc ↔ Sc3+ + 3ē | -2,077 |
| Pu | Pu ↔ Pu3+ + 3ē | -2,031 |
| Th | Th ↔ Th4+ + 4ē | -1,899 |
| Be | Be ↔ Be2+ + 2ē | -1,850 |
| Hf | Hf ↔ Hf4+ + 4ē | -1,700 |
| Al | Al ↔ Al3+ + 3ē | -1,66 |
| Ti | Ti ↔ Ti2+ + 2ē | -1,63 |
| Zr | Zr ↔ Zr2+ + 2ē | -1,539 |
| Mn | Mn ↔ Mn2+ + 2ē | -1,179 |
| V | V ↔ V2+ + 2ē | -1,175 |
| Nb | Nb ↔ Nb3+ + 3ē | -1,1 |
| Cr | Cr ↔ Cr2+ + 2ē | -0,913 |
| Zn | Zn ↔ Zn2+ + 2ē | -0,763 |
| Cr | Cr ↔ Cr3+ + 3ē | -0,744 |
| Ga | Ga ↔ Ga3+ + 3ē | -0,53 |
| Fe | Fe ↔ Fe2+ + 2ē | -0,44 |
| Cd | Cd ↔ Cd2+ + 2ē | -0,40 |
| Tl | Tl ↔ Tl+ + ē | -0,336 |
| Co | Co ↔ Co2+ + 2ē | -0,277 |
| Ni | Ni ↔ Ni2+ + 2ē | -0,250 |
| Mo | Mo ↔ Mo3+ + 3ē | -0,200 |
| Sn | Sn ↔ Sn2+ + 2ē | -0,136 |
| Pb | Pb ↔ Pb2+ + 2ē | -0,126 |
| Fe | Fe ↔ Fe3+ + 3ē | -0,037 |
| H2 | H2 ↔ 2H+ + 2ē | 0,00 |
Продолжение таблицы В 1
| ||
| W | W ↔ W3+ + 3ē | +0,11 |
| Sb | Sb ↔ Sb2+ + 2ē | +0,15 |
| Bi | Bi ↔ Bi3+ + 3ē | +0,215 |
| Cu | Cu ↔ Cu2+ + 2ē | +0,34 |
| Re | Re ↔ Re3+ + 3ē | +0,3 |
| Tc | Tc ↔ Tc2+ + 2ē | +0,4 |
| Ru | Ru ↔ Ru2+ + 2ē | +0,45 |
| Cu | Cu ↔ Cu+ + ē | +0,520 |
| Hg | 2Hg ↔ Hg2+ + 2ē | +0,789 |
| Ag | Ag ↔ Ag+ + ē | +0,799 |
| Os | Os ↔ Os2+ + 2ē | +0,85 |
| Hg | Hg ↔ Hg2+ + 2ē | +0,852 |
| Pd | Pd ↔ Pd2+ + 2ē | +0,987 |
| Jr | Jr ↔ Jr3+ + 3ē | +1,15 |
| Pt | Pt ↔ Pt2+ + 2ē | +1,188 |
| Au | Au ↔ Au3+ + 3ē | +1,50 |
| Au | Au ↔ Au+ + ē | +1.69 |
|
|
| ПРИЛОЖЕНИЕ Г Таблица Г.1 - Взаимодействие металлов с концентрированными серной и азотной кислотами, с разбавленной азотной кислотой
| Продукты реакции | Соль металла +SO2 + H2O | Кроме соли металла и воды возможно образование следующих продуктов: SO2, S, H2S | Соль металла + вода + H2S | Соль металла + вода + NO2, | Соль металла + вода + NO | Пассивируются HNO3 | Не взаимодействуют с HNO3 | Соль металла + вода + NO | Соль металла + вода + NH3 (или NH4NO3 при избытке кисло кислоты) или N2. |
| Тип кислоты | Концентрированная H2SO4 | Концентрированная HNO3 | Разбавленная HNO3 | |||||||
| Тип металла | Малоактивные металлы и Pb, Sn, Mo, Ni, Cd. | Металлы, стоящие в середине ряда напряжений металлов | Активные металлы, стоящие в начале ряда напряжений (по Al) | Малоактивные металлы, кроме Au и платиновых металлов | Активные металлы, кроме Al, Cr, Fe | Al, Cr, Fe | Au и платиновые металлы | Малоактивные металлы, кроме Au и платиновых металлов | Активные металлы | |
ПРИЛОЖЕНИЕ Д
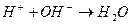
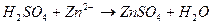
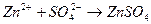
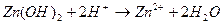
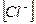 2)
2) 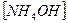 3)
3) 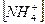 4)
4)