
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Важнейшие окислители и восстановители
Окислители – элементарные вещества. Окислителями могут быть элементарные вещества, нейтральные атомы которых способны путем присоединения электронов переходить в отрицательно заряженные ионы с электронной структурой ближайшего благородного газа. Так, молекулы галогенов Если окисление галогенами идет в кислой среде, то продуктами восстановления галогенов являются соответствующие галогеноводородные кислоты Окислители – кислородные кислоты, преимущественно высшие, и их соли. В состав окислителей обычно входят атомы элементов в высшей или в одной из боле высоких степеней окисления, например, Азотная кислота, действуя в качестве окислителя, восстанавливается до оксидов азота. В умеренно концентрированном состоянии образуется
В концентрированном состоянии наряду с
Концентрированная
При окислении двуокисью марганца, манганатом калия
В нейтральной или слабощелочной среде восстановление
Хромовая и двухромовая кислоты и их соли, действуя в качестве окислителей, восстанавливаются до трехвалентного катиона
Хлор и бром в кислородных кислотах и их солях, действуя в качестве окислителей, обычно переходят в отрицательно заряженные ионы
Окислители – ион Н+ и ионы металлов в их высшей степени окисления. В эту группу окислителей входят соединения, содержащие положительно заряженный ион Н+ (вода, кислоты и щелочи), который при взаимодействии с восстановителем переходит в элементарный водород. Ионы металлов в их высшей степени окисления, например Восстановители – элементарные вещества. К этой группе восстановителей относятся металлы и некоторые другие элементарные вещества, как, например, водород, углерод и др., атомы которых способны терять электроны и переходить в окисленное состояние. Металлы образуют при этом соответствующие соли в зависимости от кислоты, участвующей в реакции. Такие металлы, как цинк, алюминий и некоторые другие, могут восстанавливать и в щелочной среде, поскольку эти металлы растворимы в щелочах с образованием гидроксоцинкатов, гидроксоалюминатов и т. д. Являясь сильными восстановителями, при реакции, например с некоторыми растворами азотной или серной кислоты, они способны восстановить центральные ионы этих кислот до низших степеней окисления, т. е. до
Восстановители – низшие кислородные кислоты и их соли. Молекулы этих восстановителей содержат один или несколько атомов элемента в одном из его низших состояний окисления. При взаимодействии с окислителями эти атомы теряют электроны и образуют соединения, отвечающие максимальному положительному состоянию окисления данного элемента. Например,
Восстановители – положительно заряженные ионы металлов. К этой группе восстановителей относятся ионы металлов в их низшей степени окисления и способные при взаимодействии с окислителем повышать степень окисления за счет перехода электронов к окислителю. Восстановители – отрицательно заряженные элементарные ионы. К этой группе восстановителей относятся бескислородные кислоты и их соли, а также гидриды щелочных и щелочноземельных металлов (
Окислительно-восстановительная двойственность. При наличии у элемента способности проявлять переменные степени окисления, можно говорить о крайних и промежуточных степенях окисления его. Так, азот обладает крайними степенями окисления – 3 (в
Молекулы и атомы, отвечающие крайним степеням окисления, ведут себя однозначно: одни могут быть только восстановителями, другие – только окислителями. Азот в аммиаке и нитридах металлов достигает максимальной отрицательной степени окисления и не способен более к присоединению электронов. В азотной кислоте и ее солях азот достигает максимальной положительной степени окисления и не способен более терять электроны. Если же соединение или простое вещество содержит атомы элемента в промежуточной степени окисления, то оно может вести себя двояко: оно может и приобретать, и терять электроны. В первом случае оно ведет себя как окислитель, во втором – как восстановитель. Его поведение определяется химической природой элемента-партнера, с которым оно соприкасается, условиями и характером среды, в которой протекает окислительно-восстановительная реакция. Сера в свободном состоянии играет роль окислителя по отношению к водороду и металлам и роль восстановителя по отношению к кислороду или хлору. Водород в подавляющем большинстве случаев ведет себя как восстановитель, а по отношению к щелочным и щелочноземельным металлам – как окислитель. Азотистая кислота и нитриты являются восстановителями по отношению к сильным окислителям ( Большое влияние на направление окислительно-восстановительной реакции могут оказать условия, в которых она протекает. Перекись водорода в кислой среде окисляет йод в йодноватую кислоту, а при некоторой меньшей кислотности вновь восстанавливает йодноватую кислоту до свободного йода. Гидроксиламин в кислом растворе восстанавливает сульфат железа (III) в сульфат железа (II), а в щелочном растворе окисляет гидроокись железа (II) в гидроокись железа (III). Хлор, бром и йод диспропорционируют в щелочной среде, а в кислой среде реакция протекает в обратном направлении. Ниже приведены примеры некоторых соединений, проявляющих окислительно-восстановительную двойственность. Азотистая кислота и нитриты, действуя в качестве восстановителей, окисляются при этом в азотную кислоту или ее соли. Действуя в качестве окислителей, они восстанавливаются при этом до NO или более низких степеней окисления азота в зависимости от характера восстановителя. Гидроксиламин восстанавливается до аммиака, а окисляется до свободного азота или до N2О. Гидразин – сильный восстановитель, но сам может восстановиться, подвергаясь действию водорода в момент выделения.
Пероксид водорода, пероксиды металлов, дисульфид водорода
В молекулярно-ионном виде схемы имеют вид
Эти же соединения могут играть и роль восстановителей
с образованием свободного кислорода или свободной серы. Молекулярно-ионные схемы имеют вид
В зависимости от характера окислителя и условий реакции сера может подвергнуться более глубокому окислению
или по схеме
а в молекулярно-ионном виде
Говоря об окислительно-восстановительной двойственности, не следует забывать, что в некоторых случаях она может быть обусловлена различной природой отдельных составных частей молекулы. Так, соляная кислота является восстановителем за счет отрицательно заряженных ионов
Поэтому такие кислоты, как Электрохимические процессы Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами. Электрохимические процессы можно разделить на 2 основные группы: 1) процессы превращения химической энергии в электрическую (в гальванических элементах); 2) процессы превращения электрической энергии в химическую (электролиз). Простейшая электрохимическая система состоит из двух электродов и ионного проводника между ними. Электроды замыкаются металлическим проводником. Ионным проводником (проводником 2-го рода) служат растворы или расплавы электролитов, а также твердые электролиты. Электродами называют проводники, имеющие электронную проводимость (проводники 1-го рода) и находящиеся в контакте с ионным проводником. Для обеспечения работы системы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью электрохимической системы. Рассмотрим вначале общие закономерности электрохимических процессов. К ним относятся законы Фарадея, термодинамика и кинетика электрохимических процессов.
Законы Фарадея. В 1833 г. английский ученый Фарадей открыл законы, определяющие зависимость между количеством прошедшего электричества и количеством вещества, испытавшего химические превращения на электроде. С учетом современной терминологии законы Фарадея можно сформулировать в следующем виде: 1) количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества; 2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов. При превращении одного моля эквивалентов вещества на электроде через него проходит 96484, или округленно 96500 Кл (А∙с). Эта величина называется постоянная Фарадея F. Постоянную Фарадея можно рассчитать исходя из того, что один моль эквивалентов вещества несет 6,022∙1023 элементарных зарядов (постоянная Авогадро), а элементарный заряд равен 1,602∙10-19 Кл. Отсюда F = 6,022∙1023∙1,602∙10-19 = 96484 или ≈ 96500 Кл/(моль∙экв). Таким образом, зная количество вещества, испытавшего превращения на электроде, можно рассчитать теоретическое количество электричества, которое должно пройти через электрохимическую ячейку. Например, если в результате реакции
на электроде выделилось 63,54 г меди, то теоретическое количество электричества определяется из соотношения 96500 Кл (26,8 А∙ч) – 31,77 г Cu (масса моля эквивалентов) Отсюда следует, что через электрод теоретически должно пройти количество электричества
Или, если в результате реакции
на электроде выделилось при нормальных условиях 5,6 л водорода, то теоретическое количество электричества можно определить из соотношения 96500 Кл – 1 г Соответственно
На законах Фарадея основаны расчеты электрохимических установок, а на их базе созданы счетчики количества электричества (кулонометры, интеграторы тока) и другие устройства. Понятие об электродном потенциале. Рассмотрим процессы, протекающие при погружении металла в раствор собственных ионов. В узлах кристаллической решетки металла расположены ионы, находящиеся в равновесии со свободными электронами:
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Наиболее важной является реакция поверхностных ионов металла, находящихся в узлах решетки, с полярными молекулами воды, ориентированными у поверхности электрода. В результате взаимодействия происходит окисление металла, и его гидротированные ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле:
Металл становится заряженным отрицательно, а раствор – положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл – раствор возникает двойной электрический слой. Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода. По мере перехода ионов в раствор растет отрицательный заряд поверхности металла и положительный заряд раствора, что препятствует окислению металла. Наряду с этой реакцией протекает обратная реакция – восстановление ионов металла до атомов:
С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной реакции растет. При некотором значении электродного потенциала скорость прямого процесса будет равна скорости обратного процесса, устанавливается равновесие:
Для упрощения гидратационную воду обычно в уравнение реакции не включают, и оно записывается в виде
Равновесие имеет динамический характер, процессы при равновесии идут с одинаковой скоростью в прямом и обратном направлениях. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется электродным потенциалом. Абсолютные значения электродных потенциалов экспериментально определить невозможно. Однако можно определить разность электродных потенциалов. Поэтому для характеристики процессов пользуются относительными значениями электродных потенциалов. Для этого находят разность потенциалов измеряемого электрода и электрода, потенциал которого условно принимают равным нулю.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 143; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.172.252 (0.051 с.) |
 и
и  , выполняя функцию окислителей, превращаются в отрицательно заряженные ионы
, выполняя функцию окислителей, превращаются в отрицательно заряженные ионы  и
и  . Нейтральные атомы кислорода, серы и ее аналогов переходят в состояние окисления
. Нейтральные атомы кислорода, серы и ее аналогов переходят в состояние окисления  и т. д.
и т. д. и
и  . При окислении в щелочной среде получаются соли этих кислот, т. е. галогениды металлов. Сера при повышенной температуре ведет себя как окислитель по отношению к водороду и к металлам. Продуктами восстановления ее являются сероводород и сульфиды металлов.
. При окислении в щелочной среде получаются соли этих кислот, т. е. галогениды металлов. Сера при повышенной температуре ведет себя как окислитель по отношению к водороду и к металлам. Продуктами восстановления ее являются сероводород и сульфиды металлов.
 , а также
, а также  . В последних соединениях галогены находятся не в высших степенях окисления, однако они широко применяются в практике в качестве окислителей.
. В последних соединениях галогены находятся не в высших степенях окисления, однако они широко применяются в практике в качестве окислителей.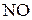 по схеме
по схеме
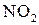 :
: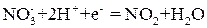
 , действуя в качестве окислителя, восстанавливается до
, действуя в качестве окислителя, восстанавливается до 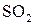 по схеме
по схеме
 или перманганатом калия
или перманганатом калия 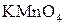 в кислой среде, т. е. в присутствии серной, разбавленной соляной (с концентрированной соляной кислотой эти окислители реагируют с выделением хлора), азотной или других кислот, происходит восстановление марганца до двухвалентного катиона, образующего соответствующие соли
в кислой среде, т. е. в присутствии серной, разбавленной соляной (с концентрированной соляной кислотой эти окислители реагируют с выделением хлора), азотной или других кислот, происходит восстановление марганца до двухвалентного катиона, образующего соответствующие соли 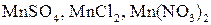 и т. д. по схемам:
и т. д. по схемам:

 , образующего соответствующие соли
, образующего соответствующие соли 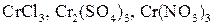 в зависимости от прибавляемой кислоты:
в зависимости от прибавляемой кислоты: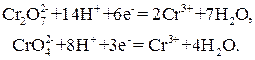
 и
и  . Йод в кислородных кислотах и их солях восстанавливается до свободного йода, а при действии более сильных восстановителей – до отрицательно заряженного иона
. Йод в кислородных кислотах и их солях восстанавливается до свободного йода, а при действии более сильных восстановителей – до отрицательно заряженного иона  .
. , выполняя функцию окислителей, переходят в ионы с более низкой степенью окисления.
, выполняя функцию окислителей, переходят в ионы с более низкой степенью окисления.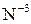 или
или  , по схемам:
, по схемам: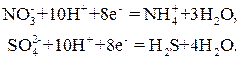

 и др.). Молекулы этих восстановителей содержат отрицательно заряженные элементарные ионы, способные терять электроны и переходить в состояние нейтральных атомов или молекул или претерпевать дальнейшее окисление.
и др.). Молекулы этих восстановителей содержат отрицательно заряженные элементарные ионы, способные терять электроны и переходить в состояние нейтральных атомов или молекул или претерпевать дальнейшее окисление. , аммонийных солях и нитридах металлов) и + 5 (в азотной кислоте, ее солях и производных). Можно привести ряд соединений, в которых степень окисления азота имеет промежуточное значение между указанными крайними значениями.
, аммонийных солях и нитридах металлов) и + 5 (в азотной кислоте, ее солях и производных). Можно привести ряд соединений, в которых степень окисления азота имеет промежуточное значение между указанными крайними значениями.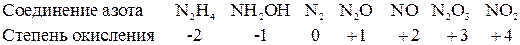
 ) и окислителями по отношению к восстановителям (
) и окислителями по отношению к восстановителям ( ). Аналогичным образом ведет себя и перекись водорода. Йод является слабым окислителем и сам окисляется более сильными окислителями, например хлорной водой или азотной кислотой.
). Аналогичным образом ведет себя и перекись водорода. Йод является слабым окислителем и сам окисляется более сильными окислителями, например хлорной водой или азотной кислотой.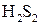 и дисульфиды металлов. В соединениях этого типа, т. е.
и дисульфиды металлов. В соединениях этого типа, т. е.  и некоторых других, содержатся двухзарядные ионы
и некоторых других, содержатся двухзарядные ионы  и
и  , поэтому степень окисления каждого из атомов кислорода и серы, образующих данные цепи, равна -1. В соответствии со сказанным выше эти соединения могут играть роль окислителей, действуя по схемам
, поэтому степень окисления каждого из атомов кислорода и серы, образующих данные цепи, равна -1. В соответствии со сказанным выше эти соединения могут играть роль окислителей, действуя по схемам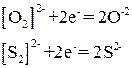
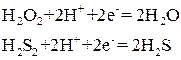





 и окислителем за счет положительно заряженных ионов Н+. Аммиак ведет себя как восстановитель за счет отрицательно заряженного
и окислителем за счет положительно заряженных ионов Н+. Аммиак ведет себя как восстановитель за счет отрицательно заряженного  и как окислитель по отношению к щелочным металлам, с которыми образует амиды:
и как окислитель по отношению к щелочным металлам, с которыми образует амиды:
 , являются как бы «двойными» окислителями. В концентрированном состоянии они окисляют главным образом за счет ионов
, являются как бы «двойными» окислителями. В концентрированном состоянии они окисляют главным образом за счет ионов  и
и 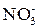 , а в разбавленном состоянии при взаимодействии с определенными металлами за счет Н+ – ионов.
, а в разбавленном состоянии при взаимодействии с определенными металлами за счет Н+ – ионов.
 « - 63,54 г «Cu
« - 63,54 г «Cu .
.
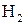 (11,2 л
(11,2 л 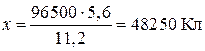 .
.
 .
.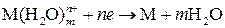 .
. .
.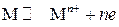 .
.


