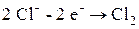Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электролиз расплавов и растворов солей
Электролизом называют процессы, происходящие на электродах под действием электрического тока, подаваемого от внешнего источника. При электролизе происходит превращение электрической энергии в химическую.
При плавлении происходит термохимическая диссоциация соли:
Если погрузить инертные (угольные) электроды и пропускать постоянный электрический ток, то ионы будут двигаться к электродам: катионы Na+ – к катоду, анионы Cl- – к аноду (рис. 6.3.). В итоге на катоде выделяется металлический натрий, а на аноде – хлор:
Электролиз растворов солей Пример 1. Электролиз водного раствора При электролизе водных растворов солей нужно учитывать: 1) все ионы в водном растворе гидратированы; 2) в водном растворе помимо самого вещества присутствуют молекулы воды и ионы Н+ и ОН-. Электролит Восстанавливаться на катоде могут только молекулы
Восстановление катионов Из-за возможных процессов окисления:
на аноде будет протекать реакция, которой отвечает меньший потенциал, то есть окисление воды с выделением О2. Итак, при электролизе водного раствора
причем электролит около катода становится щелочным, а около анода – кислым.
Суммарный процесс электролиза
Подобное изменение среды в электролите у катода и анода может быть использовано для получения щелочей и кислот, если обеспечить неперемешиваемость растворов у обоих электродов.
Аналогично протекает электролиз водных растворов солей, образованных щелочными и щелочно-земельными металлами и кислородсодержащей кислотой (
Пример 2. Электролиз водного раствора На катоде будут восстанавливаться катионы меди:
на аноде будет кислород в результате реакции окисления воды:
Суммарное уравнение электролиза:
Пример 3. Электролиз раствора На катоде при электролизе этого раствора выделяется водород
На аноде выделяется хлор по реакции
Именно таким путем – электролизом насыщенного раствора хлорида натрия – в промышленности получают хлор. Суммарное уравнение электролиза раствора
|
|||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 86; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.138.230 (0.009 с.) |
 Рис. 6.3. Схема электролиза расплава NaCl
Рис. 6.3. Схема электролиза расплава NaCl
 .
.
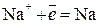 2 восстановление
2 восстановление 1 окисление
1 окисление

 .
. состоит из следующих частиц, способных участвовать в электродных процессах:
состоит из следующих частиц, способных участвовать в электродных процессах: 
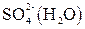 и
и  а также воды. Концентрация ионов
а также воды. Концентрация ионов 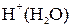 и
и 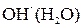 мала, так как обусловлена слабой диссоциацией молекул
мала, так как обусловлена слабой диссоциацией молекул 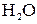 .
.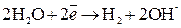
 невозможно из-за электроотрицательного потенциала (
невозможно из-за электроотрицательного потенциала ( В).
В).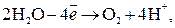
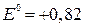 В,
В,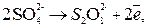
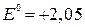 В.
В.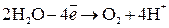 .
.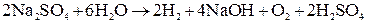 .
. ).
).
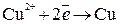 ;
;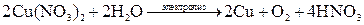 .
. .
. ,
, .
.