
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Некоторые области применения электрохимии
Идеи гальванических элементов и электролитических ячеек реализованы во многих электрохимических установках и технологиях. Большое значение имеют химические источники тока: первичные (необратимые), вторичные (обратимые) и топливные. Электрохимические технологии включают в себя: электросинтез (получение химических соединений с помощью электролиза), получение и очистку металлов (электрорафинирование), электроосаждение металлов (получение гальванических покрытий, порошков, копий и матриц), электрохимическую размерную обработку металлов и сплавов (основана на анодном растворении участков заготовки, подлежащих удалению). Для многих процессов коррозии металлов важную роль играют электрохимические цепи. Наряду с этим широко применяется электрохимическая защита металлов. Поскольку нет возможности описать все практические применения электрохимии, остановимся лишь на отдельных примерах. Сухая батарея. Ранее рассмотренные гальванические элементы относятся к жидкостным. Но для практического применения более удобны сухие элементы, которые принято называть сухими батареями (набор элементов для повышения напряжения). Наиболее распространены сухие элементы, включающие в себя цинковый анод и графитовый катод. Между электродами помещается водная паста, содержащая NH4Cl и твердый MnO2. При работе элемента на электродах протекают полуреакции Zn(к) → Zn2+(p) + 2e- (анод) 2NH4+(p) + 2MnO2(к) + 2е- → Mn2O3(к) + 2NH3(г) + Н2О(ж) (катод) Ион Zn2+ частично соединяется с NH3, образуя комплексный ион [Zn(NH3)4]2+. Первоначальная ЭДС такого сухого элемента около 1,5 В, но она уменьшается при понижении температуры окружающего воздуха и по мере расходования запаса энергии элемента. Существуют и другие виды сухих элементов. Например, никель-кадмиевый элемент. В нем протекают полуреакции Cd(к) + 2OH-(p) → Cd(OH)2(к) + 2e- (анод) NiOOH(к) + H2O(ж) → Ni(OH)2(к) + OH-(p) (катод). ЭДС элемента – около 1,3 В. Недостаток этого элемента – токсичность кадмия. Аккумуляторы. В отличие от сухих гальванических элементов аккумуляторы обеспечивают обратимость процессов разряда и заряда. К аккумуляторам предъявляются особые требования: они должны иметь большую электрическую емкость при малых массе и объеме, высокий КПД. С учетом этих требований большое распространение получили свинцовые (кислотные) и никелевые (щелочные) аккумуляторы. Перспективными считаются также цинк-серебряные и никель-кадмиевые аккумуляторы, испльзуемые в основном в космической технике.
Свинцовый аккумулятор. Его электроды представляют собой решетчатые пластины, изготовленные из сплава свинца. Ячейки пластин заполняют губчатым металлическим свинцом (анод) и диоксидом свинца PbO2 (катод). Электролитом является водный раствор H2SO4 с массовой долей 35-40 %, что соответствует плотности 1,29 г/см3. При работе аккумулятора как источника электрической энергии (процесс разрядки) на его электродах протекают полуреакции Pb(к) + HSO4-(p) → PbSO4(к) + Н+(р) + 2е- (анод); PbO2(к) + 3H+(p) + HSO4-(p) + 2e- → PbSO4(к) + 2H2O(ж) (катод). В результате обеих реакций образуется твердое вещество – PbSO4, которое остается в ячейках электродных пластин. На образование PbSO4 расходуется серная кислота, и ее концентрация в электролите уменьшается, соответственно понижается и плотность электролита. Один элемент такого аккумулятора дает ЭДС около 2 В. Для получения от аккумулятора напряжения 6 или 12 В в одной коробке соединяют последовательно несколько элементов (изготовляют батарею). Зарядку аккумулятора проводят за счет внешнего источника электрического тока. Для каждого элемента аккумулятора необходима внешняя ЭДС около 2,5 В. При зарядке аккумулятора полуреакции на его электродах идут в обратном направлении по сравнению с процессом разрядки. В частности, на аноде будет протекать полуреакция PbSO4(к) + 2H2O(ж) → PbO2(к) + 3H+(p) + HSO4-(p) + 2e-. Высокое перенапряжение при выделении О2 на свинцовом аноде препятствует разложению воды. Но в небольшой степени разложение воды происходит, что требует корректировки электролита, как по концентрации, так и по объему. В настоящее время разработаны свинцовые аккумуляторы, практически полностью исключающие процесс разложения воды. Электроды для них изготавливают из сплава свинца, содержащего добавку металлического кальция.
Недостаток свинцовых аккумуляторов – их большой вес. Примером щелочного аккумулятора является никель-кадмиевый элемент. Материалы электродов: анод – металлический кадмий, катод – гидроксид никеля (III) на металлическом никеле. Электролит – КОН. При разрядке аккумулятора на его электродах идут полуреакции Cd(к) + 2OH-(p) → Cd(OH)2(к) + 2e- (анод); NiOOH(к) + H2O(ж) → Ni(OH)2(к) + OH-(p) (катод). Продукты реакции остаются закрепленными на электродах, и обе полуреакции полностью обратимы. При зарядке аккумулятора они идут в обратном направлении. Напряжение одного элемента – около 1,3 В. Щелочные аккумуляторы обычно используются для изготовления малогабаритных источников электрической энергии. К этому типу аккумуляторов относятся также железоникелевые элементы. Топливные элементы – это элементы, в которых окислительно-восстановительная реакция непрерывно обеспечивается подачей реагентов, расходующихся в электродных процессах. Одновременно непрерывно удаляются продукты полуреакций. Например, окислительно-восстановительная реакция Н2(г) + 1/2О2(г) → Н2О(ж) (∆G = -237,2 кДж) характеризуется большой величиной молярной свободной энергии. Ее можно использовать в режиме горения водорода в кислороде (∆Н0 = -285,9 кДж). Однако полезная работа такого процесса не превышает 35 – 40 %, и нет обоснованной перспективы повышения ее эффективности (выводы по результатам анализа технической термодинамики). Не менее 50 % составляют потери энергии при преобразовании тепловой энергии в механическую и далее в электрическую. В топливном элементе идет прямое преобразование химической энергии в электрическую, и его КПД принципиально может достигать 75 %. В топливном элементе реакции окисления Н2 и восстановления О2 осуществляются раздельно, на разных электродах: 2Н2(г) + 4ОН-(г) → 4Н2О(ж) + 4е- (анод) О2(г) + 2Н2О(ж) + 4е- → 4ОН-(р) (катод) ___________________________________________________________. 2Н2(г) + О2(г) → 2Н2О(ж). Но суммарная реакция остается той же самой, что и при прямом воздействии Н2 и О2. В качестве электролита используется водный раствор КОН. Решение типовых задач Пример 1. Выяснить, в какую сторону пойдет реакция между двуокисью свинца и иодидом калия в кислой среде, если концентрация веществ (активность) равна 1 моль/л. Решение. 1) составляем уравнение:
2) пишем схему элемента для данной реакции:
3) находим окислительно-восстановительные потенциалы и ЭДС реакции:
Поскольку потенциал второй пары больше, чем первой, роль окислителя будет играть
Делаем вывод, что вышеуказанная реакция возможна, так как ЭДС является величиной положительной (идет она слева направо с напряжением 1,15 В). Пример 2. Определить, какой из металлов – барий или никель, лучше взаимодействует с разбавленной соляной кислотой. Решение.
ЭДС(1) = 0,00 – (- 2,90) = 2,90 В, ЭДС(2) = 0,00 – (- 0,25) = 0,25 В. ЭДС первой реакции в несколько раз больше, чем второй. Барий будет взаимодействовать с соляной кислотой более интенсивно, чем никель. Пример 3. Может ли перманганат калия окислить хлорид олова (II), если концентрация их растворов (активность) равна 1 моль/л?
Решение. Составляем уравнение реакции:
Находим потенциалы пар:
Вычисляем ЭДС реакции:
Устанавливаем, что Пример 4. Какова масса меди, выделившейся на электроде при прохождении через электрохимическую систему количества электричества 2F и выходе меди по току, равном единице (100%)? Решение. Согласно законам Фарадея, при похождении количества электричества, равного 2F, выделится 2 моль эквивалента меди, что составляет: MCu = MэCu · 2 = (63,57/2) г/моль · 2 моль = 63,57 г. Пример 5. Определите выход по току водорода, выделенного на электроде при нормальных условиях, если объем его составил 112 л при прохождении через электрод 1000А · ч. Решение. Объем моль эквивалента водорода при н.у. составляет 22,4/2 = 11,2 л. Для выделения такого объема водорода требуется количество электричества, равное 1F, или 26,8 А · ч. Следовательно, для выделения 112 л требуется 268 А · ч. Найдем выход по току водорода:
Пример 6. Вычислить электродный потенциал цинка в растворе Решение.
Э.д.с. гальванического элемента при различной активности концентрации катионов металла в растворе равна разности равновесных электродных потенциалов этих металлов. При этом, как и в случае стандартных потенциалов, следует при вычитании придерживаться условия, приведенного выше. Так, э.д.с. медно-цинкового электрода равна разности
получим выражение
Пользуясь уравнением (6.1), можно вычислить э.д.с. любой гальванической пары при условии образования обоими металлами катионов с одинаковым зарядом п. При различном значении п следует раздельно вычислить равновесные электродные потенциалы металлов и затем найти их разность. Анализ уравнения (6.1) приводит к выводу, что при одинаковом значении п обоих металлов и при равенстве их активностей Гальванические элементы и соответствующие им полуэлементы условно изображаются следующей записью, например
или в ионной форме
в которой одиночные вертикальные линии символизируют границу металл – раствор, а двойная – границы между обоими растворами электролитов. Пример 7. Вычислить ЭДС медно-кадмиевого гальванического элемента, в которой активность ионов
Решение. Для решения воспользуемся уравнением (6.1)
Пример 8. Вычислить ЭДС серебряно-кадмиевого гальванического элемента, в котором активные концентрации ионов Решение. Потенциалы отдельных электродов составляют:
отсюда Е = 0,74 – (- 0,47) = 1,21 В. Пример 9. Гальванические элементы могут быть получены не только из двух различных электродов, но и из двух одинаковых. Однако в этом случае они должны быть помещены в растворы с различной активностью катиона. При этом металлический электрод, помещенный в более разбавленный раствор, выполняет функцию отрицательного, а помещенный в более концентрированный – положительного электрода. Такие гальванические элементы получили название концентрационных. Определите ЭДС концентрационного медного элемента с активностями ионов меди, равными 10-1 моль/л у одного электрода и 10-3 моль/л у другого при 298 К. Решение. Рассчитаем равновесные потенциалы медных электродов по уравнению Нернста. Для первого электрода:
для второго электрода
Из сравнения величин потенциалов видно, что первый электрод в данном элементе является катодом, второй электрод – анодом и ЭДС равна: Е э = Е к – Е а = 0,3075 – 0,2485 = 0,059 В. 6.12. Задачи для самостоятельного решения 1. С помощью таблицы окислительно-восстановительных потенциалов ответить на поставленные вопросы (написать при этом уравнение реакции и определить ЭДС): А. Какой из металлов – Sn или Со – будет лучше взаимодействовать с рабавленной соляной кислотой HCl? Б. Будет ли FeCl2 окисляться газообразным хлором до FeCl3? В. Может ли металлическая медь окисляться разбавленной серной кислотой? Г. Сравнить восстановительную способность Mg, Al, Cu, по отношению к Cl2? Д. Может ли KMnO4 окислить RbI в кислой среде? 2. Исходя из степени окисления фосфора в соединениях РН3, Н3РО4, Н3РО3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: PbS + HNO3 → S + Pb(NO3)2 + NO + H2O. 3. Расставить коэффициенты методом полуреакций в уравнениях окислительно-восстановительных реакций: а) б) в) г) д) е) ж) з) и) к) л) м) 4.Определить величину электродных потенциалов: а) Ag / 0,01 M Ag+; б) Al / 0,005 M Al2(SO4)3; в) Pt, H2 / 0,01 M HCl; г) Pt, H2 / раствор с р ОН 5; д) Pt, H2 / 0,002 M H2SO4. 5. Имеется гальваническая цепь: а) Sn / Sn2+ б) Cu / Cu2+ в) Sn / 1 моль/л Sn2+ Указать: 1) окислитель и восстановитель; 2) полюсы гальванического элемента; 3) направление потока электронов во внешней цепи; 4) определить электродные процессы. 6. Вычислить ЭДС следующих гальванических цепей: а) Mn / 0,02 моль/л Mn2+ б) Zn / 0,01 M ZnSO4 в) Fe / 0,01 M FeSO4 7. Обозначить знаки электродов, указать направление потока электронов и вычислить ЭДС концентрационной цепи:
а) Pt, H2 / 0,01 M NaOH б) Pt, H2/0,001 M HCl в) Pt, H2/0,0001 M HCl г) Pt, H2 / раствор с рН 3 д) Pt, H2 / раствор с рН 9 е) Pt, H2 /0,02 M H2SO4 8. Рассчитайте ток в цепи при электролизе водного раствора поваренной соли на графитовых электродах, за 1 ч 40 мин и 25 с на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях. 9. Составьте уравнения реакций, протекающих на графитовых электродах при электролизе: а) расплава хлорида кальция; б) раствора хлорида кальция. Сколько времени (в час) потребуется для выделения на катоде вещества массой 4 г для случаев (а) и (б) при токе 1 А. 10. Какая масса (в г) гидроксида калия образовалась у катода при электролизе водного раствора K2SO4 на нерастворимых электродах, если на аноде выделилось 11,2 л газа, измеренного при нормальных условиях? 11. Написать электронно-ионные уравнения реакций, протекающих на аноде и катоде при электролизе водного раствора MnSO4, если электроды: а) угольные; б) марганцевые. 12. Написать электронно-ионные уравнения реакций, протекающих на аноде и катоде при электролизе водных растворов солей Zn(NO3)2, NaI, CuCl2, Ag2SO4, если электроды нерастворимые. ТЕМА 7. ХИМИЯ МЕТАЛЛОВ
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 64; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.70.163 (0.066 с.) |
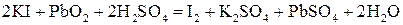 ;
;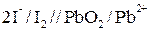 ;
;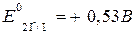 ,
, 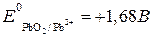 .
.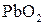 .
.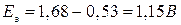 .
.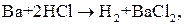
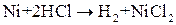 ,
, 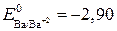 В,
В,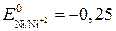 В,
В,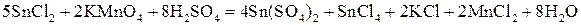 .
.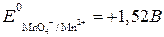 ,
,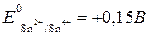 .
.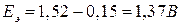 .
.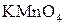 в кислой среде может окислить
в кислой среде может окислить 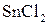 , так как ЭДС реакции положительная и приведенная выше реакция возможна.
, так как ЭДС реакции положительная и приведенная выше реакция возможна.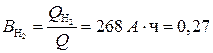 или (27%).
или (27%).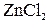 , в котором активность ионов
, в котором активность ионов 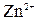 составляет 7
составляет 7 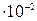 г-ион/л.
г-ион/л.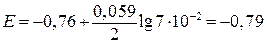 В.
В. , а после замены
, а после замены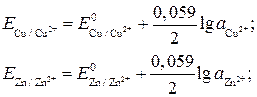
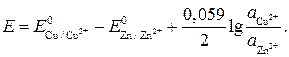 (6.1)
(6.1)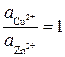 э.д.с. гальванического элемента равна разности стандартных потенциалов.
э.д.с. гальванического элемента равна разности стандартных потенциалов.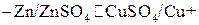
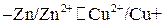 ,
,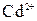 составляет 0,8 моль/л, а ионов
составляет 0,8 моль/л, а ионов 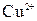 - 0,01 моль/л.
- 0,01 моль/л.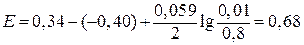 В.
В.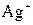 и
и 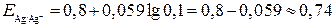 В,
В,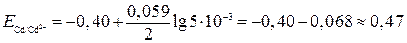 В.
В.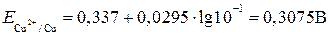 ,
,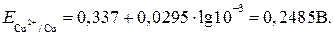
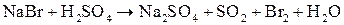 ;
;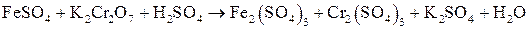 ;
;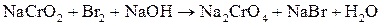 ;
;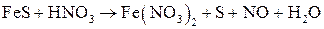 ;
;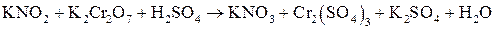 ;
;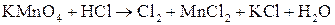 ;
;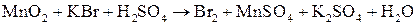 ;
;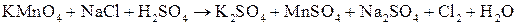 ;
;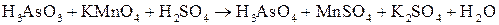 ;
;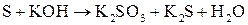 ;
;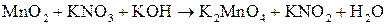 ;
;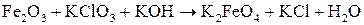 .
. Hg2+ / Hg;
Hg2+ / Hg;


