
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторная работа № 1: изучение гемодинамических показателейСтр 1 из 16Следующая ⇒
Пособие по дисциплине "Оптика и лазерная физика в медицине". Доцент кафедры общей и экспериментальной физики: Андрухова Татьяна Витальевна.
Лабораторная работа № 1: ИЗУЧЕНИЕ ГЕМОДИНАМИЧЕСКИХ ПОКАЗАТЕЛЕЙ
1. Измерение артериального давления методом Короткова. Для измерения давления крови в клинике применяется бескровный метод, предложенный более ста лет назад сотрудником Военно-Медицинской академии Н.С. Коротковым. Он заключается в том, что измеряют минимальное давление, которое необходимо приложить снаружи, чтобы сжать артерию до прекращения в ней кровотока. Это давление близко к давлению крови в артерии. При этом большое значение имеет выслушивание звуков, возникающих при прохождении крови через сжатую манжетой артерию. Прибор для измерения артериального давления по этому методу состоит из манжеты, нагнетателя (груши) и манометра. Для прослушивания звуков используется фонендоскоп. Манжета закрепляется в зоне плечевой артерии пациента, т.е. на уровне сердца пациента в его сидячем или лежачем положении. Фонендоскоп устанавливается в зоне локтевого сгиба. При закрытом выпускном клапане, в манжету нагнетают воздух, ритмически сжимая и отпуская грушу. Давление в манжете контролируется по манометру. Первоначально в манжете создается давление, на 10-20 мм рт. столба выше того, при котором перестает прослушиваться пульс на плечевой артерии. При полностью сжатой артерии никаких звуков через фонендоскоп не прослушивается. Затем, медленно открывая выпускной клапан, добиваются плавного снижения давления воздуха в манжете. При некотором давлении в манжете, работающее сердце оказывается в состоянии толчками проталкивать кровь через артерию. Начинают прослушиваться отчетливые тоны, называемые начальными. В этот момент времени показания манометра соответствуют максимальному, или систолическому давлению. Прослушиваемые при этом звуки обусловлены вибрацией стенок артерии при прохождении пульсовой волны. При дальнейшем снижении давления в манжете, начальные тоны дополняются шумами, которые обусловлены турбулентным течением крови в частично сдавленной артерии. По мере распрямления стенок артерии и восстановления ее нормального просвета, турбулентные шумы стихают и в фонендоскопе вновь прослушиваются только тоны, называемые последовательными. Эти тоны быстро ослабевают, и затем звуковые явления полностью прекращаются. В этот момент просвет артерии полностью восстановился, и в ней устанавливается ламинарное движение крови.
Показания манометра в момент окончательного исчезновения как турбулентных шумов, так и последовательных тонов, соответствуют минимальному, или диастолическому давлению крови. Совершению очевидно, что измерения артериального давления обсуждаемым методом должны производиться в бесшумном помещении. Но и при этом точный отсчет показаний манометра, соответствующих систолическому и диастолическому давлению, требует наличия определенных навыков, которые можно приобрести, выполняя данную работу. Необходима Ваша адекватная реакция на слуховые и зрительные воздействия, непрерывно получаемые Вами. Ошибки измерения. Ошибки измерения артериального давления состоят, главным образом, в том, что показания манометра считываются чуть раньше или чуть позже, чем следует. Это приводит к завышению или занижению результатов измерений. Своевременность реакций достигается практикой. Наряду с тем, что результаты измерения артериального давления могут зависеть от навыков измеряющего, они могут значительно зависеть от текущего психического состояния пациента. Например, установлено, что если давление измеряет врач, то оно оказывается несколько выше, чем в случае, когда измерения выполняет медсестра. Проявляется неодинаковость реакций психики пациента на врача и медсестру. Как общий вывод из сказанного, артериальное давление, как очень важный показатель состояния пациента, должно измеряться часто. Правила дезинфекции После использования камеру Горяева необходимо продезинфицировать 3% раствором перекиси водорода, промыть дистиллированной водой и вытереть мягкой салфеткой. Хранить камеру следует в сухом месте.
Дифракция света Понятие дифракции Явление дифракции заключается в огибании световой волной препятствий, т.е. в проникновении волны в область геометрической тени. Дифракция свойственна всякому волновому движению и обусловлена отклонениями от закона геометрической оптики. Если на пути светового пучка поместить какое-либо препятствие с резкими краями (щель, отверстие, диск и др.), то можно, используя принцип Гюйгенса – Френеля, рассчитать распределение интенсивности света в любой точке пространства. Указанное распределение интенсивности света часто называют дифракционной картиной.
Открытие и объяснение явления дифракции света является одним из основных доказательств волновой природы света. Сущность этого явления можно объяснить, привлекая принцип Гюйгенса – Френеля, согласно которому любая точка, до которой дошла световая волна, является новым источником элементарных сферических волн. Эти вторичные волны, пересекаясь, интерферируют. Результат интерференции зависит от разности фаз этих элементарных волн. Если в рассматриваемую точку (произвольная точка экрана) элементарные волны приходят с фазами, отличающимися на 2π (или на 2πm, где m – 1, 2, …), то напряженности электрических полей в этой точке складываются, т.е. элементарные волны взаимно усиливаются. В случае, когда элементарные волны приходят со значениями фазы, отличающимися на π (или на π + 2πm, где m – 1, 2, …), то колебания векторов напряженности электрического поля направлены в противоположно и взаимно ослабляются. Человеческий глаз или любой приемник света не в состоянии следить за быстро меняющейся напряженностью электрического поля (частота ν ~ 1014 Гц), а регистрирует только среднюю плотность потока энергии электрической волны, называемую интенсивностью где с – скорость света в вакууме, ε – диэлектрическая проницаемость среды, Е0 – амплитуда колебаний напряженности электрического поля. В тех точках, где колебания взаимно уничтожаются, результирующая амплитуда Е0 обращается в нуль. Говорят, что в этих точках наблюдаются дифракционные минимумы (темные (полосы) области). Наоборот, светлые области (полосы) появляются в точках, где вторичные волны взаимно усиливаются.
Дифракция света на щели.
Задача заключается в нахождении интенсивности света в различных точках экрана, расположенного за щелью. Решение задачи можно осуществить как с помощью графического, так и аналитического метода. Воспользуемся аналитическим методом. Для простоты рассмотрим случай нормального падения. Ширину элементарной полоски в плоскости щели ММ' обозначим dx. Световое возмущение (элементарная волна), вызванное каждой полоской и рассматриваемое в плоскости щели, пропорционально dx, т.е. Таким образом, можно записать
Для отыскания суммарной амплитуды в любой точке экрана Э, определяемой углом дифракции φ (угол между направлением падающей волны и направлением на точку на экране, где находится результирующая амплитуда), необходимо знать распределение фаз всех колебаний, приходящих в эту точку. Так как элементарные волны, дифрагированные под одинаковым углом φ, будут интерферировать на бесконечности (практически на достаточно большом удалении от щели), часто для удобства используют собирающую линзу Л. Поскольку линза не вносит дополнительной разности хода (а значит, и разности фаз), то распределение фазы в точке В будет таким же, как и в плоскости MF, образующей с плоскостью щели угол φ. Световое возмущение (элементарная волна), обусловленное произвольной полоской шириной dx, расположенной на расстоянии х от точки М в плоскости ММ', будет иметь в плоскости MF вид где k – волновое число, k = 2π/λ, λ – длина волны света. Как видно из выражения (3), в плоскости MF возникает дополнительная разность фаз, равная kN'F1, между полоской точки М и полоской, находящейся на расстоянии х. Из рисунка1 следует: kN'F1 = kх sinφ, таким образом выражение (3) будет иметь вид Результирующая амплитуда в точке В определяется как интеграл по всей ширине щели, т.е. от 0 до b В выражении (5) амплитуда результирующего колебания равна Интенсивность света в направлении угла φ есть величина, прямо пропорциональная квадрату амплитуды. Следовательно, имеем
где I0 – интенсивность света, идущего под углом φ = 0, т.е. в направлении начального пучка. Из выражения (7) видно, что при значении угла дифракции φ, удовлетворяющего условию
Рис. 2. Дифракционная решетка.
Основными параметрами дифракционной решетки являются ее период d = a+b, где b – ширина щели, а – ширина непрозрачного участка между щелями, и число щелей N. В направлении угла φ каждая из щелей посылает волну с амплитудой, определяемой выражением (6). Разность хода между волнами, исходящими от соседних щелей, равна, как видно из рисунка 3, Δ = d sinφ. Если Δ = 0; λ; 2λ; 3λ …, то разность фаз между всеми волнами, распространяющимися в направлении φ, окажется кратна 2π, и все колебания в этом направлении, пересекаясь в бесконечно удаленной точке, будут взаимно усиливать друг друга. Таким образом, если мы наблюдаем дифракцию в направлении φ, удовлетворяющем условию то увидим дифракционный минимум, амплитуда которого будет равна сумме амплитуд всех волн, исходящих из всех щелей, Соответственно, интенсивность дифракционных максимумов выразится в виде т.е. в N2 больше, чем интенсивность дифракционных максимумов в случае дифракции на одной щели. В результате интерференции многих пучков в дифракционной картине появятся дополнительные, по отношению к дифракции на одной щели, минимумы, которые сделают главные максимумы уже и резче. При этом появятся также дополнительные максимумы, рассматривать которые мы не будем., т.к. интенсивность их много меньше интенсивности главных максимумов. Следовательно, главные дифракционные максимумы получаются очень узкими, положение их по этой причине может быть измерено с высокой точностью, и по формуле (10) рассчитана длина волны.
Если на одну одномерную решетку наложить другую, повернутую относительно первой на 900,получится двумерная периодическая структура, отклоняющая свет во взаимно-перпендикулярных направлениях – например, в горизонтальном и вертикально. И в этом случае положение дифракционных максимумов будет описываться соотношением тина (10).
2. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ КРАТКАЯ ТЕОРИЯ В медицине на основе дегидратации строится множество методик научных исследований и лабораторной диагностики. Одним из прогрессивных методов является кристаллография биологических жидкостей (БЖ). Этот метод – кристаллография биологических жидкостей, основан на изучении различных характеристик фаций биологических жидкостей. Кристаллография базируется на исследовании и изучении структуры, атомно–молекулярного строения, физических свойств, образования и роста кристаллов и других характеристик фации биологической жидкости. Биологические жидкости (чаще всего используемые) это такие жидкости которые проще всего собрать – кровь, плазма крови, слюнная жидкость, слезная жидкость и др. Можно выделить принципиально только три варианта: свободная кристаллизация, в случае, если высушиванию подвергается непосредственно анализируемая биологическая жидкость; инициированный кристаллогенез, – визуализируется результат дегидратации системы «биосреда – базисное кристаллообразующее вещество» преимущественно на основании исследования структурогенеза последнего; парциальная кристаллизация (метод модельных композитов) – совокупность способов воссоздания отдельных составляющих кристаллоскопической картины определенного биологического субстрата. К настоящему времени в современной кристаллоскопии предложены следующие методы: 1. классическая кристаллоскопия – один из наиболее распространенных вариантов выполнения дегидратационного теста, сущностью которого является непосредственная кристаллизация биологических жидкостей. 2. тезиграфия относится к наиболее общим способам выполнения кристаллоскопического теста и представляет собой дополнительное введение в высушиваемую биожидкость организма человека различных химических веществ с целью инициации процессов кристаллообразования с использованием широкого спектра кристаллообразователей (NaCl, CaCl2, MgCl2 и другие), в большинстве своем обладающих комплексообразующими свойствами, причем концентрации у различных авторов в значительной степени варьируются 3. профильная дегидратация. Подразумевает нанесение биологических жидкостей на предметное стекло, предварительно обработанное раствором лецитина определенной концентрации. С помощью лецитина представляется возможным, по мнению авторов, изменить сродство кристаллов к основе, а, следовательно, трансформировать термодинамические характеристики дегидратируемого биосубстрата. 4. вакуумная кристаллоскопия предусматривает приготовление (высушивание) препаратов в условиях вакуума. Этим достигается изолированность дегидратируемого образца от внешней среды, создается относительно закрытая система, в которой и осуществляется непосредственно удаление жидкой части биосреды и процессы биокристаллизации. 5. кристаллизация биологических жидкостей в закрытой ячейке. Обеспечивается изоляция формирующегося образца от внешней среды аналогично вакуумной кристаллоскопии, однако технически данный способ более удобен для практического применения, так как не требует создания условий вакуума, а лишь использования закрытой ячейки, в которой возможным представляется проводить непосредственный микроскопический анализ. 6. поясная кристаллоскопия – кристаллографический метод исследования, основанный на изучении поясов кристаллов и отдельных кристаллических образований. Физико-химическим базисом способа является неоднородность компонентного состава биологических жидкостей в зависимости от молекулярных масс веществ, являющихся элементами данной биосреды, а, следовательно, различной их способности к передвижению по фации в процессе ступенчатой дегидратации образца и формирования фации. Это приводит к образованию одного или (значительно чаще) нескольких поясов кристаллизации, регистрация которых и позволяет судить о данной характеристике биологической жидкости. 7. метод клиновидной дегидратации. Способ дегидратации капли биологической жидкости, размещенной на прозрачной плоскости. Капля имеет форму клина на поперечном разрезе, что создает условия неравномерной скорости дегидратации в радиальном направлении. Это вызывает осмофоретическое перемещение растворенных веществ в объеме дегидратируемой капли в соответствии с физико-химическими параметрами и формирование четких, строго индивидуализированных структур, соответствующих состоянию организма, из которого была получена исследуемая жидкость. 8. поляризационная микроскопия – способ оценки результатов свободного или инициированного кристаллообразования биологической жидкости в поляризованном свете, позволяющий выявить некоторые дополнительные особенности как фации в целом, так и отдельных ее структурных элементов, а также охарактеризовать ее текстуру. Представляет собой универсальную модификацию подхода к визуализации результатов кристаллогенеза и может быть использован как дополнение к любому из кристаллографических методов исследования биосред. 9. субстратная конгрегация – вспомогательный кристаллографический метод, позволяющий моделировать кристаллообразование отдельных компонентов, являющихся составляющими биологических субстратов (липидов, белков, полисахаридов). В данном случае, по сравнению с методом «модельных композитов», достигается большее приближение к реальному составу биологической среды по ассортименту, но не по точному соотношению компонентов, однако имеется возможность учета изменений биожидкости по основным ее биохимическим элементам. 10. жидкокристаллическая термография – перспективная методика кристаллографических исследований, принципиальным моментом которой является использование холестерических жидкокристаллических (температурный интервал плавления 33,5-38,20С или 36,8-41,20С) покрытий изучаемых поверхностей системами с холестерилпеларголеатом, холестерилолеатом и т. д. В качестве «подложки» при этом используется кожа, на которую наносится состав. Интерпретация преобразования состояния жидких кристаллов оценивается при помощи специализированного спектрофотометра. 11. метод энергоинформационного переноса с биологических жидкостей на носитель заключается в переносе информации с биосред на «чистые горошины молочного сахара», затем на предметном стекле производится их соединение с 0,1 мл базисного вещества (5% водного раствора медного купороса). Приготовление микропрепаратов выполняется в темном помещении в течение 24 ч. Наиболее удобны и часто используемы следующие методы биокристаллографии: · клиновидной, · краевой, · профильной дегидратации; · с помощью поляризационной микроскопии, в закрытой ячейке. Метод клиновидной дегидратации наиболее прост и не требует больших материальных затрат, что, конечно, имеет немаловажную роль. Его изучением занимались такие специалисты как Шаболин В.Н., Шатохина С.Н. и многие другие. Кристаллизация – это физико-химическая реакция, при которой осуществляется переход каких-либо частиц (атомов, молекул, ионов) в кристаллическую фазу. Наиболее изученным и интересующим нас является способ кристаллизации из жидких фаз, хотя этот процесс возможен из любых дисперсных фаз, в том числе и газообразных.
Рисунок 2. Распределение неорганических солей и органических веществ в процессе высыхания капли биологической жидкости на твердой подложке: а – сагиттальный разрез; б – вид сверху
Кристаллизация начинается при определенных внешних условиях: переохлаждении жидкости, перенасыщении пара, дегидратации раствора, когда постепенно возникает множество мелких кристаллов вокруг центров кристаллизации и др. Кристалл растёт, присоединяя атомы или молекулы из жидкости или пара. Большинство природных и технических твердых материалов являются поликристаллами, одиночные кристаллы называют монокристаллами. Образование такой структуры можно объяснить тем, что испарение молекул воды с поверхности «куполообразного» жидкого препарата ведет к возникновению градиента концентраций растворенных в препарате веществ. Под действием гравитации и сил сцепления между молекулами кристаллизующейся пробы, а также между молекулами биопробы и подложки, на которой расположен препарат, в объеме капли возникают неустойчивости Бернара для концентрирующихся при испарении микрочастиц, что ведет к появлению в препарате видимых даже при небольшом увеличении аутоволн. Такие волны считают концентрационными самоорганизующимися структурами с развитой системой связей дальнего порядка. Процессы первичной кристаллизации БЖ идут в соответствии с естественными программами и технологией кристаллизации из раствора. Начало формирования аморфных структур, кристаллоидов, кристаллов характеризуется появлением первичных центров (зерен) кристаллизации в отдельных тонких слоях. Затем кристаллизация распространяется на следующие слои, что ведет к возникновению линейных, столбчатых или дендритных кристаллических структур. В начале этого процесса, в еще жидком препарате, наблюдается формирование ряда волновых процессов, и лишь на этом фоне по краю препарата, возникают зерна кристаллизации. Наличие жидкой фазы в ходе синтеза обуславливает образование дендритных структур. Из начальных центров кристаллизации развиваются новые элементарные первичные кристаллиты, которые сначала растут по краю окружности препарата, а затем превращаются в центростремительные линейные структуры с характерной ориентировкой зерен, столбчатых и дендритных и аморфных специфических структур. Затем процесс изменения концентраций быстро нарастает, и при этом сложные и длинные белковые молекулы меняют свое концентрическое направление на центростремительное. Это происходит потому, что линейные и нелинейные «каналы» формируются с неравномерными скоростями в зонах с разными градиентами концентраций. Это и вынуждает их ветвиться или образовывать фрактальные структуры. В жидкости, сложной по составу с преобладанием солей, последние занимают среднюю и центральную часть в пробе, а преимущественно органические молекулы – более периферическую его часть. Дегидратация органических составных частей идет медленнее, и после испарения основной части свободной воды начинает активизироваться процесс «борьбы субстратов» за связанную воду. В итоге отложения белков – линейные кристаллиты – раскалываются продольно, а процесс ретракции превращает их в (своего рода) каналы или трещины. В цельной крови на образование описанной структуры влияет наличие форменных элементов – эритроцитов. В препаратах цельной крови, в отличие от сыворотки или плазмы, на процесс самоорганизации тезиограммы искажающее влияние оказывает присутствие клеток. При этом, отдельные клетки могут играть роль центров кристаллизации, но больше проявляется влияние вышедшего в плазму крови из эритроцитов гемоглобина и др. компонентов клеточного содержимого. В этом случае в состав линейных кристаллитов, образованных фибрином и другими белками, имеющими длинные линейные размеры, поступает железосодержащий белок – гемоглобин. Это изменяет характер фрактализации линейных кристаллитов, сокращая их линейные размеры. У линейных кристаллитов цельной крови появляется значительно большее число остроконечных выпячиваний в наружные стороны и отростков, которые вследствие присутствия ионов железа становятся оптически более плотными. В отличие от препаратов цельной крови в ее плазме и сыворотке нет искажающего кристаллизацию влияния клеток, и поэтому формируется типичная кольцевидно-фрактальная структура. Крупные кристаллиты в пробах плазмы крови здорового человека или животного растут в центростремительном направлении, пока не сходятся в центре капли (в препаратах среднего и крупного объема). В процессе бурного роста кристаллитов и кристаллов солей навстречу друг другу, при их слиянии на стыках появлялись полости с газами или жидкостью, в которых вторично, мог идти процесс кристаллизации. В медицинской и биологической практике для чистоты эксперимента целесообразно выделять и делать упор на анализе наиболее стабильных и регулярно проявляющихся признаков. Чем меньше по объему и площади препараты, тем меньше в них случайных флуктуаций и тем выше взаимная обусловленность поведения ее частей. Малообъемные препараты формируют гораздо более неравновесные системы, в которых наблюдаются новые формы кристаллизации веществ. Если возбудить в пластинах малых размеров, с изгибами соизмеримыми длине волны, колебания (как в процессе кристаллизации БЖ), то при благоприятном соотношении параметров возбуждения (длины волны, частоты возбуждения, размера пластины, модуля упругости), на поверхности пластины в местах пересечения узловых линий образуются вращающиеся акустические зоны, обусловленные взаимодействием поверхностных и объемных волн. Кровь является типичным примером ткани организма, где одни коллоиды (клетки) находятся внутри других (плазма). Эти биоколлоиды, или жидкие кристаллы, обусловливают вязкость крови, которая в 5 раз превышает вязкость воды. Жидкокристаллические свойства составных частей крови, плазмы и других БЖ являются основой моделирования самых различных их ответных реакций на воздействие химических, физических и других факторов. Что во многом определяют способность БЖ к согласованному взаимодействию (синэргетике) и к самоорганизации. Синергетика, одна из основ самоорганизации, в противоположность кибернетике, исследует механизмы возникновения новых состояний, структур и форм в динамичных процессах структурообразования, а не сохранения или поддержания старых форм. Поэтому она опирается на принцип положительной обратной связи, когда изменения, возникшие на наноуровне в системе, под действием температурных, механических и других влияний, не подавляются или корректируются, а, наоборот, постепенно накапливаются и в итоге приводят к разрушению старой и возникновению новой макросистемы. Разрушение старой (водной) и самоорганизацию новой (воднообедненной) системы наблюдаются при постановке экспериментов с кровью, гемопрепаратами и другими БЖ. В основе этого динамичного процесса лежат фазовые переходы в биополимерах со свойствами жидких кристаллов (ЖК) в белках, нуклеиновых кислотах и т.п., в кооперативных системах (фосфолипидных мембранах, субклеточных биологических структурах), а также конформационные изменения биомолекул. Исследуемый образец БЖ в открытой системе становится самоорганизующейся диссипативной структурой. Свой вклад в формирование тезиографической картины (ТЗГ) биосубстратов может вносить кластеризация молекул воды. В зависимости от своей кластерной структуры вода способна играть роль матрицы и изменять свойства растворенных в ней солей, а также свойства белковых и углеводных компонентов биосубстратов – таких, как производные макроэргов, аденозинтрифосфата и многих молекул веществ, обладающих ферментной активностью. Кристаллизация крови и ее препаратов оказывается более сложным процессом, чем кристаллизация простых солей из раствора. По мнению А.Ф. Сонина, наблюдаемые в составных частях крови фазовые переходы имеют много общих черт с фазовыми переходами в сверхтекучем гелии. При этом роль квантово-механической волновой функции сверхтекучей фазы, не наблюдаемой в экспериментах с гелием, играет здесь амплитуда волны плотности. Многие молекулы крови имеют свойства ЖК, и в них отмечены аналогии между поведением некоторых дефектов диссипативных структур в жидких кристаллах с эффектом Джозефсена в сверхпроводниках и т.д. Просматриваются также аналогии в поведении ряда дефектов в жидких кристаллах с теоретически предсказанными свойствами магнитных монополей. Процесс формирования ТЗГ крови, ее препаратов или других БЖ оперирует уникальной информацией о ходе кристаллизации, начинающейся на наноуровне в условиях появления пересыщенного раствора и появления порядка среди частиц среды, вначале всего лишь в расположении нескольких атомов. В динамике кристаллизации БЖ важны два процесса: адсорбционный процесс, определяющий рост кристаллов и диффузионный процесс (молекулярная диффузия, режимы естественной и /или вынужденной конвекции), обеспечивающий массоперенос к растущему кристаллу, сопровождающийся рассеянием теплоты кристаллизации. Формирование характерных зональных структур означает окончание первой быстрой фазы динамичного процесса самоорганизации, характеризующееся удалением из препарата большей части жидкости. Эта фаза является наиболее чувствительной к различным факторам среды. В последующих медленно текущих фазах изменения структуры фации идут процессы освобождения из них остатков воды и газов, идет достраивание граней кристаллов солей. Эти процессы характеризуют начало фазы замедленной реструктуризации. Наряду с растрескиванием вдоль продольной оси кристаллитов, продолжается формирование простых кристаллов и кристаллитов сложного состава. Окружающая среда, воздействуя на БК или БЖ, может вызвать изменения в их форме и составе, что, в свою очередь, изменяет структуру и симметрию фации. Это уточняет разницу между кристаллизацией вне и в организме: кристаллизация вне организма – однонаправленный процесс, в организме же любой кристаллоид способен к обратному развитию – растворению. Пробоотбор, пробоподготовка. На поверхность пластины, изготовленной из стекла или иного материала, наносится капля исследуемой биологической жидкости, после чего следует процесс постепенного испарения жидкости (дегидратации) с поверхности данной капли. В ходе дегидратации, содержащиеся в жидкости вещества концентрируются по-разному из-за разной толщины капли: соли, растворённые в образце биологической жидкости (БЖ), при испарении стремятся к центру капли, белки и другие высокомолекулярные вещества остаются на периферии. В результате медленного испарения жидкости формируется тонкая плёнка, которую называют фацией. В процессе испарения воды в капле биологической жидкости происходит перераспределение растворенных веществ, в соответствии с их осмотической активностью, гидрофильностью, молекулярным весом, агрегатным состоянием и другими физико-химическими параметрами. БЖ несёт «структурную» диагностическую информацию о развитии патологического процесса. Особенности состояния организма сказываются на процессе кристаллизации жидкости, поэтому на изображении фации возникают характерные структуры. Наблюдения показали, что по имеющимся маркёрам и их расположению можно с большой уверенностью судить о состоянии организма. Обсудите ход и методику исследований биожидкостей методом биокристаллографии, проанализировав всевозможные варианты. Проведите забор исследуемых биожидкостей. Забор и подготовка образцов: 1. Кровь: · забор крови проводить из четвертого пальца левой руки. · кожу пальца обрабатывается антисептиком, · прокол делается стерильным скарификатором. · первую каплю крови снять. 2. Слюнная жидкость: · забор слюнной жидкости производится при помощи ложки Фолькмана или специальной канюли (средняя порция),
|
|||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 270; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.239.118 (0.086 с.) |
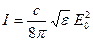 , (1)
, (1)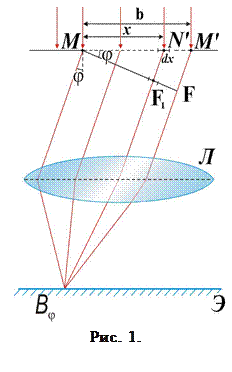 Пусть на щель шириной b падает плоская монохроматическая световая волна с амплитудой Е0 (рис. 1).
Пусть на щель шириной b падает плоская монохроматическая световая волна с амплитудой Е0 (рис. 1).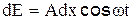 . Здесь ω – круговая частота падающего света, А – постоянная величина, которую можно найти следующим образом. Если амплитуду падающей волны, соответствующей всей ширине щели, обозначить через Е0, то справедливо условие:
. Здесь ω – круговая частота падающего света, А – постоянная величина, которую можно найти следующим образом. Если амплитуду падающей волны, соответствующей всей ширине щели, обозначить через Е0, то справедливо условие:  , откуда
, откуда 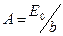 .
.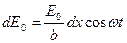 . (2)
. (2)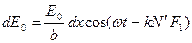 , (3)
, (3)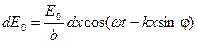 . (4)
. (4)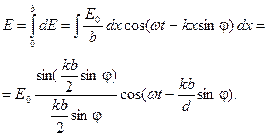 (5)
(5)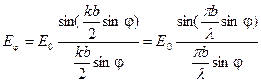 . (6)
. (6)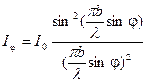 , (7)
, (7)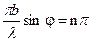 , где n – ±1, ±2, ±3, …, интенсивность равна нулю. Окончательно условие дифракционных минимумов имеет вид
, где n – ±1, ±2, ±3, …, интенсивность равна нулю. Окончательно условие дифракционных минимумов имеет вид 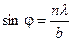 , n = ±1, ±2, ±3, …. (8)
, n = ±1, ±2, ±3, …. (8)
 Простейшая дифракционная решетка представляет собой систему параллельных щелей, расположенных на равных расстояниях друг от друга и разделенных непрозрачными участками (рис.3).
Простейшая дифракционная решетка представляет собой систему параллельных щелей, расположенных на равных расстояниях друг от друга и разделенных непрозрачными участками (рис.3).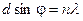 , n = 0, ±1, ±2, ±3, …, (10)
, n = 0, ±1, ±2, ±3, …, (10) . (11)
. (11)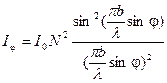 , (12)
, (12) Известно, что биологические жидкости (слюна, кровь, слезная жидкость, моча и др.) при высушивании кристаллизуются. В условиях патологии кристаллизационные свойства биологических жидкостей изменяются.
Известно, что биологические жидкости (слюна, кровь, слезная жидкость, моча и др.) при высушивании кристаллизуются. В условиях патологии кристаллизационные свойства биологических жидкостей изменяются. Метод клиновидной дегидратации, состоит в высушивании капли биологической жидкости на
Метод клиновидной дегидратации, состоит в высушивании капли биологической жидкости на



