
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Соотношение между растворимостью и произведением растворимости для солей различного состава. Расчёт растворимости малорастворимой соли. ⇐ ПредыдущаяСтр 5 из 5
Под растворимостью (s) обычно подразумевают концентрацию С (моль/л) насыщенного раствора данного вещества при определенной температуре. Провести расчеты растворимости различного типа малорастворимых соединений в их насыщенных растворах – электролитов типа AB, А2В или АВ2, А2В3. Условие выпадения осадков: Если произведение ионов в степенях стехиометрических коэффициентов соединения (ИП) больше, чем ПР, то осадок выпадет. Если в растворе эта величина не превышает значение ПР, то осадок не образуется. Привести пример расчета с учетом разбавления при сливании растворов. Факторы, влияющие на растворимость малорастворимых солей. Влияние температуры. Растворение большинства электролитов – процесс эндотермический. Поэтому повышение температуры является одним из главных факторов увеличения растворимости соединений. Влияние одноименного иона. Для системы PbCO 3 ↓ Pb (NO 3)2 → Pb 2+ + NO 3 - на основе принципа Ле Шателье показать сдвиг равновесия в сторону осадка. Обобщить – введение в систему одноименных ионов уменьшает растворимость малорастворимой соли. Провести расчет растворимости для этой системы и показать, что процесс растворимости с введением одноименных ионов резко тормозится. 3. Влияние кислотности раствора. Введение кислоты в рассматриваемую систему приводит к процессам связывания анионов CO32- с протонами: CO32- + Н+ 4. Влияние комплексообразования, в том числе образования гидроксокоплексов для соединений амфотерных элементов. Комплексообразование также должно повысить растворимость, поскольку ионы, вступающие в этот процесс, будут уходить из равновесия с осадком, сдвигая его в сторону продуктов реакции. 6. Солевой эффект также способствует повышению растворимости, т.к. соли –посторонние электролиты - могут связывать ионы, участвующие в равновесии с осадком, в различные ассоциаты посредством взаимодействия с молекулами растворителя, то есть также будут частично уводить их из равновесия раствор –осадок. При расчетах этого эффекта следует иметь ввиду, что в получаемом выражении для растворимости s коэффициент активности f, имеющий величину меньше 1, будет в знаменателе: s =√ ПР/f (выражение приведено для простейшей бинарной молекулы типа АВ). Последнее приведет к увеличению значения растворимости.
Способы уменьшения или увеличения растворимости малорастворимых соединений следует выбирать с учетом рассмотренных факторов, влияющих на растворимость малорастворимых солей.
|
|||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 379; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.149.45 (0.005 с.) |
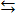 Pb 2+ + CO 3 2-
Pb 2+ + CO 3 2- HCO3- и далее HCO3- + Н+
HCO3- и далее HCO3- + Н+ 


