
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электролитическая диссоциация в растворах сильных и слабых электролитов в водных растворах.Стр 1 из 5Следующая ⇒
Растворы электролитов Дисперсная система – система, в которой вещество распространено в какой-то среде в виде мельчайших частиц. Чем меньше эти частицы, тем выше дисперсность. Раствор – гомогенная дисперсная система, состоящая из двух или более компонентов, в которой степень дробления вещества доведена до молекул. Соотношение между компонентами раствора может меняться произвольно. Растворитель – то, чего больше. Растворы бывают: газ в газе (воздух), газ в жидкости (минеральная вода), газ в тведом теле (стандартный водород-платиновый электрод), жидкость в газе (туман), жидкость в жидкости (огромное количество примеров), жидкость в твердом веществе (вода в сахаре), твердое вещество в газе (дым), твердое вещество в воде (сахар в воде), твердое вещество в твердом веществе (сплавы). Газ в жидкости Растворяется практически без взаимодействия с растворителем - Н2, О2, СО2 в воде, и с взаимодействия с растворителем – NH3, SO2, H2S в воде. При повышении температуры растворимость газов уменьшается, при увеличении давления возрастает. Объект нашего рассмотрения – водные растворы. Истинные растворы – размер частиц менее 10-7см, Коллоидные растворы - размер частиц менее 10-7 - 10-5см Взвеси – суспензии (твердое вещество в жидкости) и эмульсии, например, молоко (жидкое вещество в жидком) Растворы разбавленные, концентрированные, насыщенные, ненасыщенныс (С< Снасыщ.) и пересыщенные (С > Снасыщ.). Насыщенный раствор – раствор, в котором при данной температуре и давлении вещество больше не растворяется. Молярные концентрации (М) – определяются количеством моль растворенного вещества в 1 литре раствора Для пересчета концентраций используется соотношение n = М1∙ V1 = М2∙ V2 (46) где n - число моль растворенного вещества, М1, М2 и V1, V2 – исходная и конечная концентрации и объемы растворов. Зависимость растворимости от температуры – процесс растворения преимущественно эндотермический (привести график) Электролитическая диссоциация в растворах сильных и слабых электролитов в водных растворах. Раствор, в котором присутствуют подвижные ионы, становится электропроводным. Вещества, растворы которых проводят электричекий ток, называются электролитами.. Водные растворы многих других веществ, например, сахара, глюкозы, спирта, из-за того, что в их растворах отсутствуют ионы, практически не проводят электрический ток, и поэтому эти вещества называются неэлектролитами.
Электролитическая диссоциация – это полный или частичный распад растворенного вещества на сольватированные (гидратированные) ионы под действием растворителя. Концентрации ионов в растворах сильных электролитов Пример Al2(SO4)3 → 2 Al3+ + 3 SO42- При исходной концентрации соли С[Al2(SO4)3] = 1моль/л в соответствии со стехиометрическими коэффициентами концентрация ионов должна быть – С(Al3+) = 2моль/л, С(SO42-) = 3моль/л. На деле концентрация этих ионов несколько меньше. В растворах сильных электролитов нет молекул, но могут образовываться ассоциаты с растворителем. Для несвязанных с растворителем активных ионов было введено соотношение a ≤ C (49), где a = f∙C, f – коэффициент активности. f → 1 при С → 0. Коэффициент активности f зависит от суммы всех ионов т.е. от концентрации вещества (∑Ci),, и от зарядов Z ионов. Чем больше эти характеристики, тем больше коэффициент активности f. Существует соотношение, называемое ионной силой раствора μ, связывающее эти величины: μ = ½ ∑Ci∙ Z2 (50) Далее коэффициенты активности f вычисляются с помощью многих соотношений, простейшее - соотношение Дебая-Хюккеля lgf = -0.5 Z2√ μ (для μ < 0.01) (51) lgf = (-0.5 Z2√ μ)/ 1+√ μ (для μ в интервале 0.1 -0.01) (52) lgf = (-0.5 Z2√ μ)/ (1+√ μ) + 0.2 μ (для μ > 0.1) (53) Рассмотреть пример расчета
Слабые электролиты Рассмотреть примеры диссоциации кислот, оснований и солей с приведением констант диссоциации: НСN, NH3∙OH, Fe(OH)3, H3PO4, KHCO3, AlOHCl2, K2[HgI4] Амфотерность гидроксидов с точки зрения теории электролитической диссоциации. Реакции амфотерных гидроксидов с кислотами и основаниями Решение уравнения: а) при соотношении [Н+] = б) при соотношении C/K > 100 [Н+] = Аналонично для основания NH3∙ H2O Провести расчет концентраций ионов в одноосновной кислоте на примере HNO2 и
основании NH3∙OH. Расчёт равновесных концентраций ионов в растворах слабых многоосновных кислот – на примере H3PO4 Пусть С(H3PO4) = 1 моль/л. H3PO4 H2PO4- HPO42- Исходя из значений констант диссоциации k1 >> k2 >> k3 определение концентрации [Н+] и рН растворов осуществляется только по 1 ступени.
[Н+] = [Н+] ≈ [H2PO4- ] ≈ 9 ∙ 10-2 Cтепень диссоциации α = По второй ступени диссоциации K2 = Полученное по первой ступени соотношение [Н+] ≈ [H2PO4- ] позволяет их сократить в уравнении для K2: K2 ≈ [ HPO42-]. Таким образом для любой многоосновной кислоты концентрация анионов по второй ступени приблизительно равна второй константе K2 диссоциации кислоты. Пи третьей ступени диссоциации K3 = C учетом того, что равновесное количество протонов определяется первой ступенью ( [Н+] ≈ 9 ∙ 10-2) [ PO43-] = Концентрация недиссициированных молекул [ H3PO4] = C - [Н+] = 1 - 9 ∙ 10-2 = 1- 0.09 = 0.91
Электролитическая диссоциация воды. Ионное произведение воды Kw, его зависимость от температуры. Вода – слабый электролит. Н2О Kх.р. = [ Н+][ОН-] = K х.р. ∙ 55.55 = К W =10-14 (58) Зависимость КW от температуры: t КW 00C 0.13∙ 10-14 220C 10-14 550C 5.95 ∙ 10-14 1000C 7.4 ∙ 10-14 Нейтральная среда: из соотношения [ Н+][ОН-] =10- 14 [ Н+] = [ОН-] = 10-7 Кислотная среда: [ Н+] > [ОН-] > 10-7 Щелочная среда: [ Н+] < [ОН-] < 10-7 Водородный показатель как универсальная характеристика водных растворов. pH = - lg [ Н+] pOH = - lg [ОН-] При логарифмировании выражения [ Н+][ОН-] =10-14 получаем pH + pOH = 14 Рассмотреть вопрос о том, какая среда при pH = 7 в растворе при 550С.
Кислотно – основные индикаторы, их применение для определения кислотности раствора. Индикаторы – соединения, изменяющие свой цвет под влиянием среды. Обычно это слабые кислоты HInd, у которых цвет недиссоциированного соединения отличается от цвета аниона Ind-. Механизм действия индикатора можно грубо представить уравнением: HInd (окраска I) В кислой среде равновесие сдвигается в сторону недиссициированной формы HInd (окраска I), а в щелочной - сторону анионной формы Ind- (окраска II). Природные индикаторы (свекла, лимон) Смесь слабых кислот HA Н Ac Оба равновесия из-за взаимного влияния протонов сдвинуты влево. Поэтому [HA] ≈ CHA, [HAс] ≈ CHAс [H+] = [A-] + [Ac-] = [H+]2 = Ka∙ [HA] + Ka∙ [HAc] = Ka∙ CHA + Ka∙ CHAс [H+] = Буферные растворы. Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и ее соли (СН3СООН и CH3COONa — ацетатный буфер) или слабого основания и его соли (NH3 и NH4CI — аммиачный буфер). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи при разбавлении или концентрировании. Буферные растворы широко используют в различных химических и биохимических процессах. Ацетатный буфер СН3СООН CH3COONa → Na+ + СН3СОО- Аммиачный буфер NH3 ∙ Н2О NH4CI → NH4+ + CI- Значение pH буферного раствора можно рассчитать по формуле, полученной в предыдущей задаче при рассмотрении смеси слабой кислоты и ее соли
[ H + ] ≈ KHAc ∙ или pH = pK + lg Для смеси слабго основания ( NH3∙ OH) и его соли можно получить аналогичные соотношения: [ OH - ] ≈ Kb ∙ или p О H = pK + lg Механизм буферного действия 1. Разбавление или упаривание буферного раствора не влияет на величину рН, поскольку в формуле для ее расчета концентрация составляющих одного раствора содержится и в числители, и в знаменателе: [ H + ] ≈ Ka ∙ 2. Прибавление ограниченного количества кислоты или щелочи мало влияет на величину рН, поскольку в кислотных буферных системах это количество кислоты будет связываться с анионами соли с образованием прочной формы малодиссоциированной кислоты, а при добавлении щелочи роль буфера выполнит сама слабая кислота, связывая OH- в малодисоциируемую воду. В щелочных буферных системах эффекты аналогичны, только кислоту будут связывать молекулы слабого основания, а щелочь – катионы аммония. Буферная емкость определяется количеством кислоты (или щелочи), которое можно прибавить к 1л буферного раствора, чтобы рН изменился на 1. Рассмотрим ацетатный буферный раствор. СН3СООН CH3COONa → Na+ + СН3СОО- Для него [H+] ≈ KHAc ∙ Рассчитаем буферную емкость по кислоте без учета разбавления растворов. Добавление сильной кислоты вызовет связывание анионов СН3СОО- и увеличение количества слабой кислоты ровно на такое количество одноосновной сильной кислоты, которое мы добавляем в раствор. Пусть количеством кислоты, которое можно прибавить к 1л буферного раствора, чтобы рН изменился на 1, равно х (моль/л). При этом [H+] возрастет в 10 раз. 10 [H+] ≈ Ka∙ Разделив уравнение (b) на уравнение (a), получим: 10 = В простейшем случае CHAс = CNaAс. = 1 моль/л получаем значение х=0.82 моль/л. Прибавление такого количество кислоты изменит рН на 1. При расчете буферной емкости по щелочи следует иметь в виду, что [H+] уменьшится в 10 раз и добавление сильной щелочи вызовет связывание уксусной кислоты и увеличение количества СН3СОО-: 1/10 = Для аммиачного буферного раствора рассуждения аналогичны. Для подбора буферных растворов с определенным значением рН можно использовать формулу
pH = pK + lg При Cсоли = Cкислоты значения pH = pK. Для получения более точное значения рН следует варьировать соотношение Cсоли /Cкислоты и учитывать разбавление растворов. Буферные растворы имеют большое значение для протекания реакций в живых организмах. Например, в крови постоянство водородного показателя рН в пределах 7,37-7,44 поддерживается тремя независимыми буферными системами: бикарбонатной, фосфатной и белковой. Бикарбонатная буферная система - мощнейшая и, вместе с тем, самая управляемая система внеклеточной жидкости и крови, на долю которой приходится около 10 % всей буферной ёмкости крови. Представляет собой сопряжённую кислотно-основную пару, состоящую из молекулы угольной кислоты H2CO3, являющуюся источником протона и гирокарбонат-аниона HCO3−. Вне организма реализуется буфер с рН ≈ 6.35. В крови емкость фосфатной буферной системы невелика (составляет не более 1% общей буферной емкости), в связи с низким содержанием фосфатов в крови. Фосфатный буфер выполняет значительную роль в поддержании физиологических значений рН во внутриклеточных жидкостях и моче. Буфер образован неорганическими фосфатами. Кислотно-основная пара - дигидрофосфат (NaH2PО4) и гидрофосфат (Na2HPО4). Вне организма может давать буфер с рН ≈ 7.21. Белковая буферная система - самая мощная буферная система крови (в 9 раз мощнее бикарбонатной). На ее долю приходится 75 % всей буферной ёмкости крови. Белки́ плазмы крови, благодаря наличию кислотно-основных групп в молекулах белков образуют буферную систему, наиболее эффективную в диапазоне pH 7,2—7,4 Лекция 18. Теория Аррениуса не учитывала очень многих аспектов взаимодействий в растворах электролитов, например, не могла объяснить нейтрализацию кислоты солью слабого основания, не учитывала взаимодействия с растворителем, ограничивалась только водными растворами и не позволяла объяснить наличие основных свойств аммиака, фосфина и других соединений, не содержащих гидроксогрупп. Автопротолиз Протонный растворитель — растворитель, способный к автопротолизу, то есть передаче иона H+ от одной молекулы к другой. Это растворители, содержащие полярную связь с участием водорода и неподеленную электронную пару на каком-либо другом неметалле (чаще всего, азоте, кислороде или фторе): 2H2О HNO3 + H2SO4 Электронная теория Льюиса В теории Льюиса (1923 г.). кислота — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны принимать электронные пары. Это, например, протоны, ионы металлов, способные к комплексообразованию, соли типа AlCl3, димеризующиеся в Al2Cl6, а также такие вещества как BeF2, BF3 и др.. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы и молекулы, имеющие неподеленные пары (аммиак, вода, галогенид-ионы и др.) являются основаниями Льюиса.
В координационных соединениях Льюисовы кислоты – катионы или атомы металла, Льюисовы основания – лиганды.
Лекция 19. Гетерогенные равновесия Растворимость веществ в воде. Насыщенные и пересыщенные растворы. Строгих закономерностей, позволяющих предсказать растворимость того или иного соединения в воде, не существует. Процесс растворения ионных соединений связан с разрушением кристаллической решетки. Если энергия кристаллической решетки (ЭКР) больше энергии гидратации, то кристаллическое вещество не растворится в воде, если ЭКР меньше энергии гидратации, то кристаллическое вещество растворится. Имеют место наблюдения, что малый размер анионов F-, OH- часто приводит к тому, что их связи с ионами металла в кристаллических решетках очень прочные. Кристаллические решетки соединений с анионами с большим зарядом, такими как CO32-, PO43-, также часто имеют повышенные значения энергий. С другой стороны, соли больших по размерам однозарядных катиона NH4+ и анионов NO3-, ClO4- практически всегда растворимы в воде, что свидетельствует о пониженных значениях их ЭКР или больших энергиях гидратации, обусловленных множеством Н-связей. Насыщенный раствор – раствор, в котором при данной температуре и давлении вещество больше не растворяется и имеет в растворе определенную концентрацию С. Ненасыщенные растворы характеризуются концентрациями С< Снасыщ., а пересыщенные С > Снасыщ.. Гетерогенное равновесие - это равновесие, устанавливающееся на границе раздела фаз - осадок (твердая фаза) какого-либо вещества, находящийся в равновесии с насыщенным раствором того же вещества (жидкая фаза). ВаSO4 ↓ Для этой системы в момент равновесия скорость прямой реакции равна скорости обратной: V→ = V←, С учетом твердой фазы К→ = К←,[ Ba2+] [ SO42-]; Новая константа K = В общем случае гетерогенные равновесия осадок Влияние температуры. Растворение большинства электролитов – процесс эндотермический. Поэтому повышение температуры является одним из главных факторов увеличения растворимости соединений. Влияние одноименного иона. Для системы PbCO 3 ↓ Pb (NO 3)2 → Pb 2+ + NO 3 - на основе принципа Ле Шателье показать сдвиг равновесия в сторону осадка. Обобщить – введение в систему одноименных ионов уменьшает растворимость малорастворимой соли. Провести расчет растворимости для этой системы и показать, что процесс растворимости с введением одноименных ионов резко тормозится. 3. Влияние кислотности раствора. Введение кислоты в рассматриваемую систему приводит к процессам связывания анионов CO32- с протонами: CO32- + Н+ 4. Влияние комплексообразования, в том числе образования гидроксокоплексов для соединений амфотерных элементов. Комплексообразование также должно повысить растворимость, поскольку ионы, вступающие в этот процесс, будут уходить из равновесия с осадком, сдвигая его в сторону продуктов реакции. 6. Солевой эффект также способствует повышению растворимости, т.к. соли –посторонние электролиты - могут связывать ионы, участвующие в равновесии с осадком, в различные ассоциаты посредством взаимодействия с молекулами растворителя, то есть также будут частично уводить их из равновесия раствор –осадок. При расчетах этого эффекта следует иметь ввиду, что в получаемом выражении для растворимости s коэффициент активности f, имеющий величину меньше 1, будет в знаменателе: s =√ ПР/f (выражение приведено для простейшей бинарной молекулы типа АВ). Последнее приведет к увеличению значения растворимости. Способы уменьшения или увеличения растворимости малорастворимых соединений следует выбирать с учетом рассмотренных факторов, влияющих на растворимость малорастворимых солей. Растворы электролитов Дисперсная система – система, в которой вещество распространено в какой-то среде в виде мельчайших частиц. Чем меньше эти частицы, тем выше дисперсность. Раствор – гомогенная дисперсная система, состоящая из двух или более компонентов, в которой степень дробления вещества доведена до молекул. Соотношение между компонентами раствора может меняться произвольно. Растворитель – то, чего больше. Растворы бывают: газ в газе (воздух), газ в жидкости (минеральная вода), газ в тведом теле (стандартный водород-платиновый электрод), жидкость в газе (туман), жидкость в жидкости (огромное количество примеров), жидкость в твердом веществе (вода в сахаре), твердое вещество в газе (дым), твердое вещество в воде (сахар в воде), твердое вещество в твердом веществе (сплавы). Газ в жидкости Растворяется практически без взаимодействия с растворителем - Н2, О2, СО2 в воде, и с взаимодействия с растворителем – NH3, SO2, H2S в воде. При повышении температуры растворимость газов уменьшается, при увеличении давления возрастает. Объект нашего рассмотрения – водные растворы. Истинные растворы – размер частиц менее 10-7см, Коллоидные растворы - размер частиц менее 10-7 - 10-5см Взвеси – суспензии (твердое вещество в жидкости) и эмульсии, например, молоко (жидкое вещество в жидком) Растворы разбавленные, концентрированные, насыщенные, ненасыщенныс (С< Снасыщ.) и пересыщенные (С > Снасыщ.). Насыщенный раствор – раствор, в котором при данной температуре и давлении вещество больше не растворяется. Молярные концентрации (М) – определяются количеством моль растворенного вещества в 1 литре раствора Для пересчета концентраций используется соотношение n = М1∙ V1 = М2∙ V2 (46) где n - число моль растворенного вещества, М1, М2 и V1, V2 – исходная и конечная концентрации и объемы растворов. Зависимость растворимости от температуры – процесс растворения преимущественно эндотермический (привести график) Электролитическая диссоциация в растворах сильных и слабых электролитов в водных растворах. Раствор, в котором присутствуют подвижные ионы, становится электропроводным. Вещества, растворы которых проводят электричекий ток, называются электролитами.. Водные растворы многих других веществ, например, сахара, глюкозы, спирта, из-за того, что в их растворах отсутствуют ионы, практически не проводят электрический ток, и поэтому эти вещества называются неэлектролитами.
|
|||||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 75; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.142.115 (0.087 с.) |
 (если степень диссоциации α =
(если степень диссоциации α = 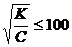 ) для решения уравнения используется соотношение
) для решения уравнения используется соотношение 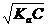 (56)
(56)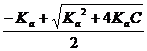 (57)
(57) NH4+ + OH-: [OН-] =
NH4+ + OH-: [OН-] =  или [ОН-] =
или [ОН-] = 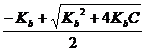
 Н+ + H2PO4- ; K1 = 8∙ 10-3
Н+ + H2PO4- ; K1 = 8∙ 10-3 Н+ + HPO42-; K2 = 6∙ 10-8,
Н+ + HPO42-; K2 = 6∙ 10-8,
 = 8∙ 10-3 > 100
= 8∙ 10-3 > 100 =
=  ≈ 9 ∙ 10-2
≈ 9 ∙ 10-2  = 9 ∙ 10-2 = 9%
= 9 ∙ 10-2 = 9% .
.
 =
= 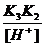 = 6∙ 10-8 ∙ 4∙ 10-13/9 ∙ 10-2 ≈ 3∙10-19
= 6∙ 10-8 ∙ 4∙ 10-13/9 ∙ 10-2 ≈ 3∙10-19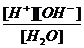 =
=  ;
; H+ + Ind- (окраска II)
H+ + Ind- (окраска II) H+ + A- KHA =
H+ + A- KHA = 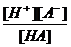 ; [A-] =
; [A-] = 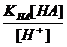
 ; [Ac-] =
; [Ac-] = 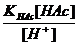

 = KHAc ∙
= KHAc ∙ 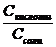
 = Kb ∙
= Kb ∙ 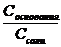
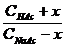 (b)
(b)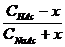 :
:  = [ Ba2+] [ SO42-] = ПР
= [ Ba2+] [ SO42-] = ПР насыщенный раствор при данной температуре характеризуется постоянной величиной, равной произведению концентраций ионов, возведенных в степень соответствующего стехиометрического коэффициента. Эта величина называется произведением растворимости (ПР), а в более строгих расчетах заменяется произведением активностей: ПР = aaA∙ abB
насыщенный раствор при данной температуре характеризуется постоянной величиной, равной произведению концентраций ионов, возведенных в степень соответствующего стехиометрического коэффициента. Эта величина называется произведением растворимости (ПР), а в более строгих расчетах заменяется произведением активностей: ПР = aaA∙ abB


