
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нивелирующее и дифференцирующее действие растворителя.
Силы кислот и оснований характеризуются их константой диссоциации. Константы диссоциации зависят от растворителя. Вода обычно нивелирует различия в сильных кислотах, например, галогенводородных – кроме HF, они все считаются сильными.Протонные растворители с высоким константами автодиссоциации («кислотные растворители», например HF) дифференцируют кислоты - в них кислоты становятся слабыми и различающимися по силе, но нивелируют основания - все основания становятся сильными. Реакция переноса протона идёт от более сильных кислот к более слабым. Электронная теория Льюиса В теории Льюиса (1923 г.). кислота — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны принимать электронные пары. Это, например, протоны, ионы металлов, способные к комплексообразованию, соли типа AlCl3, димеризующиеся в Al2Cl6, а также такие вещества как BeF2, BF3 и др.. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы и молекулы, имеющие неподеленные пары (аммиак, вода, галогенид-ионы и др.) являются основаниями Льюиса. В координационных соединениях Льюисовы кислоты – катионы или атомы металла, Льюисовы основания – лиганды.
Лекция 19. Гетерогенные равновесия Растворимость веществ в воде. Насыщенные и пересыщенные растворы. Строгих закономерностей, позволяющих предсказать растворимость того или иного соединения в воде, не существует. Процесс растворения ионных соединений связан с разрушением кристаллической решетки. Если энергия кристаллической решетки (ЭКР) больше энергии гидратации, то кристаллическое вещество не растворится в воде, если ЭКР меньше энергии гидратации, то кристаллическое вещество растворится. Имеют место наблюдения, что малый размер анионов F-, OH- часто приводит к тому, что их связи с ионами металла в кристаллических решетках очень прочные. Кристаллические решетки соединений с анионами с большим зарядом, такими как CO32-, PO43-, также часто имеют повышенные значения энергий. С другой стороны, соли больших по размерам однозарядных катиона NH4+ и анионов NO3-, ClO4- практически всегда растворимы в воде, что свидетельствует о пониженных значениях их ЭКР или больших энергиях гидратации, обусловленных множеством Н-связей.
Насыщенный раствор – раствор, в котором при данной температуре и давлении вещество больше не растворяется и имеет в растворе определенную концентрацию С. Ненасыщенные растворы характеризуются концентрациями С< Снасыщ., а пересыщенные С > Снасыщ.. Гетерогенное равновесие - это равновесие, устанавливающееся на границе раздела фаз - осадок (твердая фаза) какого-либо вещества, находящийся в равновесии с насыщенным раствором того же вещества (жидкая фаза). ВаSO4 ↓ Для этой системы в момент равновесия скорость прямой реакции равна скорости обратной: V→ = V←, С учетом твердой фазы К→ = К←,[ Ba2+] [ SO42-]; Новая константа K = В общем случае гетерогенные равновесия осадок
|
|||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 163; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.64.47 (0.003 с.) |
 Ba2+ + SO42-
Ba2+ + SO42- = [ Ba2+] [ SO42-] = ПР
= [ Ba2+] [ SO42-] = ПР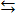 насыщенный раствор при данной температуре характеризуется постоянной величиной, равной произведению концентраций ионов, возведенных в степень соответствующего стехиометрического коэффициента. Эта величина называется произведением растворимости (ПР), а в более строгих расчетах заменяется произведением активностей: ПР = aaA∙ abB
насыщенный раствор при данной температуре характеризуется постоянной величиной, равной произведению концентраций ионов, возведенных в степень соответствующего стехиометрического коэффициента. Эта величина называется произведением растворимости (ПР), а в более строгих расчетах заменяется произведением активностей: ПР = aaA∙ abB


