
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Наиболее распространённые кислотно-основные индикаторы
Равновесия в смесях сильных и слабых электролитов - влияние одноименных ионов на диссоциацию слабых электролитов. Вычисление равновесных концентраций ионов в водных растворах, содержащих смеси сильных и слабых электролитов .. Смесь сильной и слабой кислоты В системе [Cl-] = CHCl, a pавновесие смещено в сторону недиссоциированной НА формы поэтому [HA] ≈ CHA НСl → H+ + Cl- HA [H+] = [Cl-] + [A-] = CHCl + [H+]2 - [H+] CHCl - Ka∙ CHA = 0 [H+] = Смесь слабых кислот HA Н Ac Оба равновесия из-за взаимного влияния протонов сдвинуты влево. Поэтому [HA] ≈ CHA, [HAс] ≈ CHAс [H+] = [A-] + [Ac-] = [H+]2 = Ka∙ [HA] + Ka∙ [HAc] = Ka∙ CHA + Ka∙ CHAс [H+] = Смесь слабой кислоты и ее соли НAc NaAc → Na+ + Ac- В системе равновесие смещено влево, поэтому [HAс] ≈ CHAс, а [Ac-] ≈ CNaAс KHAc = Буферные растворы. Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и ее соли (СН3СООН и CH3COONa — ацетатный буфер) или слабого основания и его соли (NH3 и NH4CI — аммиачный буфер). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи при разбавлении или концентрировании. Буферные растворы широко используют в различных химических и биохимических процессах. Ацетатный буфер СН3СООН CH3COONa → Na+ + СН3СОО- Аммиачный буфер NH3 ∙ Н2О NH4CI → NH4+ + CI- Значение pH буферного раствора можно рассчитать по формуле, полученной в предыдущей задаче при рассмотрении смеси слабой кислоты и ее соли [ H + ] ≈ KHAc ∙ или pH = pK + lg Для смеси слабго основания ( NH3∙ OH) и его соли можно получить аналогичные соотношения: [ OH - ] ≈ Kb ∙ или p О H = pK + lg Механизм буферного действия 1. Разбавление или упаривание буферного раствора не влияет на величину рН, поскольку в формуле для ее расчета концентрация составляющих одного раствора содержится и в числители, и в знаменателе: [ H + ] ≈ Ka ∙
2. Прибавление ограниченного количества кислоты или щелочи мало влияет на величину рН, поскольку в кислотных буферных системах это количество кислоты будет связываться с анионами соли с образованием прочной формы малодиссоциированной кислоты, а при добавлении щелочи роль буфера выполнит сама слабая кислота, связывая OH- в малодисоциируемую воду. В щелочных буферных системах эффекты аналогичны, только кислоту будут связывать молекулы слабого основания, а щелочь – катионы аммония. Буферная емкость определяется количеством кислоты (или щелочи), которое можно прибавить к 1л буферного раствора, чтобы рН изменился на 1. Рассмотрим ацетатный буферный раствор. СН3СООН CH3COONa → Na+ + СН3СОО- Для него [H+] ≈ KHAc ∙ Рассчитаем буферную емкость по кислоте без учета разбавления растворов. Добавление сильной кислоты вызовет связывание анионов СН3СОО- и увеличение количества слабой кислоты ровно на такое количество одноосновной сильной кислоты, которое мы добавляем в раствор. Пусть количеством кислоты, которое можно прибавить к 1л буферного раствора, чтобы рН изменился на 1, равно х (моль/л). При этом [H+] возрастет в 10 раз. 10 [H+] ≈ Ka∙ Разделив уравнение (b) на уравнение (a), получим: 10 = В простейшем случае CHAс = CNaAс. = 1 моль/л получаем значение х=0.82 моль/л. Прибавление такого количество кислоты изменит рН на 1. При расчете буферной емкости по щелочи следует иметь в виду, что [H+] уменьшится в 10 раз и добавление сильной щелочи вызовет связывание уксусной кислоты и увеличение количества СН3СОО-: 1/10 = Для аммиачного буферного раствора рассуждения аналогичны. Для подбора буферных растворов с определенным значением рН можно использовать формулу pH = pK + lg При Cсоли = Cкислоты значения pH = pK. Для получения более точное значения рН следует варьировать соотношение Cсоли /Cкислоты и учитывать разбавление растворов.
Буферные растворы имеют большое значение для протекания реакций в живых организмах. Например, в крови постоянство водородного показателя рН в пределах 7,37-7,44 поддерживается тремя независимыми буферными системами: бикарбонатной, фосфатной и белковой. Бикарбонатная буферная система - мощнейшая и, вместе с тем, самая управляемая система внеклеточной жидкости и крови, на долю которой приходится около 10 % всей буферной ёмкости крови. Представляет собой сопряжённую кислотно-основную пару, состоящую из молекулы угольной кислоты H2CO3, являющуюся источником протона и гирокарбонат-аниона HCO3−. Вне организма реализуется буфер с рН ≈ 6.35. В крови емкость фосфатной буферной системы невелика (составляет не более 1% общей буферной емкости), в связи с низким содержанием фосфатов в крови. Фосфатный буфер выполняет значительную роль в поддержании физиологических значений рН во внутриклеточных жидкостях и моче. Буфер образован неорганическими фосфатами. Кислотно-основная пара - дигидрофосфат (NaH2PО4) и гидрофосфат (Na2HPО4). Вне организма может давать буфер с рН ≈ 7.21. Белковая буферная система - самая мощная буферная система крови (в 9 раз мощнее бикарбонатной). На ее долю приходится 75 % всей буферной ёмкости крови. Белки́ плазмы крови, благодаря наличию кислотно-основных групп в молекулах белков образуют буферную систему, наиболее эффективную в диапазоне pH 7,2—7,4 Лекция 18. Теория Аррениуса не учитывала очень многих аспектов взаимодействий в растворах электролитов, например, не могла объяснить нейтрализацию кислоты солью слабого основания, не учитывала взаимодействия с растворителем, ограничивалась только водными растворами и не позволяла объяснить наличие основных свойств аммиака, фосфина и других соединений, не содержащих гидроксогрупп.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 120; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.71.237 (0.017 с.) |
 H+ + A- Ka =
H+ + A- Ka = 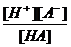 ; [A-] =
; [A-] = 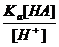

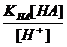
 H+ + Ac- KHAc =
H+ + Ac- KHAc =  ; [Ac-] =
; [Ac-] = 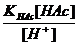

 H+ + Ac-
H+ + Ac-  ; [H+] ≈ KHAc∙
; [H+] ≈ KHAc∙ 
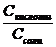
 = Kb ∙
= Kb ∙ 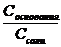
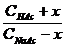 (b)
(b)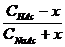 :
: 


