
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определите порядок реакции и рассчитайте, как изменится начальная скорость гомогенных химических реакций согласно закону действующих масс:
5.1.1. 2H2O2 ® 2H2O + O2; v = k [H2O2]; 5.1.2. 2NO2 ® 2NO + O2; v = k [NO2]2; 5.1.3. 2N2O ® 2N2 + O2; v = k [N2O]; 5.1.4. 2NO + H2 ® N2O + H2O; v = k [NO]2 [H2]; 5.1.5. 2O3 ® 3O2; v = k [O3]; 5.1.6. I2 + H2O ® HI + HIO; v = k [I2]; 5.1.7. 2NO + Cl2 ® 2NOCl; v = k [NO]2 [Cl2]; 5.1.8. C2H2 + H2 ® C2H4; v = k [C2H2] [H2]; 5.1.9. 2NO + O2 ® 2NO2; v = k [NO]2 [O2]; 5.1.10. CO + Cl2 ® COCl2; v = k [CO] [Cl2]3/2; 5.1.11. HCHO ® H2 + CO; v = k [HCHO]2; 5.1.12. 2F2O ® 2F2 + O2; v = k [F2O]2; 5.1.13. H2 + I2 ® 2HI; v = k [H2] [I2]; 5.1.14. H2 + Br2 ® 2HBr; v = k [H2][Br2]1/2; 5.1.15. 2ICl + H2 ® 2HCl + I2; v = k [ICl] [H2]; 5.1.16. C2Cl4 + Cl2 ® C2Cl6; v = k [Cl2]3/2; 5.1.17. 2NO + 2H2 ® N2 + 2H2O; v = k [NO]2 [H2]; 5.1.18. 2HI ® H2 + I2; v = k [HI]2; 5.1.19. HCOOH ® H2O + CO; v = k [HCOOH]; 5.1.20. 2NO + Br2 ® 2NOBr; v = k [NO]2 [Br2]; 5.2. Рассчитайте, как изменится скорость реакции при изменении 5.2.1. при повышении температуры от 20ºС до 50ºС, 5.2.2. при повышении температуры от 290 K до 300 К, 5.2.3. при повышении температуры от 20ºС до 60ºС, если g = 2 5.2.4. при повышении температуры от 20ºС до 60ºС, 5.2.5. при понижении температуры от –100ºС до –200ºС, 5.2.6. при повышении температуры от 300 К до 350 К, если g = 3 5.2.7. при повышении температуры от 400 К до 500 К, 5.2.8. при повышении температуры от 500 К до 1000 К, 5.2.9. при понижении температуры от 90ºС до 30ºС, если g = 2 5.2.10. при понижении температуры от 25ºС до 10ºС, если g = 2 5.2.11. при повышении температуры от 300 К до 320 К, 5.2.12. при повышении температуры от 27ºС до 37ºС, если Ea = 10 кДж/моль
5.2.13. при понижении температуры от –10ºС до –50ºС, 5.2.14. при повышении температуры от 320 К до 350 К, 5.2.15. при повышении температуры от 25ºС до 50ºС, если g = 3 5.2.16. при понижении температуры от 250 К до 220 К, 5.2.17. при повышении температуры от 260 К до 400 К, 5.2.18. при повышении температуры от 60ºС до 100ºС, если g = 3 5.2.19. при повышении температуры от 200 К до 220 К, 5.2.20. при понижении температуры от 180 К до 20 К, если Ea = 4,2 кДж/моль 5.3. Определите, в каком направлении сместится равновесие гомогенных химических реакций, для оценки влияния температуры на степень смещения химического равновесия рассчитать ΔН реакции: 5.3.1. 2CH4 5.3.2. 4NH3 + 3O2 5.3.3. 2NO + O2 5.3.4. 2CO + O2 5.3.5. 2SO3 5.3.6. 2NO2 5.3.7. 3H2 + N2 5.3.8. C2H2 + H2 5.3.9. 2CO + 2H2 5.3.10. C2H4 + H2O 5.3.11. 4HCl + O2 5.3.12. C2H4 + H2 5.3.13. 2N2O 5.3.14. CO + 2H2 5.3.15. 2NO2 5.3.16. 2H2 + O2 5.3.17. 2CH4 + 2NH3 + 3O2 5.3.18. 2F2O
5.3.19. 2NH3 5.3.20. 2SO2 + O2 5.4. Найдите константы равновесия гомогенных химических реакций и исходные концентрации реагентов, если в закрытом сосуде установились следующие равновесные концентрации: 5.4.1. 2O3 5.4.2. 2CO + O2 5.4.3. C2H2 + H2 5.4.4. 2H2 + O2 5.4.5. N2 + 3H2 5.4.6. 2NH3 5.4.7. H2 + I2 5.4.8. 2NO2 5.4.9. COCl2 5.4.10. CH3COOH + C2H5OH 5.4.11. 2HI 5.4.12. N2O4 5.4.13. СO2 + H2 5.4.14. 2SO2 + O2 5.4.15. C2H4 + H2O 5.4.16. 2CH4 5.4.17. 2NO + O2 5.4.18. 2NOCl 5.4.19. NH3 + CH4 5.4.20. 2H2O 5.5. Запишите выражения для констант равновесия гетерогенных химических реакций и определите, в каком направлении сместится равновесие для оценки влияния температуры на степень смещения химического равновесия рассчитать ΔН реакции: 5.5.1. 2PbO(тв.) + O2(г.) 5.5.2. C(графит) + 2H2(г.) 5.5.3. 2H2S(г.) + SO2(г.) 5.5.4. 2NaHCO3(тв.) 5.5.5. Mg(OH)2(тв.) 5.5.6. 4CuO(тв.) 5.5.7. CaCO3(тв.) 5.5.8. Fe2O3(тв.) + 3C(графит) 5.5.9. Cu2(OH)2CO3(тв.) 5.5.10. 3MnO2(тв.) 5.5.11. 2KNO3(тв.) 5.5.12. C(графит) + CO2(г.) 5.5.13. NH3(г.) + HCl(г.) 5.5.14. CaO(тв.) + H2O(г.) 5.5.15. SiO2(тв.) + 4HF(г.) 5.5.16. NH4NO3(тв.) 5.5.17. 2CuSO4(тв.) 5.5.18. NH4NO2(тв.) 5.5.19. 2KMnO4(тв.) 5.5.20. ZnCO3(тв.) Растворы Закон Рауля:
Эбулиоскопическая формула: Криоскопическая формула:
|
|||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 379; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.102.225 (0.036 с.) |
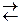 C2H2 + 3H2
C2H2 + 3H2 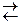 MgO(тв.) + H2O(г.)
MgO(тв.) + H2O(г.)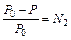 , где P 0 — давление насыщенного пара над чистым растворителем, P — над раствором, N 2 — мольная доля растворенного вещества.
, где P 0 — давление насыщенного пара над чистым растворителем, P — над раствором, N 2 — мольная доля растворенного вещества.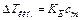 , где KE — эбулиоскопическая константа, с m — моляльная концентрация растворенного вещества;
, где KE — эбулиоскопическая константа, с m — моляльная концентрация растворенного вещества; 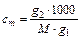 , где g 1 — масса растворителя, g 2 — масса растворенного вещества, M — молярная масса растворенного вещества.
, где g 1 — масса растворителя, g 2 — масса растворенного вещества, M — молярная масса растворенного вещества. , где КК- криоскопическая константа.
, где КК- криоскопическая константа.


