
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные классы неорганических соединенийСтр 1 из 8Следующая ⇒
СБОРНИК КОНТРОЛЬНЫХ РАБОТ ПО КУРСУ ОБЩЕЙ ХИМИИ
Учебное пособие
D H (реакции)= = S D Hf (продуктов)– S D Hf (реагентов)
Казань – 2006 Печатается по рекомендации УМЦ КГТУ им. А.Н. Туполева
Рецензенты: проф. Будников Г.К. (Казанский государственный университет) проф. Евгеньев М.И. (Казанский государственный технологический университет)
Авторы: А.Н. Глебов, А.Р. Буданов, О.В. Лавриненко,Н.М. Воеводина, И.П. Оранская, И.Г. Григорьева, С.А. Мальцева, А.И. Шамкаева, А.А. Кулаков, Н.В. Кремлева, Э.В. Гоголь, А.Г. Мельникова, А.В. Желовицкая, Р.Р. Гумерова, А.И. Юнусова, Д.В. Фролов, Е.П. Чеклаукова, С.М. Шавалеева, Е.Н. Офицеров Сборник контрольных работ по курсу общей химии: Учебное пособие для студентов всех форм обучения/Под редакцией проф. А.Н. Глебова. – 3-е изд., перераб. и доп. – Казань: «Экоцентр», 2006. – 44 стр.
Учебное пособие предназначено для студентов технического университета, изучающих общую химию по дневной, вечерней и заочной формам обучения. Пособие составлено в соответствии с учебным планом, программой курса общей химии. «Сборник контрольных работ» способствует более полному освоению изучаемого материала и развитию навыков самостоятельной работы студентов. В пособии приведены контрольные задания по основным темам курса общей химии, необходимые расчетные формулы, даны решения типовых задач. Необходимые справочные данные приведены в «Практикуме по общей химии» Часть I, Казань, изд-во «Экоцентр», 2003 г., 88 с.
ã Издательство «Экоцентр», 2006 г. Основные классы неорганических соединений Классификация химических соединений базируется на реагентах и продуктах одной из основных химических реакций — реакции нейтрализации: оксиды (кислотные и основные), кислоты, основания, соли. Взаимосвязь между основными классами неорганических веществ можно упрощенно представить в виде схемы:
Химические свойства основных классов неорганических соединений:
1.1. Назовите следующие вещества и укажите, к какому классу
1.2. Напишите формулы следующих соединений:
1.3. Составьте уравнения реакций получения следующих соединений
Основные законы химии Закон Авогадро: равные объемы газов при одинаковых условиях содержат одинаковое количество молекул. Уравнение состояния идеального газа (Менделеева – Клапейрона):
где p - давление, Па; V - объем, м3; m - масса, кг; M - молярная масса, кг; Химическим эквивалентом вещества называется такое его количество, которое соединяется с 1 г водорода или замещают его в соединении. Эквивалентная масса элемента равна его атомной массе, деленной на валентность. Эквивалентная масса кислоты (основания) равна их молярной массе, деленной на основность (кислотность). Эквивалентная масса окислителя (восстановителя) равна его молярной массе, деленной на число электронов, принимаемых (отдаваемых) в ходе реакции. 2.1. Рассчитайте давление в сосуде: 2.1.1. объемом 5 л, содержащем 16 г кислорода и 28 г азота при 273 К
2.1.2. объемом 20 л, содержащем 28 г этилена и 10 г аргона при 50ºС 2.1.3. объемом 10 л, содержащем 16 г метана и 42 г азота при –10ºС 2.1.4. объемом 20 л, содержащем 16 г кислорода и 28 г азота при 30ºС 2.1.5. объемом 20 л, содержащем 8 г метана и 4 г водорода при 298 К 2.1.6. объемом 5 л, содержащем 18,25 г хлороводорода и 20,25 г бромоводорода при 80ºС 2.1.7. объемом 5 л, содержащем 1 г водорода и 2 г гелия при 20ºС 2.1.8. объемом 20 л, содержащем 16 г оксида серы (IV) и 7 г азота при 15ºС 2.1.9. объемом 10 л, содержащем 14 г оксида углерода (II) и 44 г оксида углерода (IV) при 0ºС 2.1.10. объемом 50 л, содержащем 24 г метана и 4 г гелия при 0ºС 2.1.11. объемом 20 л, содержащем 8 г водорода и 30 г этана при 80ºС 2.1.12. объемом 20 л, содержащем 2 г гелия и 42 г азота при 20ºС 2.1.13. объемом 20 л, содержащем 8 г кислорода и 22 г оксида углерода (IV) при 398 К 2.1.14. объемом 20 л, содержащем 32 г кислорода и 14 г азота при 318 К 2.1.15. объемом 5 л, содержащем 4 г водорода и 8,5 г аммиака при 50ºС 2.1.16. объемом 10 л, содержащем 10 г аргона и 48 г кислорода при 273 К 2.1.17. объемом 50 л, содержащем 20 г гелия и 8 г водорода при –100ºС 2.1.18. объемом 50 л, содержащем 17 г фосфина и 6 г водорода при 200ºС 2.1.19. объемом 10 л, содержащем 34 г аммиака и 14 г азота при 50ºС 2.1.20. объемом 10 л, содержащем 51 г аммиака и 7 г азота при 50ºС Следующих молекул и ионов:
3.5. Объясните с помощью метода молекулярных орбиталей возможность образования следующих молекул и ионов, определите порядок связи, установите, являются ли они диамагнитными или парамагнитными:
Химическая термодинамика Первое начало термодинамики: D U = Q – A, где U — внутренняя энергия, Q — теплота, A — работа. Закон Гесса: тепловой эффект химической реакции зависит только от начального и конечного состояния, но не зависит от пути превращения. Следствие из закона Гесса: D H (реакции) = S D Hf (продуктов) – S D Hf (реагентов), где H — энтальпия (D H = D U + p D V), D Hf — энтальпия образования вещества. Второе начало термодинамики:
Для изолированных систем: D S ³ 0. D S (реакции) = S S (продуктов) – S S (реагентов). Свободная энергия Гиббса: D G = D H – T D S, D G (реакции) = S D Gf (продуктов) – S D Gf (реагентов). Для самопроизвольных реакций D G < 0. 4.1. Пользуясь справочными данными, вычислите тепловой эффект 4.1.1. 2SO2(г.) + O2(г.) = 2SO3(г.) 4.1.2. 4NH3(г.) + 3O2(г.) = 2N2(г.) + 6H2O(г.) 4.1.3. 2С2H2(г.) + 5O2(г.) = 4CO2(г.) + 2H2O(г.) 4.1.4. С2H5OH(ж.) + 3O2(г.) = 2CO2(г.) + 3H2O(ж.) 4.1.5. 2KClO3(тв.) = 2KCl(тв.) + 3O2(г.) 4.1.6. 4HCN(г.) + 5O2(г.) = 2H2O(ж.) + 4CO2(г.) + 2N2(г.) 4.1.7. CO2(г.) + C(графит) = 2CO(г.) 4.1.8. C2H4(г.) + 3O2(г.) = 2CO2(г.) + 2H2O(г.) 4.1.9. WO3(тв.) + 2Al(тв.) = Al2O3(тв.) + W(тв.) 4.1.10. TiO2(тв.) + 2Mg(тв.) = Ti(тв.) + 2MgO(тв.) 4.1.11. 2H2O2(ж.) = 2H2O(ж.) + O2(г.) 4.1.12. (CuOH)2CO3(тв.) = 2CuO(тв.) + CO2(г.) + H2O(г.) 4.1.13. Fe2O3(тв.) + 3СO(г.) = 2Fe(тв.) + 3СO2(г.) 4.1.14. CH4(г.) + 2O2(г.) = CO2(г.) + 2H2O(г.) 4.1.15. 2C2H6(г.) + 7O2(г.) = 4CO2(г.) + 6H2O(г.) 4.1.16. 6CO2(г.) + 6H2O(ж.) = C6H12O6(тв.) + 6O2(г.) 4.1.17. 2Fe2O3(тв.) + 3С(графит) = 4Fe(тв.) +3СO2(г.) 4.1.18. С6H12O6(тв.) = 2С2H5OH(ж.) + 2CO2(г.) 4.1.19. 2H2S(г.) + SO2(г.) = 3S(ромб.) + 2H2O(г.) 4.1.20. 4NH3(г.) + 5O2(г.) = 4NO(г.) + 6H2O(ж.) Растворы Закон Рауля:
Эбулиоскопическая формула: Криоскопическая формула: Напишите полные ионные, сокращенные ионные и молекулярные уравнения реакций, описывающих поведение следующих металлов в водных растворах соляной и азотной кислот, в воде и растворе щелочи (при необходимости пользуйтесь диаграммой электрохимической устойчивости воды и таблицей стандартных потенциалов восстановления):
Примеры решения типовых задач 1.3.3
Для получения 142 г Na2HPO4 нужно взять 80 г NaOH; для получения 1 г Na2HPO4 нужно взять x г NaOH: Для получения 142 г Na2HPO4 нужно взять 98 г H3PO4; для получения 1 г Na2HPO4 нужно взять y г H3PO4: Ответ. Для получения 1 г гидрофосфата натрия нужно взять 0,56 г гидроксида натрия и 0,69 г фосфорной кислоты. 2.3.2
Ответ. K2MnO4. 3.3.5 При составлении уравнений ядерных реакций соблюдается равенство суммы зарядов и массовых чисел в левой и правой частях уравнения. При этом заряд электрона учитывается со знаком минус, протона и позитрона — со знаком плюс. Нейтрон и гамма-квант заряда не имеют. Кроме того, массы электронов, позитронов и гамма-квантов не учитываются. Сумма зарядов частиц в левой части уравнения: 92 + 0 = 92 (нейтрон заряда не имеет), значит, ядро нового элемента имеет заряд 92 – 56 = 36 (криптон). Сумма массовых чисел частиц в левой части уравнения: 235 + 1 = Ответ. 4.4.9 Найдем при помощи справочных данных изменения энтальпии и энтропии реакции при стандартных условиях:
D H (реакции) = 2×(–241,8) = –483,6 (кДж);
D S (реакции) = 2×188,7 – 2×130,5 – 205 = –88,6 (Дж/К); T = D H /D S = 483600 / 88,6 = 5460 (K). Ответ. 5460 К. 5.2.3 Используем правило Вант-Гоффа: Ответ. Скорость реакции увеличится в 243 раза. 5.4.5 2NO2 Равновесная концентрация [NO] = 0,024 M, значит, равновесная концентрация кислорода в два раза меньше: [O2] = 0,012 М. Учитывая, что стехиометрические коэффициенты перед NO2 и NO одинаковы, [NO2]0 = 0,006 + 0,024 = 0,030 (моль/л). Ответ. Ke = 0,192 моль/л, [NO2]0 = 0,030 М. 6.2.5 Масса полученного раствора m = 70 + 50 = 120 (г). Масса растворенного вещества m 2 = 0,40×70 + 0,15×50 = 35,5 (г). Массовая доля растворенного вещества wm = Масса растворителя m 1 = 120 – 35,5 = 84,5 (г). Моляльная концентрация Ответ. wm = 29,6%; cm = 12,4 моль/кг. 6.3.5 n1 = 50/18 = 2,778 (моль); n2 = 4,5/176 = 0,026 (моль); Ответ. D P / P 0 = 0,0093 7.4.9 Так как для сероводородной кислоты Ka 1 = 10–7, то используем приближенную запись закона разбавления Оствальда: Ответ. a = 0,18%. 7.5.3 3Pb(NO3)2 + 2Na3PO4 = Pb3(PO4)2¯ +6NaNO3 3Pb2+ + 6NO3– + 6Na+ + 2PO43– = Pb3(PO4)2¯ + 6Na+ + 6NO3– 3Pb2+ + 2PO43– = Pb3(PO4)2¯ ПР = [Pb2+]3×[PO43–]2 При смешении равных объемов растворов концентрация каждого из них уменьшается в два раза. K ’ = 0,000053×0,000052» 3×10–22 K ’ > ПР, значит, выпадает осадок. Ответ. Выпадает осадок Pb3(PO4)2. А Запишем стандартные восстановительные потенциалы электрохимических систем, участвующих в реакции: Fe3+ + 2I– Ок-ль Fe3+ + Вост-ль I2+ 2 Поскольку j°ок > j°вос, то окислителем является ион Fe3+, а восстановителем — ион I–, т.е. реакция протекает слева направо. Ответ. В стандартных условиях указанная реакция протекает слева направо. 9.2.6 Найдем значения электродные потенциалов: Т.к. jFe > jCd, то на аноде окисляется кадмий, на катоде восстанавливаются ионы железа. Е = –0,47 – (–0,52) = 0,05 (В). Ответ. Е = 0,05 В. 9.4.3 K(–): Mg2+ +2 A(+): 2Cl– = Cl2 + 2 Масса магния, выделившаяся на катоде: Ответ. m = 2,27 г.
Примеры задач повышенной трудности 11.1 ( Всероссийская олимпиада среди технических вузов, 1999 г.) Негашеную известь получают в шахтных печах, загружая в них шихту, состоящую из смеси угля с известняком. В каком соотношении следует смешать эти вещества, чтобы процесс протекал без подвода тепла извне? При расчете необходимо учесть, что потери теплоты составляют 40%. 11.2 (Всероссийская олимпиада среди технических вузов, 1999 г.) При коррозии железа, покрытого кадмием, в кислой среде работает гальванический элемент: Fe | 0,1 М Fe2+, 1 М HCl | Cd Определить, как изменится ЭДС гальванического элемента вследствие поляризации электродов, если концентрация ионов Fe2+ возросла до 0,15 моль/л и перенапряжение водорода составляет 0,08 В (j°(Fe2+/Fe) = –0,44 В). Написать процессы, происходящие на аноде и на катоде, показать характер поляризационных кривых.
11.3 (олимпиада КГТУ, 1999 г.) Ученые обнаружили параллельную Вселенную, в которой некоторые физические законы отличаются от нашей Вселенной. Так, там выполняются принцип запрета Паули, правила Гунда и Клечковского, но электроны подчиняются следующим ограничениям на квантовые числа: n > 0; l = 0, 1, …, (n – 1); m = +1 или –1; s = +1/2 или –1/2. Какие порядковые номера имеют в параллельной Вселенной первые два «инертных газа»? 11.4 (олимпиада КГТУ, 1999 г.) Граната Ф1 состоит из оболочки массой 300 г и заряда тринитротолуола (C7H5N3O6) массой 80 г. Теплота взрыва ТНТ составляет 4190 кДж/кг, взрыв происходит без доступа воздуха. В кинетическую энергию осколков (средняя масса осколка 10 г) переходит 0,1% энергии взрыва. Запишите уравнения реакций взрыва и горения ТНТ. На какую максимальную высоту поднимется осколок, если он взлетает вертикально, а сопротивление воздуха пренебрежимо мало?
11.5 (Республиканская олимпиада школьников, 1998 г.) Д.И. Менделеевым была предложена формула для расчета теплового эффекта сгорания угольного и нефтяного топлива: Qp = 81×C + 246×H – 26(O – S) [ккал/кг], где Qp — удельная рабочая теплота сгорания теплота топлива, определенная при условии, что вода, образовавшаяся при сгорании топлива и влага, содержавшаяся в топливе, полностью сконденсированы, С — массовая доля углерода в топливе (выраженная в %), Н — массовая доля водорода, О — массовая доля кислорода, S — массовая доля серы. а. Используя формулу Менделеева, рассчитайте удельную рабочую теплоту сгорания эталонной смеси, соответствующей бензину с октановым числом 92 (плотность смеси, а также плотности ее компонентов равны 0,69 г/см3). б. Расчет по формуле Менделеева менее точен, чем расчет теплоты реакции по термохимическим уравнениям, однако в промышленности она используется до сих пор. Объясните, почему. 11.6 (Соросовская олимпиада школьников, 1999 г.) Соединение X, образованное элементами № 1 и 7, реагирует с соединением Y, образованным элементами № 7 и 8. 1. Напишите возможные уравнения реакций (не более 5). 2. Какая пара X–Y больше всего подходит для использования в качестве ракетного топлива? Обоснуйте Ваш ответ.
Литература 1. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. В 2-х т. — 2. Зайцев О.С. Общая химия. Состояние веществ и химические реакции. — М.: Химия, 1990. — 352 с. 3. Общая химия // под ред. Е.М. Соколовской, Г.Д. Вовченко, Л.С. Гузея. — М.: Изд-во Моск. ун-та, 1980. — 726 с. 4. Коровин Н.В. Курс общей химии — М.: Высш. шк., 2003.-557 с. 5. Харин А.Н., Катаева Н.А., Харина Л.Т. Курс химии — М.: Высш. шк., 1983. — 511 с. 6. Лучинский Г.П. Курс химии — М.: Высш. шк., 1985. — 416 с. 7. Фролов В.В. Химия — М.: Высш. шк., 1986. — 540 с. 8. Курс химии / Под ред. Г.А.Дмитриева, Г.П. Лучинского, В.И. Семишина. — 2-е изд., испр. — Т. 1. — М.: Высш. шк., 1972. — 309 с. 9. Курс химии / Под ред. И.В. Кротова и К.А.Дулицкой — Т. 2. — М.: Высш. шк., 1971. — 208 с. 10. Глинка Н.Л. Общая химия. — Л.: Химия, 1986. — 703 с. 11. Глинка Н.Л. Задачи и упражнения по общей химии. — Л.: Химия, 1983. — 12. Справочник химика, Т. 1–6. — Л: Химия, 1963–1967 гг. 13. Химическая энциклопедия. Т. 1–5. – М.: Сов. энциклопедия, 1969–1971 гг. 14. Гороновский И.Т., Назаренко Ю.П., Некряч Е.Ф. Краткий справочник по химии — Киев: Наукова думка, 1974. — 992 с. 15. Лурье Ю.Ю. Справочник по аналитической химии — М.: Химия, 1971. — 456 с. 16. Гордон А., Форд Р. Спутник химика. — М.: Мир, 1976. — 544 с. 17. Рябин В.А. Термодинамические свойства веществ: Справочник — 18. Химия: Справочное руководство. // Пер. с нем. — Л: Химия, 1975. — 19. Мини-справочник по общей химии. — Казань: Экоцентр, 1997. — 54 с. 20. Практикум по общей химии // под ред. А.Н. Глебова — Казань: Экоцентр, 2003 — 88 с. 21. Курс лекций по общей химии // под ред. редакцией проф. А.Н. Глебова. – 3-е изд., перераб. и доп. – Казань: «Экоцентр», 2005. — 134 с.
ОГЛАВЛЕНИЕ
Сборник контрольных работ по курсу общей химии: Учебное пособие для студентов всех форм обучения/Под редакцией проф. А.Н. Глебова. – 3-е изд., перераб. и доп. – Казань: «Экоцентр», 2006. – 44 стр.
Издательство «Экоцентр» Лицензия Минпечати РТ № 0307 от 8.06.2000 Без объявл. – 2006 Отпечатано с готового оригинал-макета. Печать RISO. Бумага офсет 1. Формат 60*84 1/16. Объем 2,75 п.л. Тираж 500 экз. Заказ 4. Отпечатано на полиграфическом участке издательства «Экоцентр» г. Казань, ул. Четаева, 18.
СБОРНИК КОНТРОЛЬНЫХ РАБОТ ПО КУРСУ ОБЩЕЙ ХИМИИ
Учебное пособие
D H (реакции)= = S D Hf (продуктов)– S D Hf (реагентов)
Казань – 2006 Печатается по рекомендации УМЦ КГТУ им. А.Н. Туполева
Рецензенты: проф. Будников Г.К. (Казанский государственный университет) проф. Евгеньев М.И. (Казанский государственный технологический университет)
Авторы: А.Н. Глебов, А.Р. Буданов, О.В. Лавриненко,Н.М. Воеводина, И.П. Оранская, И.Г. Григорьева, С.А. Мальцева, А.И. Шамкаева, А.А. Кулаков, Н.В. Кремлева, Э.В. Гоголь, А.Г. Мельникова, А.В. Желовицкая, Р.Р. Гумерова, А.И. Юнусова, Д.В. Фролов, Е.П. Чеклаукова, С.М. Шавалеева, Е.Н. Офицеров Сборник контрольных работ по курсу общей химии: Учебное пособие для студентов всех форм обучения/Под редакцией проф. А.Н. Глебова. – 3-е изд., перераб. и доп. – Казань: «Экоцентр», 2006. – 44 стр.
Учебное пособие предназначено для студентов технического университета, изучающих общую химию по дневной, вечерней и заочной формам обучения. Пособие составлено в соответствии с учебным планом, программой курса общей химии. «Сборник контрольных работ» способствует более полному освоению изучаемого материала и развитию навыков самостоятельной работы студентов. В пособии приведены контрольные задания по основным темам курса общей химии, необходимые расчетные формулы, даны решения типовых задач. Необходимые справочные данные приведены в «Практикуме по общей химии» Часть I, Казань, изд-во «Экоцентр», 2003 г., 88 с.
ã Издательство «Экоцентр», 2006 г. Основные классы неорганических соединений Классификация химических соединений базируется на реагентах и продуктах одной из основных химических реакций — реакции нейтрализации: оксиды (кислотные и основные), кислоты, основания, соли. Взаимосвязь между основными классами неорганических веществ можно упрощенно представить в виде схемы:
Химические свойства основных классов неорганических соединений:
1.1. Назовите следующие вещества и укажите, к какому классу
1.2. Напишите формулы следующих соединений:
1.3. Составьте уравнения реакций получения следующих соединений
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 241; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.244.153 (0.163 с.) |

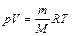 ,
, , где S — энтропия.
, где S — энтропия.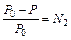 , где P 0 — давление насыщенного пара над чистым растворителем, P — над раствором, N 2 — мольная доля растворенного вещества.
, где P 0 — давление насыщенного пара над чистым растворителем, P — над раствором, N 2 — мольная доля растворенного вещества.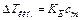 , где KE — эбулиоскопическая константа, с m — моляльная концентрация растворенного вещества;
, где KE — эбулиоскопическая константа, с m — моляльная концентрация растворенного вещества; 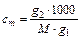 , где g 1 — масса растворителя, g 2 — масса растворенного вещества, M — молярная масса растворенного вещества.
, где g 1 — масса растворителя, g 2 — масса растворенного вещества, M — молярная масса растворенного вещества. , где КК- криоскопическая константа.
, где КК- криоскопическая константа.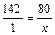 , x = 80:142 = 0,56 (г).
, x = 80:142 = 0,56 (г).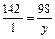 , y = 98:142 = 0,69(г).
, y = 98:142 = 0,69(г).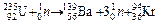 .
.
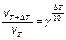 .
. 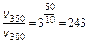 .
.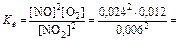 0,192 (моль/л).
0,192 (моль/л). = 29,6%.
= 29,6%.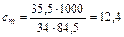 (моль/кг).
(моль/кг).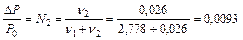 .
.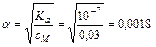 или 0,18%.
или 0,18%. = Fe2+ j°1 = 0,77 В;
= Fe2+ j°1 = 0,77 В; = I2 j°вос = ‑0,54 В.
= I2 j°вос = ‑0,54 В.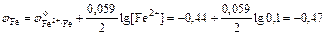 (В);
(В);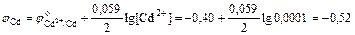 (В).
(В). (г).
(г).


