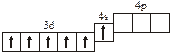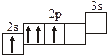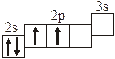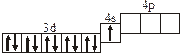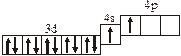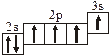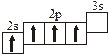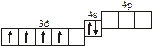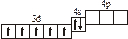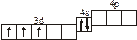Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение атома и химическая связь
Состояние электрона в атоме характеризуется четырьмя квантовыми числами:
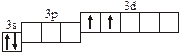
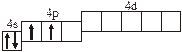
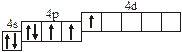
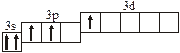
Заполнение электронных оболочек в многоэлектронных атомах происходит в соответствии со следующими закономерностями: Принцип запрета Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Правило Гунда: электроны располагаются по вырожденным орбиталям так, чтобы их суммарный спин был максимален. Правило Клечковского: электроны заполняют подуровни по возрастанию суммы n + l, при равенстве сумм сначала заполняется подуровень с меньшим значением n. Явление радиоактивности — процесс самопроизвольного распада ядер некоторых элементов. При a-распаде испускается a-частица (ядро Теоретическое рассмотрение химической связи возможно в рамках метода валентных связей (ВС) или метода молекулярных орбиталей (МО). Метод ВС позволяет объяснить строение молекул многих химических соединений. Согласно этому методу химическая связь между атомами осуществляется обобществленными парами электронов с антипараллельными спинами на внешних подуровнях. Этот вид связи называется ковалентной связью (полярной и неполярной). Она характеризуется направленностью и насыщаемостью, что означает определенное расположение атомов в пространстве. Ионная связь возникает в результате электростатического взаимодействия противоположно заряженных ионов. Метод МО предполагает, что электроны находятся на молекулярных орбиталях, охватывающих все ядра атомов в молекуле. Для двухатомных молекул элементов второго периода МО обозначаются (в порядке увеличения энергии):
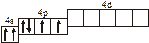
2s s < 2s s * < 2p y = 2p z < 2s x < 2p y * = 2p z * < 2s x *. Для элементов, находящихся в конце периода, начиная с кислорода, порядок следования МО несколько изменяется: ... < 2s x < 2p y = 2p z <... 3.1. Напишите электронные и электронно-ячеечные формулы валентных электронов атомов следующих элементов в основном и возбужденном состояниях, определите высшую и низшую степени окисления, приведите формулы оксидов в высшей степени окисления элемента: 3.1.1. p -элемент VI периода IV группы 3.1.2. p -элемент V периода V группы 3.1.3. p -элемент V периода VII группы 3.1.4. d -элемент IV периода IV группы 3.1.5. p -элемент III периода IV группы 3.1.6. p -элемент III периода VI группы 3.1.7. s -элемент V периода I группы 3.1.8. p -элемент IV периода V группы 3.1.9. p -элемент IV периода V группы 3.1.10. d -элемент IV периода III группы 3.1.11. s -элемент III периода II группы 3.1.12. p -элемент IV периода VII группы 3.1.13. d -элемент VI периода V группы 3.1.14. s -элемент V периода II группы 3.1.15. p -элемент V периода IV группы 3.1.16. d -элемент V периода VI группы 3.1.17. p -элемент III периода VI группы 3.1.18. d -элемент IV периода VI группы 3.1.19. p -элемент III периода V группы 3.1.20. d -элемент V периода IV группы 3.2. Определите, относится ли данная электронно-ячеечная формула к основному, возбужденному или невозможному состоянию атома, назовите химический элемент и укажите его порядковый номер:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
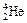 ), заряд ядра уменьшается на 2, массовое число — на 4, образуется элемент, расположенный в Периодической системе на две клетки левее. При b–-распаде испускается электрон, заряд ядра увеличивается на 1, массовое число не изменяется, образуется элемент, расположенный в Периодической системе на одну клетку правее. При b+-распаде или К -захвате испускается позитрон или захватывается электрон с ближайшей к ядру оболочки соответственно, заряд ядра уменьшается на 1, массовое число не изменяется, образуется элемент, расположенный в Периодической системе на одну клетку левее.
), заряд ядра уменьшается на 2, массовое число — на 4, образуется элемент, расположенный в Периодической системе на две клетки левее. При b–-распаде испускается электрон, заряд ядра увеличивается на 1, массовое число не изменяется, образуется элемент, расположенный в Периодической системе на одну клетку правее. При b+-распаде или К -захвате испускается позитрон или захватывается электрон с ближайшей к ядру оболочки соответственно, заряд ядра уменьшается на 1, массовое число не изменяется, образуется элемент, расположенный в Периодической системе на одну клетку левее.