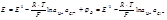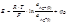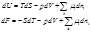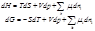Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизм возникновения электродного потенциала. Равновесный потенциал. Контактная разность потенциалов. Диффузионный потенциал.
1.Механизм возникновения электродного потенциала. При погружении металлической пластинки в раствор собственной соли имеют место два основных процесса. Первый процесс-это ионизация металла пластинки, где в узлах кристаллической решетки находятся ионы – атомы: Ме ⇄ Меn+ + ne- Ионизация происходит под действием полярных молекул растворителя (воды). Образующиеся при этом электроны концентрируются на пластинке, заряжая ее отрицательно, а образующиеся катионы металла переходят с пластинки в раствор и концентрируются возле пластинки (рис.). Второй процесс – это взаимодействие молекул растворителя с ионами металла, т.е. сольватация образующихся ионов: Меn+ + mH2O⇄ Меn+ mH2O 2. В результате контакта двух металлов образуется контактная разность потенциалов. Контактная разность потенциалов не зависит от того, соприкасаются ли рассматриваемые металлы непосредственно или через посредство одного или нескольких промежуточных проводников. Контактную разность потенциалов необходимо учитывать при расчете ЭДС гальванического элемента 3. На границе между растворами двух одинаковых электролитов разной концентрации возникает диффузионный потенциал. Диффузионный потенциал возникает из-за различия в подвижности анионов и катионов при их совместной диффузии из более концентрированного раствора в менее концентрированный. Для устранения вклада диффузионного потенциала в измеряемую ЭДС его устраняют с помощью солевого мостика, в качестве которого используют насыщенный солево й раствор, например KCl. …………………………………………………………………………. (продолжение 7) 3. Химические цепи c переносом В этих цепях два различных электрода погружены в различные растворы, а контакт между растворами осуществляется через какую-либо пористую мембрану или с помощью электролитического ключа. Пример: водород-хлорсеребряный элемент, в котором полуэлементы расположены в разных растворах – Pt,H2|HCl||AgCl,KCl|Ag. Его ЭДС равна: В этом случае произведение активностей ионов нельзя заменить средней ионной активностью электролита, поскольку катионы и анионы образуются при диссоциации разных электролитов. 4. Концентрационные цепи с переносом В таких цепях два одинаковых электрода находятся в растворах с одними и теми же потенциалопределяющи-ми ионами, но с разной активностью (концентрацией).
Примером может служить цепь с двумя серебряными электродами в растворах нитрата серебра разной концентрации: Ag | AgNO3 (aI) || AgNO3 (aII) | Ag. Его ЭДС равна (aI<aII): Cуммарный процесс формально можно представить как перенос ионов серебра из более концентрированного раствора (II) в менее концентрированный (I). Типы электродов Электроды первого рода *Катионные электроды (потенциал зависит от активности катионов) – устанавливается равновесие между электронейтральными частицами (например, атомами металла) и соответствующими катионами в растворе. Различают металлические (цинковый, медный, серебряный и т.д.), амальгамные (амальгамы щелочных и щелочноземельных металлов) электроды, газовый водородный электрод. *Анионные электроды (потенциал зависит от активности анионов) – устанавливается равновесие между электронейтральными частицами и анионами – хлорный, бромный, иодный. Если анионный электрод является газовым, то в уравнение для электродного потенциала включается также давление газа. Например, потенциал хлорного электрода Рt,Cl2|Cl– равен: Электроды второго рода Состоят из трех фаз – металла, его труднорастворимой соли и раствора, содержащего анионы этой соли. На этих электродах устанавливается равновесие между атомами металла и анионами в растворе как результат двух частных равновесий: между металлом и катионом труднорастворимой соли и между анионом в твердой фазе этой соли и анионом в растворе (Аz–|MA|M). Окислительно-восстановительные электроды. Состоят из индифферентного проводника (обычно платина или углерод, иногда золото, палладий), погруженного в раствор, который содержит окисленную и восстановленную формы одного и того же вещества (Fe3+–Fe2+, Sn4+–Sn2+, MnO2–Mn2+, H3AsO4–H3AsO3 и т.п.) Металл электрода служит лишь посредником в обмене электронами между двумя формами. Мембранные (ион-селективные) электроды. Обе граничащие фазы – мембрана и раствор – имеют ионную проводимость и поэтому на их границе не протекает собственно электрохимическая реакция с переносом электронов.
Процесс сводится в этом случае к обмену ионами При соответствующем подборе состава и структуры мембраны потенциал на межфазной границе будет зависеть только от какого-либо одного вида ионов. Это дает возможность измерять активность отдельного вида ионов (селективность по какому-то иону).
| 3.Влияние различных факторов на равновесие химической реакции.
1. Потенциалы взаимодействия для термодинамической системы можно считать равными соответствующим величинам для окружающей среды. Равновесный процесс протекает при бесконечно малой разности потенциалов взаимодействия.
2. Система в любой момент процесса может считаться находящейся в равновесном состоянии.
3. Количество энергии, отданное окружающей средой системе в определенной форме, всегда равно количеству энергии, воспринятому системой в той же форме обмена энергией
4. Равновесный процесс протекает бесконечно медленно
При химическом равновесии скорость реакции в прямом направлении равна скорости реакции в обратном направлении. В условиях химического равновесия концентрация исходных веществ и продуктов реакции не изменяется во времени и называются равновесными концентрациями. Для характеристики состава химического равновесия было введено понятие константа химического равновесия. Эта величина определяется из закона действующих масс и представляет собой отношение концентраций продуктов реакций и исходных веществ.
Влияние различных факторов на сдвиг химического равновесия:
1)Влияние температуры.
С повышением температуры равновесие смещается в сторону эндотермических реакций, т.е. реакций протекание которых обеспечивает поглощение теплоты. Повышение температуры вызывает увеличение константы равновесия, соответственно возрастают отношения концентраций продуктов реакции к концентрации исходных веществ, т.е. равновесие смещается в сторону эндотермической реакции.
2)Влияние общего давления в системе
Если в результате реакции изменяется число молей газообразного вещества, то изменение общего давления в системе вызывает смещение равновесия в соответствии с принципом Ле-Шателье, увеличение общего давления в системе вызывает смещение равновесия в сторону уменьшения числа молей газообразного вещества, т.е. в сторону уменьшения давления.
3)Влияние концентрации компонентов системы.
Если в систему добавить Метан, т.е. увеличить концентрацию, то равновесие системы нарушится. При этом ускоряется прямая реакция, что приводит к увеличению концентрации продуктов реакции. В результате происходит уменьшение концентрации газообразной воды и равновесие смещается вправо. Процесс будет протекать до тех пор, пока не установится новое равновесие. Новое равновесие концентрации всех компонентов будет таким, чтобы константа равновесия оставалась постоянной.
Δ H >0 (эндотермическая реакция, поглощение тепла): увеличение температуры (уменьшение 1/T) приводит к увеличению константы равновесия, равновесие смещается в сторону продуктов реакции
ΔH<0 (экзотермическая реакция, выделение тепла): увеличение температуры (уменьшение 1/T) приводит к уменьшению константы равновесия, равновесие смещается в сторону исходных веществ
Принцип Ле-Шателье-Брауна: если на систему, находящуюся в состоянии равновесия оказать какое-либо воздействие, то равновесие в системе сместится в том направлении, что оказанное воздействие уменьшится
6. Термохимия. Закон Гесса и следствия из него. Теплота образования и тепловой эффект химической реакции. Зависимость теплового эффекта химической реакции от температуры
1.Термохимия – раздел химической термодинамики, посвященный исследованиям тепловых эффектов химических реакций, теплот фазовых переходов, теплот растворения веществ и т.д.
Под тепловым эффектом химической реакции понимают количество теплоты, которое выделяется или поглощается при условиях: а) процесс протекает необратимо при постоянном объеме или давлении; б) в системе не совершается никаких работ, кроме работы расширения системы; в) продукты реакции имеют ту же температуру, что и исходные вещества.
Экзотермические реакции – выделение тепла
Эндотермические реакции – поглощение тепла
2.Закон Гесса
Тепловой эффект химической реакции не зависит от пути протекания процесса (промежуточных стадий), а определяется лишь начальным и конечным состояниями системы (т.е. состоянием исходных веществ и продуктов реакции)
Закон Гесса выполняется при условии протекания реакции при постоянном давлении или при постоянном объеме (что реально соблюдается в подавляющем большинстве случаев)
Связь изобарного и изохорного тепловых эффектов:
Qp – QV = ΔUp + р∙ΔV – ΔUV.≈ р∙ΔV
Разностью изобарного и изохорного тепловых эффектов можно пренебречь, если в реакции участвуют вещества только в твердом и жидком состоянии.
Следствия из закона Гесса
1. Тепловой эффект разложения химического соединения до определенных продуктов равен по величине и противоположен по знаку тепловому эффекту образования этого соединения из тех же продуктов
2. Разность между тепловыми эффектами превращения двух различных химических систем в одинаковые продукты реакции равна тепловому эффекту перехода одной системы в другую.
3. Разность между тепловыми эффектами превращения двух одинаковых химических систем в различные продукты реакции равна тепловому эффекту, соответствующему превращению одних продуктов реакции в другие
ВЫВОД: Термохимические уравнения можно складывать и вычитать подобно алгебраическим
3.Теплота образования
Под теплотой образования (энтальпией образования) понимают то количество теплоты, которое выделяется или поглощается при образовании одного моля вещества (атома, молекулы) из простых веществ, взятых в термодинамически устойчивом состоянии при рассматриваемых условиях – обычно 298 К и 1 атм.
Энтальпию (теплоту) образования простых веществ при стандартном давлении и 298 К и в термодинамически устойчивом состоянии (Н2, Сl2, Sромб, Сграфит) принимают равной нулю.
 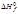 Энтальпии образования при стандартных условиях и 298 К табулированы в справочниках, их принято обозначать или
Теплота образования и тепловой эффект химической реакции Энтальпии образования при стандартных условиях и 298 К табулированы в справочниках, их принято обозначать или
Теплота образования и тепловой эффект химической реакции
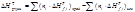 Энтальпия (тепловой эффект) химической реакции равняется разности между суммами энтальпий (теплот) образования продуктов реакции и энтальпий (теплот) образования исходных веществ в соответствии с их стехиометрическими коэффициентами: Энтальпия (тепловой эффект) химической реакции равняется разности между суммами энтальпий (теплот) образования продуктов реакции и энтальпий (теплот) образования исходных веществ в соответствии с их стехиометрическими коэффициентами:
 Для стандартного давления и 298 К справедливо:
4.Зависимость теплового эффекта химической реакции от температуры
Для реакции:
n1A + n2B = n3C + n4D Для стандартного давления и 298 К справедливо:
4.Зависимость теплового эффекта химической реакции от температуры
Для реакции:
n1A + n2B = n3C + n4D
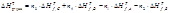 Если реакция протекает при постоянном давлении, то изменение энтальпии равно теплоте Qp.
Если реакция протекает при постоянном давлении, то изменение энтальпии равно теплоте Qp.
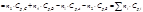  Дифференцируя, получим:
9. Принципы статистической термодинамики. Статистический смысл энтропии. Сумма по состояниям, ее связь с энтропией и внутренней энергией.
Принципы статистической т/д.
Статистический смысл энтропии.
При описании систем можно использовать 2 подхода: микро- и макросскопический. подробно хар-ся микросостояние системы. Для макросостояний исп-ует небольшое число переменных (Т,V, n). Каждому макросостоянию соотв-ет несколько микросостояний.
Т/д вероятность – это число микросостояний, с помощью которых можно осуществить данное макросостояние. Дифференцируя, получим:
9. Принципы статистической термодинамики. Статистический смысл энтропии. Сумма по состояниям, ее связь с энтропией и внутренней энергией.
Принципы статистической т/д.
Статистический смысл энтропии.
При описании систем можно использовать 2 подхода: микро- и макросскопический. подробно хар-ся микросостояние системы. Для макросостояний исп-ует небольшое число переменных (Т,V, n). Каждому макросостоянию соотв-ет несколько микросостояний.
Т/д вероятность – это число микросостояний, с помощью которых можно осуществить данное макросостояние.
 По закону распределения Больцмана число молекул N i, обладающих энергией ε i :
где А – константа.
Общее число молекул равно: По закону распределения Больцмана число молекул N i, обладающих энергией ε i :
где А – константа.
Общее число молекул равно:
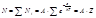 где Z – статистическая сумма по состояниям.
где Z – статистическая сумма по состояниям.
 Сумма по состояниям мультипликативна, т.е. общая сумма по состояниям является произведение сумм по состояниям, соответствующих отдельным независимым видам движения:
Энтропия системы связана с т/д вероятностью: S= f(W).
По принципу Больцмана: Энтропия системы в данном состоянии пропорц т/д веятности этого состояния.
S =k∙lnW где k – постоянная Больцмана (k = R / NA =1.38∙10-23 Дж/К)
1 2. Химический потенциал. Химический потенциал идеальных газов.
1. Химический потенциал. Физический смысл: Химический потенциал компонента характеризует изменение экстенсивной характеристической функции при добавлении 1 моль этого компонента к бесконечно большому количеству этого компонента при постоянных условиях Сумма по состояниям мультипликативна, т.е. общая сумма по состояниям является произведение сумм по состояниям, соответствующих отдельным независимым видам движения:
Энтропия системы связана с т/д вероятностью: S= f(W).
По принципу Больцмана: Энтропия системы в данном состоянии пропорц т/д веятности этого состояния.
S =k∙lnW где k – постоянная Больцмана (k = R / NA =1.38∙10-23 Дж/К)
1 2. Химический потенциал. Химический потенциал идеальных газов.
1. Химический потенциал. Физический смысл: Химический потенциал компонента характеризует изменение экстенсивной характеристической функции при добавлении 1 моль этого компонента к бесконечно большому количеству этого компонента при постоянных условиях
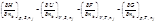 Дж. Гиббс (1876) предложил называть общуюю производную химическим потенциалом компонента μ k:
Дж. Гиббс (1876) предложил называть общуюю производную химическим потенциалом компонента μ k:
 Записанные с учетом химического потенциалы основные уравнения термодинамики имеют вид:
Записанные с учетом химического потенциалы основные уравнения термодинамики имеют вид:
Для большинства термодинамических расчетов используют энергию Гиббса, так как она определена через наиболее удобные независимые параметры (давление, температура, состав) и при p, T = const может быть выражена как dGT , p = ∑ μ i dni
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 225; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.121.131 (0.013 с.) |