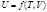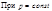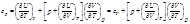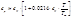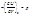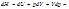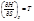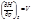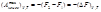Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Связь между средней и истинной теплоемкостью
Средняя теплоемкость приближается к истинной при уменьшении температурного интервала, когда (Т2 – Т1) → 0.
Формула Майера Для идеальных газов (формула Майера): Для реальных газов: Для твердого тела при обычной температуре разность cp - cV < R и составляет около 1 Дж/(моль∙К). Величина Для твердых тел справедливо эмпирическое уравнение: где Tm – температура плавления Расчет теплоемкости Для идеальных газов теплоемкость определяется только поступательным движением их молекул. Из молекулярно-кинетической теории вытекает, что мольная теплоемкость одноатомного газа равна В действительности наблюдаются значительные отклонения от теоретических значений. Расчеты по формулам этих теорий дают правильные результаты лишь для некоторых веществ в ограниченном температурном интервале. Поэтому для расчетов теплоемкостей и тепловых эффектов при разных температурах используют экспериментальные величины теплоемкостей: c р = a +b∙T +c∙T 2 c р = a +b∙T +c*∙T -2+d∙T 2 В справочных таблицах приводятся значения коэффициентов (a, b, c, c*, d) и интервал температур, Характеристические функции: внутренняя энергия, энтропия, энергия Гиббса, энергия Гельмгольца. Характеристическими наз-ся функции, через кот, а также через их производные, наиболее просто и в явном виде могут быть выражены все т/д свойства системы. Практически любые функции состояния и переменные можно выразить через саму хар функцию или через ее частные производные по естественным для функции переменным.
1. S=const, V=const
При δ A немех =0
Темп-ра – мера возрастания внут энергии системы с увелич энтропии при пост V, а давление – мера убыли внут энергии с увеличением V при постоянной энтропии.
Внутренняя энергия – хар функция, если в качестве независимых переменных принять S и V 2. S=const, p=const При δ A немех =0:
Энтальпия – характеристическая функция, если в качестве независимых переменных принять S и p. 3. T=const, V=const
Функция F = U - T ∙ S называется энергией Гельмгольца. В качестве независимых переменных выбраны V и T 4. T=const, p=const
Функция G = U - T ∙ S + p ∙ V называется энергией Гиббса.
|
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 122; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.135.224 (0.005 с.) |
|||||||||||||||||||||||||||||||||||||||

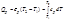 При постоянном давлении справедливо:
При постоянном давлении справедливо:
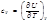 4.Связь между с p и cv
4.Связь между с p и cv