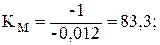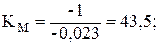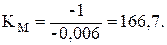Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Органических кислот на липазу зародышей пшеницы
При исследовании воздействия смесей органических кислот А-D на липазу ЗП в реакционную среду, содержащую раствор фермента, 50 мМтрис/НСl буфер (рН 8,0), вносили поочередно смеси А-D до конечных концентраций 8, 20, 30 мМ/дм3. После внесения смесей органических кислот контролировали рН. Далее вносили субстрат – эмульсию триацилглицерида рафинированного подсолнечного масла. Активность липазы определяли при изменении концентрации масла в пределах 20-100 мМ/дм3, принимая молекулярную массу подсолнечного масла 913 Да. Реакционные среды инкубировали при постоянном перемешивании 30 мин при температуре 37 оС и определяли остаточную активность липазы [15, 251]. На рисунке 3.4 представлены результаты экспериментальных исследований зависимости скорости ферментативной реакции липазы от содержания субстрата в реакционных средах, включающих разное количество смесей А-D. Из рисунков следует, что композиции органических кислот снижают скорость реакции симбатно.
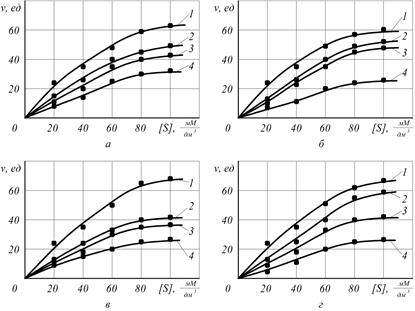
Для выявления типа ингибирования, согласно методу Лайнуивера – Берка, были проанализированы функции 1/v и 1/[S], полученные по данным рисунка 3.4. (рисунок 3.5) [78, 88, 348]. На рисунках 3.5 (а-г) видно, что все графики могут иметь общую точку на оси абсцисс при интерполяции экспериментальных зависимостей в области отрицательных значений, а наклон графиков к оси абсцисс возрастает с увеличением концентрации смесей органических кислот, что свидетельствует о неконкурентном типе ингибирования.
Неконкурентный ингибитор подавляет каталитическое превращение субстрата в продукты реакции. При неконкурентном торможении ингибитор связывается с ферментом на участке, отличающемся от центра связывания субстрата; при этом он деформирует этот центр, подавляя его каталитическую функцию. Ингибитор связывается либо с ферментом, либо с комплексом фермент-субстрат. Другими словами, когда в реакционной среде находятся и субстрат и ингибитор, они присоединяются к ферменту одновременно, не конкурируют за один и тот же центр связывания.
Кинетическую характеристику процесса ингибирования оценивали по известному уравнению 3.2
где v – скорость ферментативной реакции; Ki – константа равновесия системы фермент-ингибитор; [ S ] – концентрация субстрата; V – максимальная скорость ферментативной реакции; [I] – концентрация ингибитора; Kм – константа Михаэлиса, характеризующая химическое сродство фермента к субстрату. Константа равновесия системы фермент-ингибитор Kiвычисляется по формуле
В присутствии ингибитора константа Михаэлиса КM не изменяется, а уменьшается в (1 + [I]/Ki) раз. КM является характеристикой эффективности подавления активности фермента ингибитором: чем больше КM, тем выше эффективность ингибирования. В присутствии смеси А эта константа составляет
В присутствии смесей В, С, D константы Михаэлиса имеют следующие значения, соответственно
Экспериментально доказано, что наибольшее ингибирующее действие на липазу ЗП оказывали композиционные смеси органических кислот В, D, наименьшее - смеси А, С [15, 251].
|
|||||||||
|
Последнее изменение этой страницы: 2020-12-19; просмотров: 80; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.239.46 (0.004 с.) |

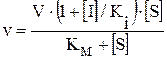 , (3.2)
, (3.2) , (3.3)
, (3.3)