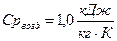Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Калорические параметры состояния.
t - внутренняя энергия U, Дж t удельная u, t - энтальпия Н, Дж t удельная R, t - энтропия S, t удельная s, Понятие внутренней энергии связано с рассмотрением закрытой адиабатной системы. Закрытая система – нет обмена веществом с внешней средой. Адиабатная система – нет обмена энергией в форме теплоты, допускается обмен энергии в форме работы. U2 – U1 = lад 1) газ (неадиабатная)
2) электрическое сопротивление + газ (адиабатная)
Внутренняя энергия является полной энергией для закрытой системы и представляет собой сумму потенциальной энергии сил сцепления и отталкивания и кинетической энергии поступательного, колебательного, вращательного движений частиц. Понятие внутренней энергии позволило аналитически выразить I закон термодинамики. Внутренняя энергия – это функция состояния.
Для идеального газа
Обладает свойством аддитивности:
Энтальпия есть полная энергия для открытой системы, аналогично, как внутренняя энергия для закрытой системы.
Свойство аддитивности:
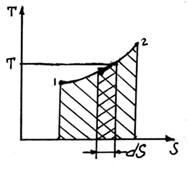
Энтропия.
Теплота и работа не являются функциями состояния, есть характеристики процесса, а потому не могут быть дифференцируемыми.
Энтропия есть мера необратимости процесса, это понятие позволило выразить аналитически II закон термодинамики. Свойства:
подвод q – S увеличивается, отвод q – S уменьшается. Энтропия и термодинамическая вероятность состояния системы. Система, выведенная из состояния равновесия, стремится к равновесию, по достижению которого энтропия максимальна.
Уравнение Больцмана:
процесс расширения
процесс сопровождается подводом теплоты
P = const – процесс изобарный
V = const – изохорный процесс
Теплоемкость вещества. Это физический параметр, характеризующий способность вещества воспринимать или отдавать энергию в форме теплоты.
Зависит от: 1) природы вещества, 2) его количества, параметров состояния, 3) условий проведения процесса подвода или отвода теплоты.
1)
2) Ar, Xe, Ne, Kr, He –теплоемкость от температуры не зависит ~ 300 К неизменна для O2, N2, H2 для остальных с увеличением Т, С увеличивается 3) Р = const – подвод и отвод теплоты, V = const
|
|||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 115; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.160.14 (0.008 с.) |





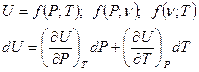
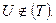
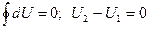 или U2 = U1 – к понятию полного дифференциала.
или U2 = U1 – к понятию полного дифференциала.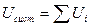
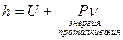
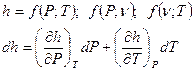

 - для идеального газа
- для идеального газа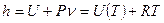

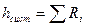
 , d –оператор дифференциала
, d –оператор дифференциала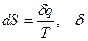 - знак элементарного количества при бесконечно малом изменении параметров.
- знак элементарного количества при бесконечно малом изменении параметров.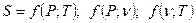
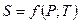 - для идеального газа
- для идеального газа


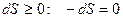 - для обратимых процессов
- для обратимых процессов - для необратимых процессов
- для необратимых процессов ,
,  - постоянная Больцмана
- постоянная Больцмана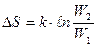






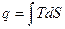

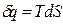
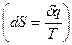




 ~
~ 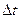
 ~
~