Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Т.С. Кухарева, В.Ю. Мишина, Т.В. ВанюгинаСтр 1 из 16Следующая ⇒
Т.С. Кухарева, В.Ю. Мишина, Т.В. Ванюгина З А Д А Ч Н И К По органической химии Часть 1 Москва 200 9 Успехи в изучении органической химии достигаются в полной мере лишь при сочетании освоения теоретического материала с комплексом упражнений и решением задач. С учетом сказанного, на кафедре органической химии химического факультета МПГУ подготовлено и апробировано учебное пособие для студентов, включающее в себя набор упражнений и задач, соответствующий стандарту и программе курса. Книга охватывает материал, посвященный изучению алифатических систем[1]. Задания, представленные в пособии, разнообразны, и они требуют от студентов как знания теоретических положений курса, так и творческой инициативы и сообразительности в подходе к решению аналитических и синтетических задач. Проверочный материал распределен по главам, которые в сумме охватывают основные разделы органической химии, изучаемые в первом семестре. Каждая глава предваряется кратким анализом химического строения и возможных химических превращений представляемого класса органических соединений. В первой главе задачника приведены задания, целью которых является совершенствование знаний об электронном строении органических соединений и реакционной способности частиц, образующихся в реакциях органических веществ. Во второй главе собраны задачи по химии насыщенных соединений, молекулы которых содержат только s-связи: алканов, галогеналканов, алканолов и аминов. Третья глава посвящена химии непредельных соединений - алкенов, алкадиенов и алкинов, в молекулах которых присутствует неполярная p-связь. В четвертой главе рассмотрены свойства более сложных органических соединений - альдегидов, кетонов, карбоновых кислот и их производных. Задачник содержит ответы на некоторые задачи, которые обозначены в тексте значком (*). Для удобства в задачник включен справочный материал. Справочные таблицы расположены в конце книги. ГЛАВА 1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ Электронное строение органических соединений и реакционных частиц Задачи 1. Приведите электронные конфигурации атомов элементов второго периода. Определите значение высшей валентности каждого элемента.
2. Дайте определения следующим понятиям: атом, катион, анион, радикал. Приведите примеры.
3. Укажите внешние электроны в следующих частицах: а) H, H +, H -; б) Br, Br +, Br -; в) CH 3, CH 3 +, CH 3 -; г) OH, OH +, OH - Назовите эти частицы.
4. Охарактеризуйте типы химических связей в приведенных соединениях (ковалентная неполярная, ковалентная полярная, ионная): F2, CH4, NaI, HCl, H2O, NaNH2 KF, CH3CN.
Образец выполнения задания: 5. Охарактеризуйте типы химических связей (обычная ковалентная, координационная, семиполярная) в приведенных соединениях: H3C – Br, HNO3, CO, NH4Cl, H3C – CH3, C2H5ONa, NH3. Образец выполнения задания:
6. Представьте следующие молекулы в виде структур Льюиса, укажите типы химических связей:
Образец выполнения задания:
7. Представьте следующие молекулы в виде структур Льюиса и поставьте, где необходимо, формальные заряды на атомах, укажите типы химической связи:
Образец выполнения задания:
8. Дополните указанные формулы соединений неподеленными электронными парами (НЭП), выберите заряженные частицы, проставьте заряды: BH3; CH3; H3O; NH3; NH4; CH4; NH2; H2O, CH3NH2, CH3OH, CH3OCH3, CH3SCH3, CH3C(O)OC(O)CH3, [CH3OH2]Cl.
9. Какие из приведенных пар соединений являются изоэлектронными: а) CH 3 + и BH 3; б) NH 3 и H 3 O +; в) CH 4 и H 2 O
10. Выберите соединения, в молекулах или ионах которых валентность центрального атома равна четырем: CH 4; NH 4 +; H 2 O; CH 3 +
11. Выберите соединения, в молекулах или ионах которых валентность центрального атома равна трем: CH 4; NH 3; H 3 O +; CH 3 +; CH 3 -; BF 3; NH 4 +
12. Выберите соединения, в молекулах или ионах которых координационное число центрального атома равно трем: CH 4; NH 3; H 3 O +; CH 3 +; CH 3 -; BF 3; NH 4 +
13. Представьте следующие молекулы в виде структур Льюиса и объясните, почему они изоэлектронны: N 2, CO, CN -.
14. Докажите, что приведенные структуры изоэлектронны: а) CO 3 2- и NO 3 -; б) CO 2 и NO 2 +; в) CO и N 2.
15. В приведенных рядах соединений выберите изоэлектронные структуры, напишите для них формулы Льюиса: 1) NO+, NO, CO2, CN- 2) N2, NO+, CO, CN-, NO, NH2- 3) CH4, NH4+, BH4-
4) CO2, HNO2, NO2+, N2, CN
16. Какие из перечисленных структур являются ионами:
17. Для приведенных молекул укажите тип гибридизации каждого атома:
Образец выполнения задания:
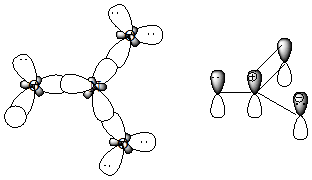
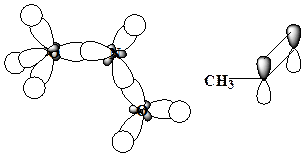
18. Для приведенных молекул и частиц укажите тип гибридизации каждого атома, используя правило октета, проставьте все неподеленные электронные пары и укажите орбитали, на которых они находятся:
Приведите схемы s- и p-связей. Образец выполнения задания:
19. Определите длину одинарных (σ-) связей в приведенных соединениях с учетом ковалентных радиусов атома углерода (RСsp3 = 0.767 Ǻ, RCsp2 = 0.742 Ǻ, RCsp = 0.668 Ǻ):
20. Из каждой пары веществ выберите такие, в молекулах которых выделенная связь имеет большую длину: а) CH 3 - CH 3 или CH 2 = CH 2; б) > C = O или CH 3 – OH; в) HC º CH или CH 3 - Cl.
21. Приведите схемы σ- и π- связей для молекул следующих соединений, укажите орбитальные углы:
Образец выполнения задания: Схема s – и π-связей для молекулы азотной кислоты: Схема σ- и p -связей для молекулы пропена: 109 ° 28 ¢ и 120 °
22. Какая из связей в каждой паре более полярна, какая более поляризуема: а) C – C и C º C; б) C – Cl и С - I; в) C - N и C º N; г) C - O и C = O; д) C - S и C - O; е) C - O и C - F; ж) C - F и C - Br; з) C = N и C º N; и) C = C и C º C
23. Сопоставьте полярность и поляризуемость выделенных связей в следующих парах соединений:
(Указание: воспользуйтесь данными табл.10 в Приложении).
24. Определите ковалентность и координационное число для выделенных атомов в следующих соединениях:
25. Рассчитайте формальные заряды на выделенных атомах: а)[ CH 3 – OH 2 ] Br; б) [ NH 4 ] Cl; в) [ CH 3 – C º C:] K;
26. Рассчитайте формальные заряды в следующих фрагментах молекул:
27. Приведите конкретные примеры для каждого случая образования ковалентной связи по донорно-акцепторной схеме: A: + B+ → A+ - B A:- + B+ → A - B A:- + B → A – B- A:- + B + → A – B
28. Какие способы обобщения электронной пары реализуются при образовании приведенных соединений:
29. В каком случае донорно-акцепторное взаимодействие приводит к образованию семиполярной связи? В чем ее отличие от ионной и ковалентной? В каких из приведенных соединений имеются семиполярные связи?
Задачи 1. Укажите виды индукционного эффекта (+I, -I) в молекулах следующих соединений, проставьте возникающие при этом дробные заряды: H 3 CCl, (H 3 C)3 CCl, H 3 C 4 Li, CH 3 CH 2 CH 2 NH 2, CH 3 CHICH 3. Образец выполнения задания:
(См. табл.4 в Приложении).
2. Расположите приведенные соединения в порядке убывания величины δ+ на указанном атоме углерода: H3 C – Cl, H3 C – CH2 – Cl, H3 C – F, H3 C – OH, H3 C – CH2 – CH2 – Cl, H3 C – NH2.
3. Сравните кислотные свойства карбоновых кислот, учитывая действие индукционного эффекта групп, входящих в состав кислот: а) CH2Cl – COOH; CH2I – COOH; CH2(OH) – COOH; CH3 – COOH б) CH3 – COOH; H – COOH; CH3 – CH2 – COOH; CH3 – CH(CH3) – COOH в) CH2F – COOH; CH2F – CH2 –COOH; CH3 – CHF – COOH; CH 2 (F) – CH 2 – CH 2 – COOH
4. Укажите, в каких случаях реализуется образование единой сопряженной системы и мезомерной стабилизации:
Образец выполнения задания: Бутадиен-1,3, аллильный радикал, винилфторид
5. Сопоставьте силу мезомерного эффекта со стороны указанных частиц: а) -NH2; -OH; б) -OH; -OR; O-
6. Сопоставьте силу мезомерного эффекта со стороны указанных частиц:
7. Какие виды электронных эффектов наблюдаются в данных соединениях:
а) – I; б) + I; в) + M; г) - M; д) s-p-сопряжение; е) p-p-сопряжение.
8. В каких из приведенных структур реализуется мезомерный эффект? Укажите вид сопряжения. CH 3 – CH 2 – OH, CH 3 – COOH, CH 3 – CH = CH 2. С H 3 – CH 2 +, (CH 3)3 C +
9. В каких из приведенных соединений реализуется эффект p-p-сопряжения: CH2 = CH – CH2 – CH2 – CH = CH2; CH2 =CH - COOH; CH2 = CH – Cl; CH2 = CH – CH = CH2; CH3 –O – CH2 – C º C - C º CH; CH2 = CH – C º C - C º CH; CH2 = CH – CH = CH – CH3
10. В каких из приведенных соединений реализуется эффект s-p-сопряжения: CH3 – COOH; CH2 = CH – CH = CH2; CH3 – CH = CH2 Cl – CH = CH2; CH3 – CH2 - CH = CH2; H – COOH; CH3 – NO2
11. В каких из приведенных соединений реализуется эффект p-p-сопряжения:
Образец выполнения задания:
12. Каков вид электронного эффекта в молекуле, если он передается по цепи p-связей и на заместителе, вызывающем этот эффект, образуется частичный положительный заряд:: а) – I; б) + I; в) + M; г) - M
13. Приведите граничные структуры и мезоформулы с изогнутыми стрелками и выравненными связями для указанных соединений:
Образец выполнения задания: в)
14. Объясните, почему а) частичный положительный заряд на выделенном атоме углерода в молекуле ацетальдегида СН3 С НО больше, чем в молекуле этанола СН3 С Н2ОН; б) невозможно существование винилового спирта СН2=СН-ОН; в) нитрометан CH3NO2 может существовать в виде кислоты. Образец выполнения задания: в)
15. В приведенных соединениях определите виды мезомерных эффектов (π-π-, р-π- и σ-π- сопряжение). Приведите мезоформулы соединений:
Образец выполнения задания:
16. Приведите для указанных соединений граничные структуры, мезоформулы и вид единой π-молекулярной орбитали (укажите, сколько центров и электронов участвуют в ее образовании):
Образец выполнения задания:
17.Приведите граничные структуры, мезоформулы и вид единой π-молекулярной орбитали для одной из граничных структур на выбор для следующих соединений (укажите, сколько центров и электронов участвуют в ее образовании):
18. Приведите граничные структуры, мезоформулы и вид единой π-молекулярной орбитали для одной из граничных структур на выбор для следующих частиц (укажите, сколько центров и электронов участвуют в ее образовании):
19. Определите, в каком из приведенных соединений имеется больший частичный положительный заряд на атоме углерода связи С-I:
CH3 – CH = CH – I CH3 – CH2 – CH2 – I Дайте объяснения.
20. Дайте объяснение уменьшению стабильности катионов: а) б)
Задачи 1. Приведите кривую изменения потенциальной энергии системы в зависимости от устойчивости конформаций (конформационный анализ) с использованием формул Ньюмена для а) этана СН3 – СН3 относительно связи С – С; б) этилхлорида H3C – CH2 – Cl относительно связи С – С; в) н-пентана H3C1 – 2CH2 – 3CH2 – 4CH2 – 5 CH3 относительно связи С3 – С4. г) бутана С2-С3.
д) 2-хлорпентана относительно связи С2-С3. е) 2,3-дибромбутана относительно связи С2-С3 Образец выполнения задания: а) рассматриваем две конформации: заторможенную
2. Какая особенность строения органических молекул является причиной оптической изомерии: а) асимметрический атом углерода; б) ось симметрии?
3. Выберите характеристику рацемата: а) индивидуальное вещество; б) смесь изомеров; в) эквимолекулярная смесь антиподов; г) оптически активен; д) оптически неактивен.
4. Какими свойствами отличаются антиподы: а) физическими; б) физико-химическими; в) величиной угла вращения плоскополяризованного света; г) знаком вращения плоскополяризованного света?
5. Выберите характеристику мезоформы: а) отсутствие асимметрических центров; б) отсутствие оптической активности; в) наличие оси симметрии.
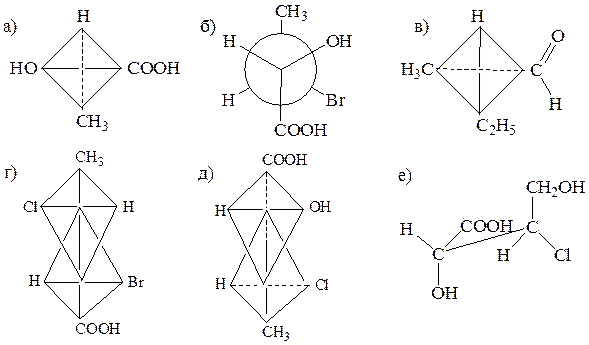
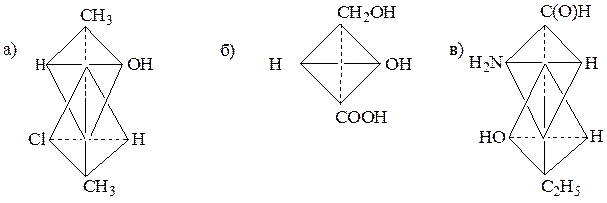
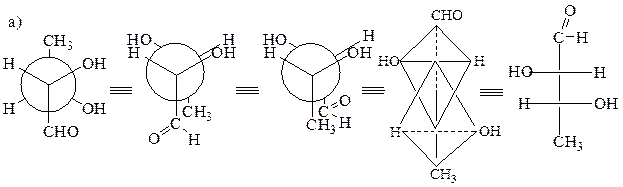
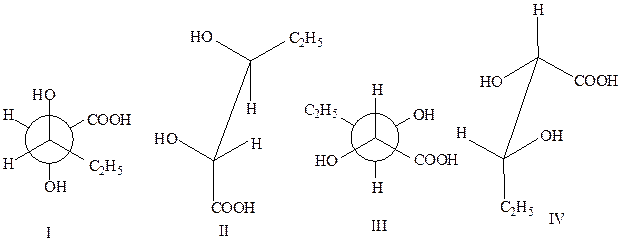
6. Приведите проекционные формулы Фишера для указанных соединений. Определите абсолютную конфигурацию хирального центра. Чем являются соединения I, II, III по отношению друг к другу?
Образец выполнения задания:
7. Сколько оптических изомеров существует для нижеприведенных соединений? Укажите число рацематов, мезоформ, диастереомеров.
Образец выполнения задания:
I и II; III и IV – антиподы, I и III; I и IV; II и III; II и IV – диастереомеры. 50 % I + 50 % II – эритрорацемат 50 % III + 50 % IV - треорацемат
8. Приведите проекционные формулы Фишера всех возможных оптических изомеров для CH3–CH(OH)–СH(NH2)–CHO. Определите абсолютную конфигурацию асимметрических атомов углерода.
9. Возможны ли геометрические изомеры для следующих соединений? Приведите их проекционные формулы:
10. Какие виды изомерии свойственны приведенным соединениям:
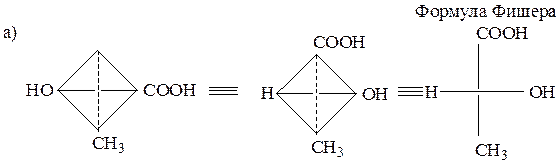
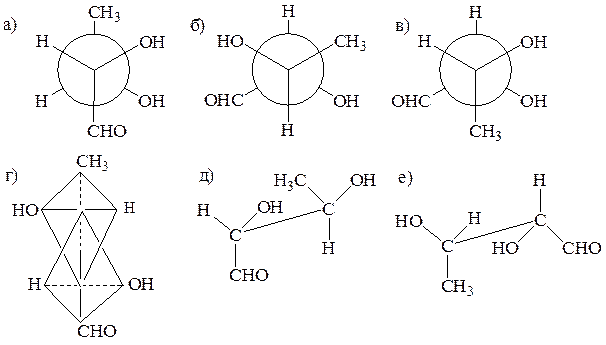
11. Приведите проекционные формулы Фишера для соединений, формулы которых изображены различными графическими способами:
Образец выполнения задания:
12. Приведите проекционные формулы Фишера для соединений: а) 2-аминопропионовая кислота, «S»-конфигурация; б) 2,3-дигидроксиянтарная кислота, «R, R»-конфигурация.
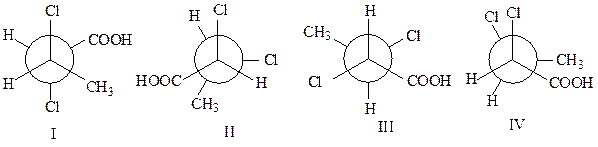
13. Приведите проекционные формулы Фишера всех оптических изомеров для соединений, имеющих следующее химическое строение:
Все ли из указанных изомеров обладают оптической активностью?
14. Приведите проекционные формулы Фишера для соединений, имеющих R,R-конфигурацию для *С2 и *С3. Приведите формулы Ньюмена наиболее устойчивых конформаций для этих форм, определите их (эритро-, трео-):
15. Определите абсолютную конфигурацию каждого хирального центра:
Образец выполнения задания:
16. Используя формулы Фишера, приведите ряд соединений к единообразию. Установите взаимную связь между указанными изомерами (антиподы, диастереомеры, мезоформы, эритро-, треоформы):
Образец выполнения задания:
17. Приведите ряд соединений к единообразию. Установите взаимную связь между указанными изомерами (антиподы, диастереомеры, мезоформы, эритро-, треоформы, рацематы):
18. Приведите ряд соединений к единообразию. Установите взаимную связь между указанными изомерами (антиподы, диастереомеры, мезоформы, эритро-, треоформы, рацематы):
19. Приведите ряд соединений к единообразию. Установите взаимную связь между указанными изомерами (антиподы, диастереомеры, мезоформы, эритро-, треоформы, рацематы):
20. Определите абсолютную конфигурацию (Z и E) для соединений:
Образец выполнения задания: а) E – старшие заместители у каждого атома углерода (Br и COOH) находятся по разные стороны от плоскости двойной связи; б) Z - старшие заместители у каждого атома углерода (-С2Н5 и - CH = CH 2) находятся по одну сторону от плоскости двойной связи
21. Напишите формулы следующих соединений: (Е)-бутена-2, (Z)-пентена-2, (Е)-3-метил-пентена-2.
Задачи
1. Газообразный углеводород имеет следующий элементный состав: С 0.8571, Н 0.1429. Относительная плотность его по водороду равна 21. Определите молекулярную формулу исследуемого углеводорода.
2. Определите молекулярную формулу вещества, если при сжигании 13.8 г его получено 26.4 г СО2 и 16.2 г Н2О. Относительная плотность вещества по водороду равна 23.
3. Выведите молекулярную формулу газообразного вещества, имеющего состав С 0.828, Н 0.172, если известно, что 1 л этого газа весит 2.59 г (н.у.).
4. Выведите молекулярную формулу органического вещества, содержащего 54,5% углерода, 36,4% кислорода и 9,1% водорода. Плотность по водороду равна 44.
5. При сжигании органического вещества, состоящего из углерода, водорода и серы получено 2,64 г углекислого газа, 1,62 г воды и 1, 92 г диоксида серы. Выведите формулу вещества.
6. Выведите молекулярную формулу вещества, содержащего 93,75% углерода, если плотность его по воздуху равна 4,41.
7. Выведите молекулярную формулу органического вещества, содержащего 77,4% углерода, 7,5% водорода и 15,1% азота. Плотность по воздуху равна 3,21.
8. При сжигании 4,3 г углеводорода получено 13,2 г углекислого газа. Выведите формулу вещества.
9. С помощью какого спектрального метода удобнее всего установить наличие той или иной функциональной группы: а) ИК; б) ЯМР; в)УФ?
10. С помощью какого спектрального метода удобнее всего установить наличие группы >С=О: а) ИК; б) ЯМР; в) УФ?
11. Какую информацию дает анализ ИК-спектра: а) о наличии неэквивалентных протонов; б) о наличии определенных функциональных групп?
12. Какие изменения в молекуле при действии электромагнитного излучения фиксирует метод ИК-спектроскопии: а) взаимодействие атомных ядер с радиоизлучением; б) валентные колебания связей между атомами; в) переход валентных электронов на более высокий энергетический уровень?
13. Какие из перечисленных изотопов могут быть объектом метода ЯМР-спектроскопии: а) 13С; б) 16O; в) 31P; г)14N; д)15N; ж) 19F; з) 12С; и) 1H; к) 2H?
14. Какую информацию несет понятие химического сдвига в спектре ПМР: а) наличие разных видов протонов; б) экранирование магнитных ядер; в) количественное соотношение протонов?
15. Какую информацию можно извлечь из интенсивности сигналов в спектре ПМР: а) наличие разных видов протонов; б) различное электронное окружение магнитного ядра; в) количественное соотношение протонов; г) спин-спиновое взаимодействие?
16. Что означает расщепление сигнала в спектре ПМР: а) наличие различных видов протонов; б) взаимодействие магнитных ядер; в) количественное соотношение протонов?
17. Какой вывод можно сделать, если в спектре ПМР органического соединения присутствует три сигнала: а) в молекуле три атома водорода; б) в молекуле три различных типа протонов?
18. Какой вывод можно сделать, если в спектре ПМР органического соединения присутствует сигнал в виде триплета: а) в молекуле три атома водорода; б) в молекуле содержится два протона; в) в молекуле три различных типа протонов?
19*. Установите строение углеводорода С9Н20 на основании ЯМР 1Н спектра, в котором присутствуют два синглета с химическими сдвигами 0.98 м.д. и 1.26 м.д. с соотношением интенсивностей 9:1.
20*. Приведите спектр ЯМР 1Н и интегральную кривую для соединения
21*. Установите строение соединения с формулой С4Н9Br на основании его спектра ЯМР 1Н:
22*. Соединения А и В имеют одинаковую молекулярную формулу С2Н6О. Спектры ЯМР 1Н этих соединений приведены на рисунках. Установите строение веществ А и В.
23. При сжигании одного объема углеводорода в шести объемах кислорода образовалось четыре объема СО2 и четыре объема водяного пара, приведенные к н.у. Определите молекулярную формулу углеводорода.
24*. Установите строение соединения С5Н10О на основании следующих данных: а) ИК-спектр имеет интенсивную полосу поглощения в области 1720 см-1; б) В спектре ЯМР 1Н наблюдается два резонансных сигнала 0.9 м.д. (триплет) и 2.4 м.д. (квадруплет) с соотношением интегральных интенсивностей 3:2.
25*. Установите строение соединения С6Н10О3 на основании следующих данных: а) Данные ИК-спектров указывют на наличие групп
б) спектр ПМР приведен на рисунке
26. Установите строение соединения состава С5Н12О на основании следующих данных: а) ИК-спектр имеет широкую полосу поглощения в области 3200 см-1; б) В спектре ЯМР 1Н наблюдается четыре резонансных сигнала: 0.9 м.д. (триплет), 2.0 м.д. (синглет), 3.0 м.д. (квадруплет), 3.5 м.д. (синглет) с соотношением интенсивностей 3:6:2:1.
27. Установите строение углеводорода С9Н20 на основании ЯМР 1Н спектра, в котором присутствуют два синглета с химическими сдвигами 0.98 м.д.(триплет) и 1.26 м.д. (квадруплет) с соотношением интенсивностей 3:2.
28.Установите строение соединения С6Н12О на основании следующих данных: а) ИК-спектр имеет интенсивную полосу поглощения в области 1725 см-1; б) В спектре ЯМР 1Н наблюдается два синглета: 1.5 м.д. и 2.8 м.д. с соотношением интенсивностей 3:1.
29. Установите строение соединения С4Н11Т на основании следующих данных: а) ИК-спектр имеет одну полосу поглощения в области 3330 см-1; б) В спектре ЯМР 1Н наблюдается три сигнала: 0.8 м.д. (синглет), 1.1 м.д. (триплет) и 2.7 м.д. (квадруплет)с соотношением интегральных интенсивностей 1:6:4.
Алканы Алканы (предельные, насыщенные углеводороды, парафины) – это углеводороды общей формулы CnH2n+2. В их молекулах имеются прочные низкополяризуемые ковалентные s-связи С-С и С-Н. Связи в алканах не проявляют склонности к гетеролитическому разрыву, они устойчивы к действию ионных (нуклеофильных и электрофильных) реагентов. В обычных условиях алканы не реагируют с концентрированными кислотами, с сильными окислителями (KMnO4, K2Cr2O7), щелочными металлами и щелочами.
Однако неполярные С-Н-связи в молекулах алканов способны расщепляться гомолитически при атаке свободными радикалами. К таким процессам относятся реакции радикального замещения атомов водорода - галогенирование, нитрование (реакции Коновалова и Титова), сульфохлорирование и сульфоокисление (I), окисления – частичного или полного (горение) (II), расщепления углеродного скелета – изомеризация, крекинг, дегидрирование до алкенов (III, IV, V). Несмотря на то, что связь С-С менее прочна, чем связь С-Н, последняя рвется легче, так как располагается на периферии молекулы и более доступна для реагента. Реакции замещения носят цепной характер и протекают по механизму SR.
Задачи Номенклатура и изомерия 1. Сущестуют ли алканы, содержание водорода в которых достигает 50%?
2. Напишите структурные формулы всех изомеров гептана. Назовите их по рациональной и систематической номенклатуре. Укажите первичные, вторичные, третичные и четвертичные атомы углерода.
3. Напишите формулы структурных изомеров октана: а) содержащие один вторичный атом углерода, б) не содержащих третичных атомов углерода, в) содержащих два третичных атома углерода.
4. Какие одновалентные радикалы можно образовать от углеводородов: а) н-бутана, б) изобутана, в) неопентана? Назовите эти радикалы.
5*. Напишите структурные формулы изомерных радикалов, имеющих состав: а) –С3Н7, б) –С4Н9, в) –С5Н11. Напишите структурные формулы углеводородов, которым соответствуют эти радикалы.
6*. Укажите число первичных, вторичных, третичных и четвертичных атомов углерода в следующих соединениях: а) СН3СН2СН(СН3)СН3 б) СН3СН(СН3)СН(СН3)СН(СН3)СН2СН3 в) (СН3)2СНСН2СН2СН2С(СН3)2 СН2 СН3 г) СН3С(СН3)2СН(СН3)СН2СН2СН(СН3)СН(СН3)2
7*. Напишите структурные формулы и назовите по систематической номенклатуре следующие соединения: а) триметилметан, б) метилдиэтилметан, в) метилпропилметан, г) метилдиизопропилметан, д) диизопропил.
8*. Сколько изомеров можно вывести из углеводорода, заменяя один атом водорода на атом хлора:
9. Сколько структурных изомеров можно вывести, если заменить один атом водорода на атом брома в 2,3,4-триметилпентане? Назовите получившиеся соединения по систематической номенклатуре.
10. Составьте структурные формулы соединений и назовите их по систематической номенклатуре: а) 3-этилгексан, б) 2,2,5-триметилгептан, в) 2-метил-3-изопропилгептан, г) 2,3,3,4,4-пентаметилпентан, д) изобутан, е) 4,4-диметилоктан, ж) изопентан, з) неопентан
11. Приведите проекции Ньюмена для заслоненной и заторможенной конформации следующих алканов: а) пропан, б) 2-хлорбутан, в) 2,2,3.3-тетраметилбутан. Объясните различную устойчивость конформаций.
12. Найдите ошибку в названии углеводородов: а) 4,4-диметилгептан, б) 2-метил-3-этилбутан, в) 2,4-диметил-2-изопропилпентан.
13. Изобразите спектры ПМР и интегральные кривые для следующих алканов: а) этана, б) тетраметилметана, в) изобутана, г) пропана. Химические свойства 14*. Расположите углеводородные радикалы по увеличению устойчивости. Приведите объяснения.
15*. Расположите углеводородные радикалы по увеличению устойчивости. Приведите объяснения.
16. Напишите уравнения реакций полного сгорания: а) этана, б) бутана, в) 2,2,3-триметилгексана, г) октана. Расставьте коэффициенты.
17. При хлорировании метана получается смесь четырех хлорпроизводных. Сколько хлорпроизводных образуется при хлорировании этана?
18*. Сколько изомерных монохлорпроизводных может образоваться при хлорировании следующих углеводородов: а) пропана, б) бутана, в) изобутана?
19. Напишите уравнения реакций. Укажите механизмы реакций, условия их протекания. Отметьте случаи, где реакция не идет. а) н-бутан + О2 б) н-бутан + Br2 (на свету) → в) н-бутан + Сl2 (на свету)→ г) i-бутан + Br2(на свету) → д) i-бутан + Сl2(на свету) → е) ж) i-бутан +HNO3(разб.) з) i-бутан + Br2 и) этан + HBr → к) метан + SO2 + Сl2 → л) метилбромид + HI → м) этан + KMnO4 н) этан + H2SO4(конц.) →
20. Напишите уравнение реакции монохлорирования изобутана. Рассмотрите механизм реакции (SR).
21. При монохлорировании алканов на свету относительные скорости замещения первичного, вторичного и третичного атомов водорода составляют 1:3,8:5. Рассчитайте изомерный состав смесей, которые образуются при монохлорировании: а) изобутана, б) 2,2-диметилбутана, в) 2,2,3-триметилбутана, г) 2,2,3-триметилпентана, д) декана
22. Объясните различие во взаимодействии пропана с галогенами: а) Пропан + F2 → CF4 б) Пропан + Cl2 → CH3CH2CH2Cl (45%) + CH3CHClCH3(55%) в) Пропан + Br2 → CH3CH2CH2Br (3%) + CH3CHBrCH3(97%) г) Пропан + I2 → реакция не идет
23. Напишите уравнение реакции нитрования (реакция Коновалова) следующих алканов: а) метана, б) изобутана, в) н-бутана, г) 2-метилбутана. Укажите условия реакций. Напишите механизм реакции нитрования.
24*. Какие алканы получатся в результате следующих реакций? а) CH3CH2I + HI → б) CH3CH2CH(CH3)Br + Na → в) CH3CH2Br + CH3Br + Na → г) CH3CH2Br + Mg (эфир) → … д) CH3CH2CH=CH2 + H2(Ni) → 25. Предложите способы получения бутана из а) н-бутилбромида, б) втор-бутилбромида, в) хлорэтана, г) валериановой кислоты, д) бутена-2.
26. Сколько продуктов дегидрирования можно получить из 3-метилпентана? Будут ли полученные алкены иметь геометрические изомеры?
27*. Рассчитайте процентный состав монохлорпроизводных изобутана, получен-ных путем термического хлорирования при 300 ºС. Вероятность отрыва атомов водорода от первичных и третичного атомов углерода составляет 1:3.
28. Напишите уравнение реакции и механизм парофазного окисления бутана кислородом воздуха до уксусной кислоты в присутствии пероксида ацетила СН3 – С(О) – О – О – С(О) – СН3.
29*. Приведите возможные продукты крекинга 2,3-диметилбутана.
30. Из неорганических соединений получите метан.
31.. Из неорганических соединений получите изобутан.
32*. Из пропана получите 2,3,4,5-тетраметилгексан.
33. Осуществите превращения: пропан
34. Осуществите превращения:
Галогеналканы Галогеналканы (алкилгалогениды) можно рассматривать как предельные углеводороды, в молекулах которых один или несколько атомов водорода замещены на атомы галогенов. Обобщенную формулу галогеналканов можно представить таким образом:
Действующий индуктивный эффект делает связь углерод-галоген полярной, склонной к разрыву под действием нуклеофильных частиц. В некоторых случаях связь C-Hal может разрываться по радикальному пути, поэтому галогеналканы могут вступать в реакции радикального замещения. Кроме того, атомы водорода метиленового звена имеют слабо выраженный кислотный характер и поэтому могут быть атакованы основаниями, что приводит к отщеплению (элиминированию) галогеноводорода. Значит, наличие двух реакционных центров в молекуле галогеналкана способствует протеканию двух типов реакций: нуклеофильного и гомолитического замещения (SN и SR) и элиминирования (Е). Легкость реакций и их направление зависит как от строения молекулы галогеналкана, так и от строения реагента. Очень важную роль играет растворитель.
|
|||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 337; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.113.197 (0.422 с.) |
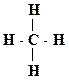 четыре C – Н связи, все ковалентные неполярные.
четыре C – Н связи, все ковалентные неполярные.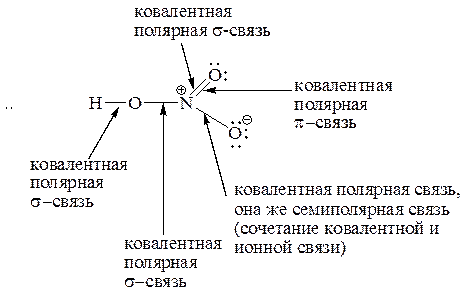
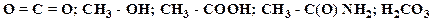
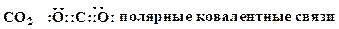
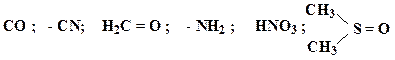
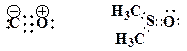
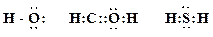
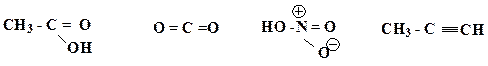
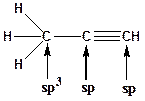
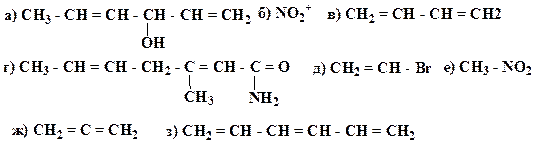
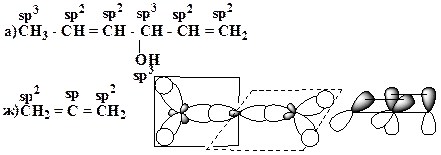
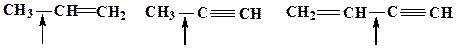
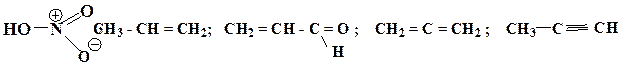
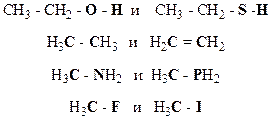
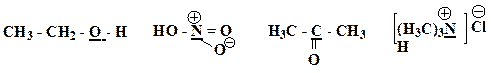
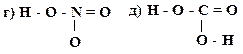
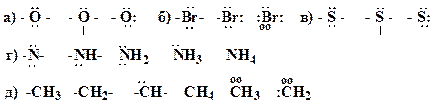
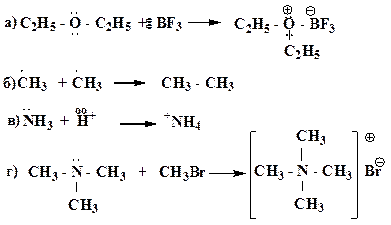
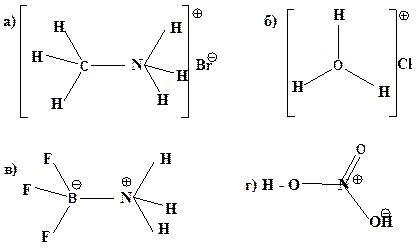
 т.к. ЭОCl > ЭОС
т.к. ЭОCl > ЭОС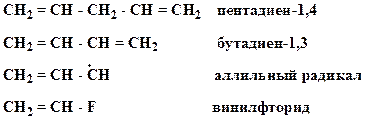
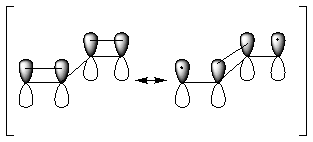
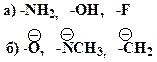
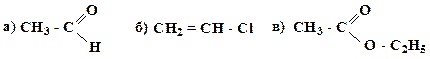

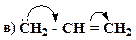 также г), д), е).
также г), д), е).

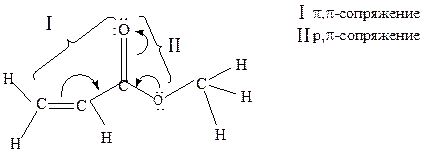

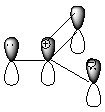


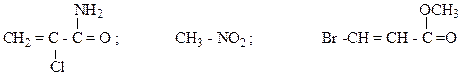
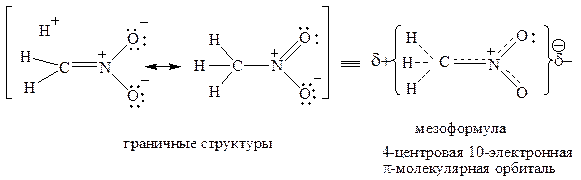
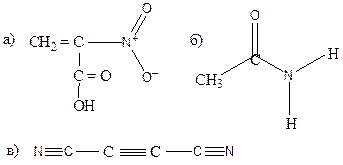

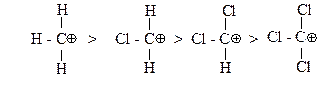
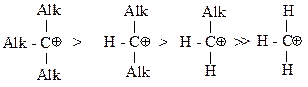
 и заслоненную
и заслоненную 

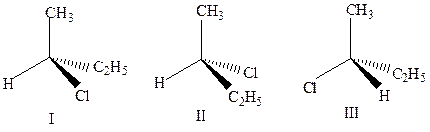
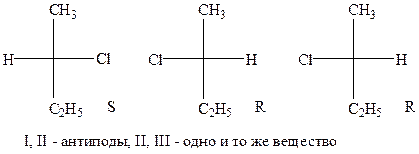
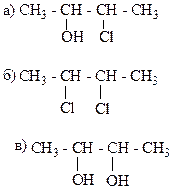
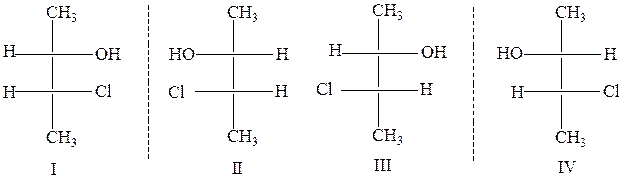
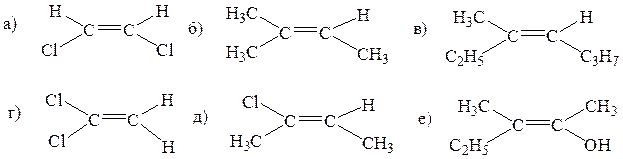
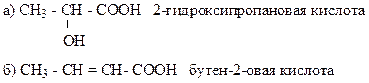
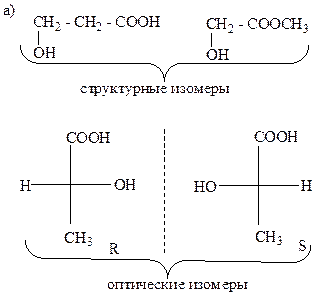
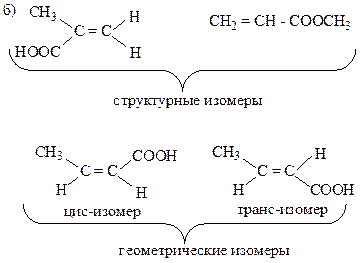
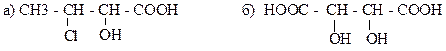
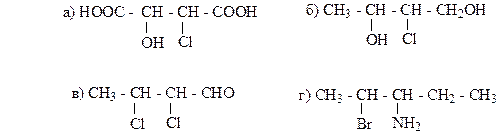


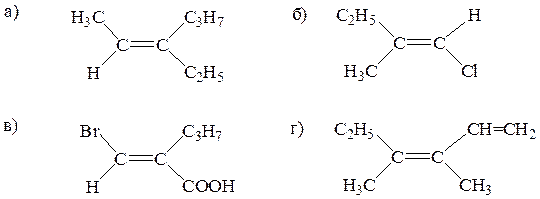
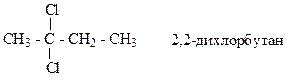
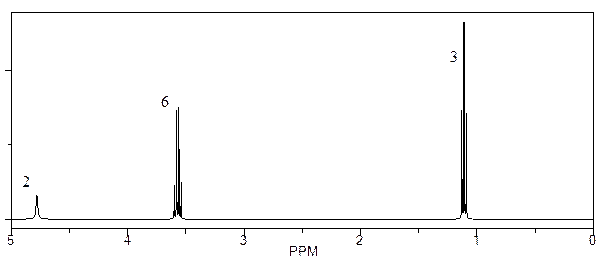
 в
в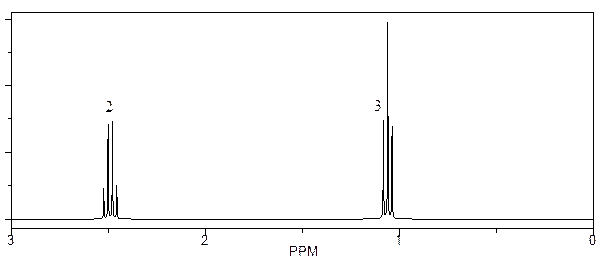
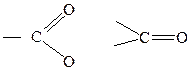
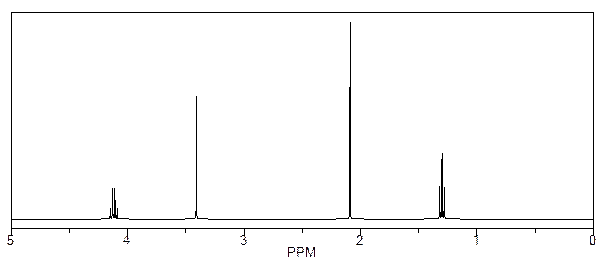
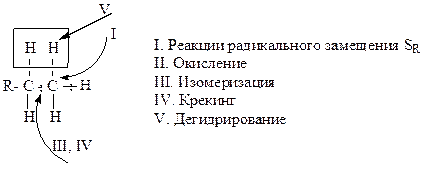
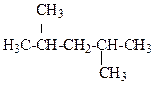
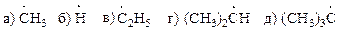


 …
… А
А 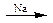 2,3-диметилбутан
2,3-диметилбутан