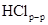Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адсорбция органических катионов
Адсорбция органических катионов или катионных поверхностно-активных веществ на слоистых силикатах имеет большое практическое значение. [ 8, 16-20 ], частности, в связи с модификацией слоистых силикатов для их использования в качестве наполнителя пластмасс и резин. Изучение адсорбции органических катионов на глинистых минералах началось еще в первой половине ХХ века [4, 21]. Ллойд впервые обнаружил в 1910 г., что некоторые из фуллеровых земель удаляют алкалоиды из водных растворов их солей. В 1924 г. Смит осуществил реакции органических оснований и их солей с монтмориллонитом и установил, что эта реакция протекает по механизму ионного обмена. В 1934 г. он опубликовал данные о взаимодействии монтмориллонита с гидразином, аммиаком, пара-амиламином, пиперидином из водных растворов соляной кислоты, причем он показал, что эти амины не вымываются водой, но вымываются 1% раствором NaCl. По предположению Хендрикса, прочность этих комплексов возрастает благодаря тому, что катионы адсорбируются на поверхности монтмориллонита не только электростатически, но также за счет сил Ван-дер-Ваальса. Гизекинг с сотр. в 30-е годы показали, что органические ионы вступают в реакции катионного обмена с глинистыми минералами (особенно с монтмориллонитом). В зависимости от размера и природы этого органического катиона частица глинистого минерала может быть полностью покрыта органическими молекулами толщиной в один молекулярный слой и более. Такие частицы глинистых минералов обладают гидрофобными свойствами и олеофильны. В ряде работ было доказано, что реакция с солями органических аминов в основном заканчивается в течение суток. Реакция с аминами с короткой цепью полностью завершается за три часа при периодическом перемешивании, с аминами с длинной цепью время реакции возрастает до 10 часов, а крупные двухцепочечные амины, такие как диоктадецилдиметиламмоний хлорид, не компенсируют полностью емкость катионного обмена глины даже за 1 сут. Глубина реакции максимальна при концентрации глины не выше 2%, и при концентрации амина не выше ККМ. В случае длинноцепочечных аминов перед смешением лучше нагреть растворы до 50-60°С для повышения растворимости амина [ 8]. Было показано, что адсорбция длинноцепочечных или двухцепочечных аммониевых оснований может превышать емкость катионного обмена, причем если монослойное заполнение происходит по ионообменному механизму, то сверхэквивалентная адсорбция может происходить благодаря Ван-дер-Ваальсову взаимодействию, а также за счет адсорбции мицелл даже при концентрациях ниже ККМ, благодаря большой концентрации аминов возле поверхности [ 22]. Например, для катионов типа цетилпиридиния при концентрации 3 ммоль/л адсорбция может достигать 3-4 значений КОЕ [ 23 ].
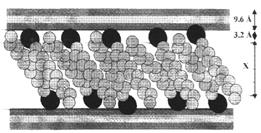
В работе Кована с сотр. [ 23 ] было показано, что с увеличением молекулярной массы аминов начальный наклон и положение плато на изотерме адсорбции возрастают, а начиная с С8 для ряда первичных н-алкил аминов наблюдается адсорбция выше КОЕ. В то же время, рентгеноструктурные данные и данные ИКС указывают на ассоциацию органических катионов и молекул солей (или нейтральных аминов) в межпакетном пространстве. До достижения емкости катионного обмена адсорбция аминов протекает по уравнению:
Выше КОЕ, по данным Тенгаамин соединяется с глиной либо в виде соли (вместе с анионом), либо в виде свободного амина [21]:
( В работе [ 24 ] исследовалась кинетика замещения протонов в Н-монтмориллоните на органические катионы, с разной степенью гидрофобности, и было показано, что в случае короткоцепочечного ЧАС ионный обмен завершается при количестве основания равном КОЕ. Выше точки эквивалентности, протекает дальнейшая адсорбция органической соли, а флокуляция наступает при двукратном избытке тетраметиламмоний иодида. В дальнейшем после введения четырехкратного избытка соли наблюдается пептизация осадка. Пептизация осадка при добавлении более гидрофобного амина - алкиламона начинается вблизи точки эквивалентности. В случае еще более гидрофобного карбазолина, вытеснение ионов водорода и образование осадка заканчивается значительно раньше точки эквивалентности, а затем электропроводность суспензии падает по мере постепенной пептизации осадка, заканчивающейся при концентрации 3×КОЕ. Авторы делают вывод, что чем меньше величина радикала четвертичной соли, тем большее ее количество требуется как для коагуляции, так и для пептизации монтмориллонитовых частиц. Это связано с тем, что крупноразмерные катионы, занимая только часть ионообменных мест, покрывают большую часть гидрофильной поверхности и закрывают доступ к оставшимся на боковых гранях гидроксильным группам, а также к оставшимся невостребованными ионообменным центрам на базальных гранях монтмориллонита.
Было показано [ 25 ], что адсорбция ацетата октадецилтриметиламмония (ОДТАА) происходит быстрее и полнее, чем адсорбция диоктадецилдиметиламмний ацетата (ДОДДАА). В первом случае уже за 5 часов адсорбция практически достигает величины, равной КОЕ монтмориллонита, а в раствор переходит эквивалентное количество ионов натрия. С течением времени, при добавлении новых порций ионов ОДТАА адсорбция увеличивается, однако с все меньшей скоростью. Через три месяца количество адсорбированной соли достигает 2×КОЕ, причем часть органических катионов прочно связана с поверхностью минерала, а вещество, адсорбированное сверх емкости катионного обмена, легко отмывается при диализе. В случае двухцепочечного ДОДДАА, адсорбция, равная КОЕ достигается лишь за 14 дней, и увеличение концентрации органической соли приводит лишь к незначительной сверэквивалентной адсорбции. По данным РФА ионы ОДТА располагаются параллельно поверхности слоя, тогда как ионы ДОДДА занимают большую площадь на поверхности минерала и сильнее раздвигают слои силиката, так как обе цепи располагаются плоско на обеих сторонах пакета. Помимо этого уменьшается теплота смачивания в воде, т.е. снижения гидрофильности по мере увеличения количества адсорбированного органического катиона. Существенно, что эта характеристика отражает способность органоглины набухать в различных растворителях, сорбировать различные органические соединения. В работе [ 26 ] было показано, что константа ионообменной реакции Ca-монтмориллоните практически не зависит от концентрации короткоцепочечных солей аминов. В то же время, она изменяется в зависимости от концентрации длинноцепочечных хлоридов цетил- и додециламмония по экстремальному закону. Первоначальные значения константы относительно невелики, поскольку выигрыш в энергии при ионообменной адсорбции первых длинноцепочечных органических катионов в межпакетном пространстве, по данным авторов, в значительной мере расходуется на расширение решетки монтмориллонита. После расширения решетки проникновение последующих ионов к свободным ионообменным позициям значительно облегчается, и значения константы растут. Дальнейшее возрастание количества поглощенных органических катионов создает стерические препятствия для обмена остаточных ионов Са2+. Данные рентгенофазового анализа, полученные различными авторами, дают возможность судить об ориентации интеркалированных органических катионов в межслоевом пространстве способного к набуханию глинистого минерала. По данным Джордана первичные алкиламмониевые катионы с углеводородным радикалом от C1 до C10 ориентируются плоско (для них d001 составляет 1,36 нм, что соответствует межслоевому раздвижению на 0,4 нм (-СН2- группа). При С12 – С18 d001 составляет 1,76 нм (т.е. раздвижение соответствует двум плосколежащим метиленовым группам или двухслойному расположению адсорбированных катионов). В тоже время, по данным работы [ 27] увеличение межплоскостного расстояния при адсорбции первичных аминов на Li-фторгекторите с емкостью катионного обмена 150 мг-экв/100 г постоянно вплоть до n=12, поскольку алифатические цепи располагаются внутри галерей в виде псевдобислойной структуры. При переходе к высшим аминам, катионы образуют менее упорядоченную псевдо-трехслойную структуру, а затем жидкокристаллическую (парафинообразную) вертикальную структуру. Зависимость d001 от концентрации н-октадециламмония, по данным тех же авторов, позволяет заключить, что при количествах катиона, превышающих КОЕ, второй слой углеводородных цепей начинает располагаться под углом (d001 = 2,16), а затем почти вертикально (d001 = 2,4).
По данным Квирка и Гринленда [ 28 ] адсорбция цетилпиридиний бромида на вермикулите и монтмориллоните достигает плато при вертикальной ориентации алкильного радикала по отношению к минеральной поверхности. При этом пиридиновое кольцо располагается плоско и занимает на поверхности площадь 0,54 нм2. Однако на внешней поверхности частиц при этом может образовываться бимолекулярный слой, поскольку на молекулу приходится ровно половина указанной площади. За счет этого при полном эквивалентном заполнении межслоевого пространства органическими катионами, сами частицы успевают приобрести положительный заряд и становятся гидрофильными. В работе [ 17 ] было обнаружено, что адсорбция цетилтриметиламмоний хлорида приводит к увеличению межплоскостного расстояния до 2,2 нм, причем интенсивный пик наблюдается только при концентрации ЧАС близкой к КОЕ, в остальных случаях пик в этой области является плечом соседнего пика, расположенного в области меньших углов q. В работе [ 29 ] изучалось взаимодействие трех серий катионных ПАВ – N-алкилтриметиламмоний бромидов, N,N-диалкилдиметиламмоний бромидов и a,w-бис(N-алкилдиметиламмоний) алканов с вермикулитом. Были получены значения межплоскостных расстояний для серии алкилтриметиламмоний хлоридов при их содержании равном КОЕ вермикулита. В этом случае органические катионы занимают объем около 70% от свободного межслоевого объема. В таблице представлены значения межплоскостных расстояний, рассчитанные исходя из модели вертикальной ориентации органических катионов под углом 54,5° к поверхности – углом, являющемся наиболее выгодным с точки зрения обеспечения максимального контакта метильной группы с силикатной поверхностью. Для расчета толщина слоя принималась равной 0,96 нм, а высота полярной группы – 0,32 нм.
На рис. 1.3. представлена возможная ориентация данной серии органических катионов в межслоевом пространстве вермикулита.
Рис. 1.3. Строение адсорбционного слоя N -алкилтриметиламмония в межслоевом пространстве вермикулита. Межслоевое расстояние рассчитывали по формуле: Х = (1.265 n + 1,5) * sin (54.5 °), где n – число атомов углерода в алкильном радикале. Было установлено, что происходит уменьшение межплоскостного расстояния при нагревании адсорбционного комплекса при температурах ниже температуры разложения органических катионов в случае додецилтриметиламмоний хлорида (ДТАХ). Уменьшение расстояния возможно связано с плавлением алифатических цепей при температуре около 18°С. Двухцепочечные катионы типа C12CnДАБ и C16CnДАБ, где n – число углеродных атомов во второй цепочке, более плотно упакованы в межслоевом пространстве, чем одноцепочечные катионы, и занимают около 85% свободного объема. Если размер второго углеводородного радикала не превышает 6 атомов углерода, короткая цепь располагается параллельно минеральной поверхности, а длинная цепочка наклонена к поверхности под углом 54,5°. Модельный расчет в этом случае хорошо совпадает с экспериментальными данными. Если длина второй углеводородной цепи превышает 6 атомов углерода, данные рентгенофазового анализа хорошо описываются моделью, согласно которой оба радикала располагаются под углом 35° к поверхности слоистого силиката, и образуется двухслойная структура, в которой углеводородные цепи расположены хвостом к хвосту. В работе [ 30 ] была изучена адсорбция цетилпиридиний хлорида на синтетическом слоистом силикате, магадиите. Методом РФА было показано, что даже при небольшом количестве ЧАС, равном 0,27×КОЕ, происходит увеличение базального расстояния до 2,45 нм. При этом в частично обработанных силикатах на дифрактограммах сохраняется пик, соответствующий базальному расстоянию исходного силиката (d001 = 1,55 нм). Это позволяет утверждать, что часть поверхностей слоистого силиката после четырехчасовой обработки при 20°С остается свободной от органических катионов. В результате обработки органических комплексов в течение нескольких часов в горячей воде во всех случаях наблюдается уменьшение базального расстояния на 0,2-0,6 нм. При использовании ЧАС в количестве менее 0,6×КОЕ на дифрактограммах таких образцов проявляется пик исходного магадиита в виде плеча к пику d002, в то время как до повторной обработки в адсорбционных комплексах исходный пик наблюдается вплоть до исходной концентрации ЧАС 0,92×КОЕ. По результатам химического анализа, количество входящих в состав комплекса органических катионов не изменяется после обработки органических комплексов в горячей воде, во всех случаях за исключением комплекса, содержащего избыток органической соли, В этом случае избыточные органические катионы, адсорбированные на поверхности в виде ионных пар (физически адсорбированные), десорбируются с поверхности слоистого силиката. Таким образом, во всех частично обработанных образцах в результате гидротермальной обработки при 60°С происходит перераспределение и гомогенизация органических катионов в межслоевом пространстве синтетического слоистого силиката. По данным авторов, после обработки органокомплекса снижается содержание остаточного натрия, вследствие замены натрия на протоны. Одновременно со снижением содержания натрия в образцах снижается содержание физически связанной воды. Таким образом, при взаимодействии ЧАС со слоистыми силикатами в водных растворах происходит ряд процессов, связанных с обменом ионов натрия на протоны, перегруппировкой ЧАС, изменением содержания воды и пр.
Для получения более точной информации о структуре адсорбционного слоя наряду с РФА может быть использован метод ИК-спектроскопии [ 31 ]. Пользуясь данными ИК – спектроскопии вместе с данными РФА удалось проследить за изменениями, происходящими в структуре слоистых силикатов при катионном обмене с солями первичных алкиламмониевых катионов. Как оказалось, при увеличению межплоскостного расстояния в ряду гексиламмоний - октадециламмоний одновременно происходит упорядочивание структуры, и переход от жидкообразного латерального монослоя, латерального бислоя, затем псевдотримолекулярного слоя к жидкокристаллическому бислою с высокой степенью упорядоченности. 1.2.3. Коллоидно-химические свойства глинистых минералов, модифицированных органическими катионами. Коллоидно-химические характеристики суспензий слоистых силикатов, обработанных органическими катионами, зависят как от природы катиона, так и от степени замещения неорганических ионов и количества органических катионов на поверхности глинистых частиц. Способность к набуханию в органических растворителях, естественно, улучшается при увеличении длины углеводородного радикала или при увеличении гидрофобности органического катиона. Дисперсность и вязкость растворов также зависят от свойств поверхности глины после обработки органическим катионом. Подбор количества и природы модификатора позволяет регулировать эти свойства и, следовательно, свойства конечного композиционного материала, компонентом которого является органоглина. Четвертичные аммониевые основания являются гораздо более сильными коагулирующими агентами по отношению к глинистым суспензиям, чем неорганические соли. Например, критическая концентрация коагуляции (ККК) в случае 0,025% дисперсии для Na+ составляет 5 ммоль/л, тогда как для ЦТАБ эта величина оказывается равной 0,09 ммоль/л. В водных растворах адсорбция органического катиона приводит к существенным изменениям в распределении заряда в двойном электрическом слое и, значит, – изменяет силы взаимодействия частиц между собой. При адсорбции малых количеств ЧАС вязкость бентонитовых суспензий слегка снижается, органические катионы адсорбируются на отрицательных центрах базальных граней, что приводит к разрушению значительного числа межчастичных контактов типа боковая грань – базальная грань (разрушение структуры типа карточного домика – card-house). При увеличении концентрации органического катиона происходит сильное увеличение вязкости вследствие снижения потенциала ДЭС и гидрофобизации поверхности. Введение большего количества ЧАС приводит к перезарядке поверхности и снижению вязкости. Вязкость суспензии глинистых минералов в присутствии органических катионов определяется концентрацией самой суспензии. Для полного описания реологии систем типа бентонит - катионное ПАВ – вода требуется построение фазовой диаграммы. Так, при введении в бентонитовую или монтмориллонитовую суспензию ЦТАБ могут получаться четыре различных типа дисперсий [ 17 ]. Были получены эмпирические зависимости, связывающие массовые концентрации бентонита и ЧАС при которых наблюдается переход от одного типа системы к другому при данной молекулярной массе ЧАС и значении катионной обменной емкости бентонита. Экспериментальные данные хорошо согласуются с теоретическими: переход I/II происходит при концентрациях ЧАС близких к КОЕ, а переход II/III - при концентрациях, близких к двухкратному значению КОЕ.
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2019-05-20; просмотров: 224; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.102.178 (0.013 с.) |
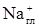 +
+ 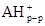 Û
Û 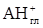 +
+ 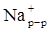
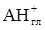 +
+ 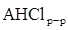 Û (
Û (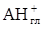 )(
)(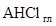 )
)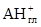 )(
)(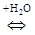
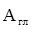 +
+