
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сера и её бинарные бескислородные соединения
391. Опишите строение атома серы. Какие валентности и степени окисления возможны для серы? Почему для серы характерно образование цепочечных химических связей? Изобразите строение молекулы циклооктасеры. Какое образное название отражает строение этой молекулы?
392. В каком виде сера находится в природе, чему равен её кларк? Какая из аллотропных модификаций представляет собой самородную серу? В состав каких минералов входит сера? Встречаются ли на Земле газообразные соединения серы? Какими химическими формулами выражается состав пирита, мирабилита, смитсонита?
393. Как выделяют самородную серу из «пустой» породы? Как получают серу из природного газа и из газов, получаемых при переработке сульфидных руд? Как очищают серу от примесей? Какие объемы H2S и SO2 должны провзаимодействовать для того, чтобы образовалось 100 кг серы?
394. Какие изменения происходят при нагревании серы? Что происходит с серой при её смешивании с водой, сероуглеродом, ацетоном, бензолом? Какая химическая реакция протекает при кипячении серы в растворах щелочей, к какому типу реакций она относится?
395. При растворении 3,24 г серы в 40 г бензола температура его кипения повысилась на 0,81 градуса. Из скольких атомов состоит молекула серы в растворе бензола?
396. Привести примеры реакций, в которых сера является окислителем, восстановителем и диспропорционирует. Что свидетельствует об уменьшении окислительных свойств серы в сравнении с кислородом? Почему реакции окисления серой в ряде случаев (привести примеры) идут с бóльшей скоростью, чем окисление кислородом? Вычислите энтальпию реакций серы с магнием, кальцием, стронцием, барием и объясните увеличение её абсолютного значения.
397. Окисление серы в кислой среде возможно по следующим полуреакциям: S + 4H2O - 6e = SO S + 3H2O - 4e = H2SO3 + 4H+; jº = 0,45 В 2S + 3H2O - 4e = S2O 4S + 6H2O - 10e = S4O Почему сера, как правило, окисляется до серной кислоты? Что происходит при взаимодействии серы с концентрированной серной кислотой? Напишите уравнения реакций:
398. Восстановительные свойства серы в кислой и щелочной средах характеризуются следующими полуреакциями и потенциалами:
S + 4H2O - 6e = SO
S + 8OH- - 6e = SO
В какой среде сера легче окисляется? Напишите уравнения реакций:
399. Какое отношение к сере имеет «серный цвет» и где он применяется? Сера используется для вулканизации каучука – в чем состоит сущность этого процесса, как изменяются свойства каучука при его вулканизации, как называется вулканизированный каучук и где он применяется?
400. Каков тип гибридизации орбиталей серы в молекулах H2S, SO2, SO3 и ионах SO32– и SO42–? Сколько s- и p-связей имеется в этих молекулах и ионах? В составе каких соединений имеются ионы SO32– и SO42–?
401. Объясните химическую связь в молекуле сероводорода и ее строение, приведите характеристики связи: длину, энергию, валентный угол, дипольный момент. Почему валентный угол в молекуле H2S меньше, чем в H2O? Образуются ли водородные связи между молекулами сероводорода?
402. Опишите физические свойства сероводорода, вычислите его относительную плотность по водороду, воздуху и абсолютную. приведите данные о растворимости сероводорода в воде; почему она невелика – ведь старинное правило гласит: подобное растворяется в подобном?
403. По растворимости сероводорода в воде при 20 ºC в справочной литературе и учебных пособиях имеются такие данные: а) 2,6 мл газа (н.у.) в 100 г H2O;
404. Концентрация насыщенного водного раствора сероводорода при 20 ºC приблизительно равна 0,1 М. Вычислите степень диссоциации H2S в этом растворе по первой и второй ступеням и pH раствора. Какое из названий – сероводородная кислота или сероводородная вода – более соответствуют этому раствору? 405. Предельно допустимой концентрацией сероводорода в воздухе промышленных помещений считается 0,01 мг/л. Какая масса и какой объем H2S в чистом виде находится в помещении объемом 100 м3 при этой концентрации?
406. Сероводород можно получать из водорода и серы по реакции:
2H2(г) + S2(г) D 2H2S(г).
Вычислите энергию Гиббса этой реакции при нескольких температурах в интервале от 273 К до 1000 К и постройте график зависимости
407. Для лабораторных целей сероводород получают действием серной или соляной кислоты на сульфид железа (II). Напишите уравнение реакции. Можно ли использовать в этой реакции азотную кислоту? Какая масса FeS понадобится для того, чтобы выделившегося сероводорода оказалось достаточно для получения одного литра сероводородной воды с молярной концентрацией H2S 0,1 М, если через воду обычно пропускают двукратный избыток сероводорода?
408. Соляной кислотой обрабатывали вещество, в котором содержится 95 % FeS, остальное – свободное железо. Какой объем сероводорода (н.у.) выделился из 100 г такого вещества? Какой газ будет примесью в сероводороде и чему равна объемная доля этой примеси?
409. Какая масса сульфида алюминия образуется в результате взаимодействия 10,8 г алюминия с 9,6 г серы? Какое вещество взято в избытке? Определите массу избытка. Вычислите объем 20 %-й соляной кислоты (r = 1,10), который потребуется для взаимодействия с продуктом реакции.
410. Для реакции взяли 13,08 г цинка и 6,00 г серы. Продукты реакции обработали 10 %-й серной кислотой, взятой в избытке. Определите объёмы выделившихся газов.
411. При поглощении сероводорода растворами щелочей образуется или нормальная соль, или кислая. Какой объем H2S (н. у.) поглощается одним литром 1 М раствора NaOH при образовании нормальной и какой – при образовании кислой соли?
412. Сероводород, образующийся при действии кислот на сульфиды – влажный. Для осушения сероводорода предлагаются три вещества: концентрированная серная кислота, безводный хлорид кальция и твердая щелочь. Какой из этих осушителей можно использовать, а какие – нельзя?
413. Почему нельзя сушить сероводород концентрированной серной кислотой? Напишите уравнения возможных реакций. Какая из них термодинамически наиболее вероятна?
414. Почему сероводород считается сильным восстановителем? Напишите уравнения реакций, в которых сероводород окисляется до серы:
Какой объем сероводорода, измеренный при 17 ºC и 98 кПа, пропустили через
415. Какой объем сероводорода при 20 ºC и 100 кПа необходимо пропустить через один литр раствора, в котором содержится 0,1 моль иода, для того, чтобы произошло полное восстановление иода?
416. Дихромат калия в одном литре децинормального раствора был восстановлен пропусканием через раствор 10 л воздуха, содержащего сероводород. Чему равно содержание H2S в воздухе в объемных процентах?
417. Напишите уравнения реакций, в которых сероводород окисляется до серной кислоты:
Чему равно содержание сероводорода в одном литре воздуха, если после его окисления на нейтрализацию образовавшейся серной кислоты было израсходовано 100 мл децимолярного раствора гидроксида натрия?
418. Горение сероводорода можно выразить уравнениями:
1) 2H2S + 3O2 = 2SO2 + 2H2O 2) 2H2S + O2 = 2S + 2H2O
Вычислите термодинамические параметры реакций; какая из них более вероятна? Чему равен объем воздуха, теоретически необходимый для сжигания 100 л H2S (н.у.) по термодинамически более вероятной реакции?
419. Продукты сжигания 29,6 л сероводорода (н.у.) поглотили 500 мл 25%-го раствора гидроксида натрия (r = 1,28). Каким стал качественный и количественный состав раствора щелочи?
420. Какие соединения называются сульфидами, полисульфидами, персульфидами, сульфанами? Напишите уравнения реакций для осуществления следующей цепочки превращений:
421. Напишите уравнения реакций получения сульфида натрия: а) из простых веществ, б) из натрия и сероводорода, в) из оксида натрия и сероводорода, г) из гидроксида натрия и сероводорода, д) из сульфата натрия. При какой температуре термодинамически возможно получение Na2S восстановлением сульфата натрия углеродом? Какую массу сульфида натрия можно получить из одной тонны Na2SO4, если выход реакции равен 90 %?
422. Перечислите сульфиды, которые растворяются: а) в воде, б) в соляной и разбавленной серной кислотах, в) в азотной кислоте и в царской водке, г) в растворах сульфида аммония и щелочных металлов. Напишите уравнения реакций, которыми сопровождается растворение Na2S, FeS, PbS и Sb2S3 в соответствующих средах.
423. Вычислите показатели гидролиза сульфидов натрия и аммония в децимолярных растворах. Почему раствор сульфида аммония готовят в лабораториях непосредственно перед употреблением и ежедневно обновляют?
424. В раствор, содержащий сульфаты меди (II), марганца (II), цинка и кадмия одинаковой концентрации, медленной струей пропускается сероводород. Какие реакции и в какой последовательности идут в растворе?
425. При каком соотношении молярных концентраций ионов свинца (II) и меди (II) их осаждение при пропускании сероводорода через раствор произойдет одновременно? При каком соотношении молярных концентраций в растворе ионов железа (II) и цинка их осаждение при смешивании с раствором сульфида натрия произойдет одновременно? Почему в первом случае для осаждения сульфидов используется H2S, а во втором – Na2S?
426. Какие сульфиды разлагаются в воде полностью с выделением сероводорода и образованием оснований и кислот? Напишите уравнение гидролиза одного из этих сульфидов.
427. Вследствие закономерного изменения свойств сульфидов в периодах и в группах, возможны реакции соединения сульфидов. Объясните, между какими сульфидами и почему возможны такие реакции и привести их примеры (3 уравнения). К какому классу соединений относятся образующиеся продукты и как они называются?
428. Сравните окислительно-восстановительные потенциалы:
S2- -2e = S; jº = -0,48 В
HS- -2e = S + H+; jº = -0,06 В
S2- + 3H2O - 6e = SO32- + 6H+; jº = –0,23 В
S2- + 4H2O - 8e = SO42- + 8H+; jº = -0,15 В
До каких соединений окисление сульфидов и гидросульфидов более вероятно и до каких менее вероятно? Приведите примеры реакций. 429. Напишите формулы всех соединений серы с галогенами. Объясните химическую связь и строение молекул SF4, SF6 и S2Cl2. Какими необычными свойствами отличается гексафторид серы и чем они объясняются?
430. Напишите уравнения реакций гидролиза галогенидов серы: SF4, SCl4, SCl2, S2Cl2, S2Br2. Чем отличается гидролиз последних трех от гидролиза первых двух? Почему гексафторид серы SF6 устойчив к гидролизу?
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 1025; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.170.17 (0.027 с.) |
 + 8H+; jº = 0,36 В
+ 8H+; jº = 0,36 В + 6H+; jº = 0,46 В
+ 6H+; jº = 0,46 В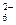 + 12H+; jº = 0,42 В
+ 12H+; jº = 0,42 В от температуры. Определите по графику температуру, при которой прямое направление реакции изменяется на обратное. Совпадают ли результаты расчетов с литературными данными о том, что равновесие этой реакции около 350 ºC смещено в сторону продукта, а при 400 ºC начинается термическая диссоциация H2S?
от температуры. Определите по графику температуру, при которой прямое направление реакции изменяется на обратное. Совпадают ли результаты расчетов с литературными данными о том, что равновесие этой реакции около 350 ºC смещено в сторону продукта, а при 400 ºC начинается термическая диссоциация H2S?



