
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Бинарные соединения кислорода
351. Опишите строение молекулы воды и механизм образования в ней химических связей, укажите валентный угол и дипольный момент молекулы, эффективные заряды атомов водорода и кислорода. Объясните возможность образования молекулой воды дополнительных донорно-акцепторных связей и приведите примеры соответствующих соединений.
352. Приведите физические характеристики воды и укажите, какие из них приняты как эталонные. Вычислите абсолютную массу одной молекулы воды и число молекул, находящихся в одной капле (0,1 г) воды.
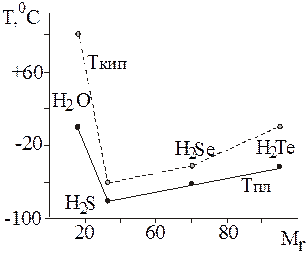
353. Почему, как показывает рис. 1, вода плавится и кипит при аномально высоких температурах в сравнении со своими однотипными соединениями?
354. Водородная связь между молекулами воды слабее, чем между молекулами HF, молекулярная масса H2O также меньше, чем HF. Но температура плавления (273 К) и кипения (373 К) воды значительно выше, чем фтороводорода (190 К и 292 К). Почему?
355. Какое строение имеет лед и жидкая вода? Почему при плавлении льда плотность не уменьшается, а увеличивается? При какой температуре вода характеризуется максимальной плотностью, какое значение имеет эта особенность воды для жизни на Земле? Какую массу имеет1 м3 воды при температуре ее максимальной плотности?
356. Какая вода называется тяжелой водой, как ее получают и каково её применение? Какая вода называется баритовой, жавелевой, известковой, хлорной, жесткой, мягкой? К какому типу относится вода, в 10 л которой содержится 6 г растворенного хлорида кальция?
357. Какая вода называется дистиллированной, природной, минеральной, водопроводной, сточной, морской? Каковы особенности состава каждой из этих вод? Содержание брома в морской воде в среднем составляет 65 мг/л. Какой объем воды необходимо переработать для получения одной тонны брома при его 100% -ном извлечении?
358. Почему вода широко используется как растворитель? Как классифицируются соли, основания и кислоты по их растворимости в воде? Какой объем воды потребуется для растворения в воде при 20 ºC хлорида натрия и хлорида серебра, взяты по одному грамму? Чему равны массовые доли и молярные концентрации насыщенных растворов NaCl и AgCl?
359. Почему растворение веществ в воде сопровождается тепловыми эффектами? Почему растворение кислот сопровождается выделением тепла, а растворение большинства солей – поглощением тепла? Сколько тепла выделится при растворении одного моля безводной серной кислоты в одном литре воды и на сколько градусов при этом может повыситься температура при отсутствии теплоотвода в окружающую среду?
360. Почему при растворении многих (каких?) веществ в воде происходит их электролитическая диссоциация? Опишите механизм этого процесса на примере HCl и NaCl. Напишите схемы диссоциации H2SO4, Na2SO4, KHSO4 и (FeOH)2SO4. Определите степень диссоциации гидросульфата калия в одномолярном растворе по первой и второй ступеням.
361. Почему при кристаллизации из воды многих солей они выделяются в виде кристаллогидратов? Один из кристаллогидратов называется кристаллической содой. Определить формулу этого соединения, если оно содержит 16,08 % натрия, 4,20 % углерода, 72,72 % кислорода и 7,00 % водорода.
362. Почему растворенные соли при выделении из воды образуются в виде кристаллогидратов? Кристаллогидраты сульфата натрия и хлорида бария взяли по одному грамму и прогрели до постоянной массы, которая оказалась равной
363. Почему вода часто содержится во внутренней сфере комплексных соединений? Как называются эти соединения? Определите формулу такого соединения, в котором массовые доли воды, ионов Cl– и Fe3+ равны 39,97 %, 39,36 %
364. Почему в чистой дистиллированной воде имеются катионы гидроксония и гидроксид-анионы? Каким показателем выражается их концентрация? Вычислите этот показатель для чистой воды, после растворения в одном литре воды
365. При растворении в воде многих веществ происходит их взаимодействие с водой, в результате которого изменяется среда раствора. Как называется это взаимодействие и как оно объясняется? Приведите примеры и классификацию этого взаимодействия. Для 0,1 М раствора NH4Cl вычислите константу равновесия (как она называется?) этого взаимодействия.
366. Приведите примеры химических реакций, в которых вода выступает в роли окислителя, восстановителя, катализатора или только среды. Какая масса алюминия может быть окислена 100 мл H2O в щелочном растворе? Какой объем водорода (40 ºC; 105 кПа) выделится при этом?
367. За счет водорода (+1) вода может быть окислителем. По уравнению Нернста вычислите окислительно-восстановительный потенциал воды при 25 ºC. Исходя из свойств ряда электродных потенциалов, укажите металлы, которые окисляются водой. Какая масса воды окисляет 200 г кальция и какой объем водорода при 60 ºC и 105 кПа выделяется при этом?
368. За счет кислорода (-2) вода может быть восстановителем:
2H2O - 4e = O2 + 4H+; jº = 1,23 В
2H2O - 2e = H2O2 + 2H+; jº = 1,77 В
Приведите уравнения реакций воды с окислителями – фтором, гексафторидом платины, пентафторидом золота, озоном. Какой объем выделяющегося кислорода (н.у.) соответствует одному молю израсходованного окислителя в этих реакциях?
369. Вода, присутствующая в воздухе и газах, «мешает» проведению некоторых химических реакций, «отравляет» катализаторы, вызывает гидролиз и т.д. Какие вещества используются в качестве осушителей и что является показателем эффективности того или иного осушителя? Почему в качестве осушителя используют концентрированную серную кислоту, хлорид кальция, ангидрон, фосфорный ангидрид, силикагель и цеолиты? Какие из перечисленных осушителей нельзя (почему?) использовать для осушки аммиака и углекислого газа?
370. Перед употреблением воды для получения пара на тепловых электростанциях она проходит водоподготовку. Из каких операций состоит процесс водоподготовки, какие реагенты используются в этом процессе?
371. Приведите примеры бинарных соединений кислорода (оксидов, пероксидов, надпероксидов, озонидов). Укажите в них степень окисления кислорода; кратко опишите их важнейшие свойства.
372. Почему в ряду оксидов, образованных элементами одного периода, эффективный заряд атома кислорода уменьшается, например:
Na2O–0,81 – MgO–0,72 – Al2O3–0,31 – SiO2–0,23 – P2O5–013 – SO3–0,06 – Cl2O7–0,02?
Соответствует ли изменение основно-кислотных свойств оксидов изменению эффективного заряда кислорода? Ответ иллюстрируйте уравнениями реакций.
373. Какие оксиды относятся к веществам с молекулярной структурой, кристаллического строения, к дальтонидам и бертоллидам? Каковы электрофизические свойства оксидов переменного состава – бертолидов? Ответ иллюстрируйте примерами. Определите точную формулу одного из оксидов марганца, массовая доля кислорода в котором составляет 31,8 %.
374. Опишите строение молекулы и свойства пероксида водорода H2O2, сравнивая их со свойствами воды. Какой объем пергидроля (30%-й раствор H2O2, плотность r = 1,112) можно получить из одного килограмма BaO2 по его обменной реакции с серной кислотой?
375. Чем объясняется неограниченная растворимость H2O2 в воде и то, что в безводном виде это вещество само по себе является хорошим ионизирующим растворителем? Какой объем пергидроля (30%-й раствор H2O2, плотность r = 1,112) можно получить из одного килограмма пероксомоносерной и пероксодисерной кислот при взаимодействии каждой из них с водой?
376. Выпишите из справочной литературы данные, характеризующие окислительно-восстановительные свойства пероксида водорода. В какой среде его целесообразно использовать в качестве окислителя и в какой – восстановителя? Напишите уравнение диспропорционирования H2O2 и укажите условия осуществления этой реакции. Вычислите массовую долю пероксида водорода в растворе, если при полном диспропорционировании Н2О2 из 100 г этого раствора выделяется 11,2 л (н.у.) кислорода.
377. Сравните окислительно-восстановительные потенциалы полуреакций:
O2 + 4H+ + 4e = 2H2O; jº = 1,23 В
H2O2 + 2H+ + 2e = 2H2O; jº = 1,78 В
O3 + 2H+ + 2e = O2 + H2O; jº = 2,07 В
Почему пероксид водорода является более сильным окислителем, чем кислород, но менее сильным, чем озон? Какая масса Fe(OH)2 окисляется до Fe(OH)3 при взаимодействии с 100 мл 8%-го раствора H2O2 (r = 1,028)?
378. Напишите уравнения реакций, укажите в них функцию пероксида водорода:
При взаимодействии 100 г раствора пероксида водорода с подкисленным серной кислотой раствором иодида калия образовалось 76,2 г иода. Вычислите массовую долю H2O2 в растворе.
379. Напишите уравнения реакций, укажите в них функцию пероксида водорода:
Какой объем кислорода (15 ºC; 110 кПа) выделится при взаимодействии 100 мл 0,05 М раствора перманганата калия c избытком пероксида водорода в сернокислом растворе?
380. Напишите уравнения реакций, укажите в них функцию пероксида водорода:
Какой объем 22%-го раствора H2O2 (r = 1,08) потребуется для восстановления в присутствии серной кислоты всего дихромата калия в 0,5 л децимолярного раствора? Какой объем кислорода, измеренный при нормальных условиях, выделится из раствора?
381. Напишите уравнения реакций, укажите в них функцию пероксида водорода:
Какой объем 10%-го раствора H2O2 (r = 1,035) потребуется для окисления в присутствии серной кислоты всего FeSO4 в 0,1 л его 1 М раствора?
382. Вычислите и сравните термодинамические параметры двух близких реакций: 1) H2 + O2 = H2O2; 2) H2 + 1/2O2 = H2O.
Можно ли получить пероксид водорода при непосредственном взаимодействии водорода с кислородом? Если можно, то при каких условиях следует проводить эту реакцию?
383. Пероксид водорода относится к термодинамически устойчивым веществам (DGºf = -120,4 кДж/моль), но при стандартных условиях он самопроизвольно разлагается. Чем объясняется разложение пероксида водорода? Почему разбавленные растворы H2O2 боле устойчивы, чем концентрированные? Какой объем кислорода получается при полном разложении 100 мл 75%-го H2O2 (r = 1,29)?
384. Какие соединения называются пероксидами? Какие из элементов образуют наиболее стабильные пероксиды? Как получают технически наиболее важные пероксиды натрия и бария? Определите массовую долю кислорода в оксиде и в пероксиде натрия. Какое из этих соединений более «богато» кислородом?
385. К какому классу химических соединений относятся Na2O2, BaO2, ZnO2? Напишите структурную формулу BaO2, уравнение реакции его получения и разложения при нагревании. Какой объем кислорода (н.у.) выделяется при разложении 1 кг BaO2?
386. Пероксид натрия поглощает аммиак, максимально его окисляя. Напишите уравнение реакции. Какая масса Na2O2 расходуется на поглощение 11,2 л NH3 (н.у.), какие массы NaNO3, NaOH, Na2O при этом образуются?
387. Пероксид натрия поглощает сероводород, максимально его окисляя. Образующиеся «побочные» продукты NaOH и Na2O, в свою очередь, взаимодействуют с сероводородом по типу основно-кислотных реакций. Напишите уравнения всех стадий и общее уравнение процесса. Какой объем H2S (н.у.) поглощается одним килограммом Na2O2, сколько литров сероводорода при этом окисляется, а сколько превращается в сульфид натрия?
388. Пероксид натрия поглощает углекислый газ с выделением кислорода, что можно использовать для регенерации кислорода в замкнутых помещениях. Напишите уравнение реакции. Вычислите массу Na2O2, которая потребовалась бы для поглощения 100 л CO2? Происходит ли при этом полная регенерация кислорода?
389. Смесь пероксида натрия и надпероксида калия (техническое название – ксилит) используется для регенерации воздуха в замкнутых помещениях. Покажите уравнениями реакций, при каком мольном соотношении Na2O2: KO2 происходит полная регенерация воздуха. Вычислите массы Na2O2 и KO2 и общую массу ксилита, которые потребуются для восстановления воздуха в помещении объемом 30 м3 после того, как кислород в нем был израсходован (на дыхание) на 50 %. 390. Чем отличаются от всех соединений кислорода его соединения с фтором и диоксигенильные соединения? Приведите формулы соединений, имеющих названия: а) дифторид кислорода, б) дифторид дикислорода, в) гексафтороплатинат (IV) диоксигенила, г) гексафторостибат(V) диоксигенила, д) тетрафтороборат(III) диоксигенила. Опишите методы их получения. Имеют ли эти соединения практическое значение? Опишите электронное и геометрическое строение дифторида кислорода и дифторида дикислорода.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 845; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.191.169 (0.03 с.) |
 =
=



