
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
С кислотами, щелочами, водой
81. Почему с соляной кислотой взаимодействуют только такие металлы, которые расположены в ряду напряжений до водорода? Почему свинец и таллий с соляной кислотой не взаимодействуют? Определите массу железа, взаимодействующую с одним литром этой кислоты с массовой долей HCl 10,52 % и плотностью раствора r = 1,05.
82. Почему с разбавленной серной кислотой взаимодействуют только такие металлы, которые расположены в ряду напряжений до водорода? Почему среди этих металлов свинец является исключением? Определите массу цинка, взаимодействующую с одним литром 4,0%-й серной кислоты (r = 1,025).
83. Почему кремний, не взаимодействующий с сильными кислотами (HCl, H2SO4, HClO4), взаимодействует со слабой фтороводородной кислотой? Вычислите объем водорода, образующийся при взаимодействии 280 г кремния с избытком этой кислоты при 20 ºC и 100 кПа.
84. Концентрированная серная кислота может восстанавливаться по следующим полуреакциям:
SO42– + 4H+ + 2e = SO2 + 2H2O; jº = 0,17 В
SO42– + 8H+ + 6e = S + 4H2O; jº = 0,36 В
SO42– + 10H+ + 8e = H2S + 4H2O; jº = 0,30 В Напишите уравнения возможных реакций цинка с концентрированной серной кислотой и укажите термодинамически наиболее вероятную. Чему будет равна массовая доля H2SO4 в растворе после того, как 300 мл 80%-го раствора этой кислоты (r = 1,73) провзаимодействуют с 50 г цинка?
85. По уравнению Нернста вычислите значение окислительно-восстановительного потенциала 60 %-й серной кислоты (r = 1,50) при её восстановлении до SO2. Напишите уравнение её взаимодействия с серебром. Вычислите массу провзаимодействовавшего серебра по этому уравнению, если объем выделившегося SO2 (при н.у.) составил 2,80 л.
86. По уравнению Нернста вычислите значение окислительно-восстановительного потенциала 82 %-й серной кислоты (r = 1,75) при её восстановлении до SO2. Напишите уравнение ее взаимодействия с медью. Вычислите объем сернистого газа (30 ºC, 100 кПа), образующегося при взаимодействии по этому уравнению 50 г меди.
87. Из сравнения значений окислительно-восстановительного потенциала полуреакций: C + 2H2O - 4e = CO2 + 4H+; jº = 0,48 В
SO42– + 4H+ + 2e = SO2 + 2H2O; jº = 0,17 В
SO42– + 8H+ + 6e = S + 4H2O; jº = 0,36 В
SO42– + 10H+ + 8e = H2S + 4H2O; jº = 0,30 В
следует, что углерод не может быть окислен серной кислотой. В действительности углеродосодержащие вещества (сажа, кокс, активированный уголь и т.д.) взаимодействуют с концентрированной серной кислотой. Объясните это противоречие, напишите уравнения возможных реакций и укажите среди них наиболее вероятное.
88. Опишите термодинамические и кинетические закономерности взаимодействия металлов с азотной кислотой, покажите невозможность описания реакции любого металла с HNO3 одним уравнением. В качестве примера напишите уравнения возможных реакций железа с азотной кислотой и укажите среди них наиболее вероятное.
89. Одни авторы считают, что молибден взаимодействует с азотной кислотой в одну стадию Mo + HNO3 + 2H2O ® H2MoO4 + NO,
а другие отстаивают двухстадийный механизм:
1) Mo + HNO3 ® MoO2 + NO + H2O;
2) MoO2 + HNO3 + H2O ® H2MoO4 + NO
Сформулируйте свою точку зрения, исходя из потенциалов полуреакций:
Mo + 2H2O - 4e = MoO2 + 4H+; jº = -0,07 В
MoO2 + 2H2O - 2e = H2MoO4 + 2H+; jº = 0,39 В
Mo + 4H2O - 6e = H2MoO4 + 6H+; jº = 0,15 В
90. Установлено, что при взаимодействии 48,4%-й HNO3 (r = 1,30) с железом (при нагревании) выделяется оксид азота (II). Определите массу железных стружек, которая потребуется для получения 20 л NO по этой реакции при 80 ºC и 101325 Па.
91. Фосфор теоретически может взаимодействовать с азотной кислотой в одну стадию (P® H3PO4) или в две (P® H3PO3® H3PO4). Исходя из значений потенциалов полуреакций
P + 3H2O - 3e = H3PO3 + 3H+; jº = -0,50 В
P + 4H2O - 5e = H3PO4 + 5H+; jº = -0,41 В
H3PO3 + H2O - 2e = H3PO4 + 2H+; jº = 0,15 В
обоснуйте более вероятный вариант и напишите для него уравнения реакций, считая, что HNO3 восстанавливается до NO. Вычислите массу H3PO4 и объем NO (при н.у.), образующихся при взаимодействии с азотной кислотой 155 г белого фосфора.
92. Для получения царской водки 100 мл 60%-й HNO3 (r = 1,36) смешали с 300 мл 40%-й HCl (r = 1,20). Вычислите массу, объем и плотность полученной царской водки, молярное соотношение HNO3:HCl в ней и массу золота, которую она может «растворить».
93. Смешали 75 мл 60%-й HNO3 (r = 1,36) и 350 мл 20%-й фтороводородной кислоты (r = 1,07). Вычислите массу, объем и плотность полученной смеси, молярное соотношение HNO3: HF в ней и массу вольфрама, которую она может «растворить».
94. Объясните, почему с растворами щелочей могут взаимодействовать только такие амфотерные металлы, окислительно-восстановительные потенциалы которых jº меньше величины –0,83 В Приведите примеры таких металлов и уравнения их взаимодействия с раствором NaOH.
95. Металлы подразделяются на амфотерные (взаимодействуют с растворами и расплавами щелочей), слабоамфотерные (взаимодействуют только с расплавами щелочей) и неамфотерные (со щелочами не взаимодействуют). Приведите примеры указанных групп металлов и уравнения их реакций с растворами и расплавами щелочей. 96. Напишите уравнения реакций алюминия с раствором гидроксида натрия с образованием тетрагидроксокомплексного и гексагидроксокомплексного соединений и уравнение реакции алюминия с расплавом NaOH с образованием ортоалюмината натрия. Какая масса щелочи (в чистом виде) расходуется на взаимодействие с 0,54 кг алюминия в каждом случае?
97. Напишите уравнения реакций хрома с раствором и с расплавом KOH при недостатке и при избытке щелочи. Какая масса KOH потребуется для взаимодействия с 260 г хрома в каждом случае?
98. Напишите уравнения реакций серы, фтора и хлора с гидроксидом калия и укажите их тип. Вычислите массу каждого реагента, взаимодействующую с одним литром 40%-го раствора KOH (плотность раствора r = 1,40).
99. Опишите закономерности взаимодействия металлов с водой, ответив в описании на следующие вопросы: 1) почему с чистой водой взаимодействуют только такие металлы, электродный потенциал которых jº меньше величины
100. Опишите взаимодействие неметаллов с водой, поделив их на четыре группы: 1) окисляют воду, 2) восстанавливают воду, 3) диспропорционируют в воде, 4) не взаимодействуют с водой. Для реакции хлора с водой по стандартным значениям окислительно-восстановительных потенциалов полуреакций вычислите энергию Гиббса и константу равновесия и сделайте вывод о полноте ее протекания. Глава вторая. ВОДОРОД И ГАЛОГЕНЫ
Водород и его соединения. Фтор и его соединения. Хлор, бром, йод – простые вещества и соединения между собой. Галогеноводородные соединения и галогениды. Кислородосодержащие соединения галогенов.
ВОДОРОД И ЕГО СОЕДИНЕНИЯ
101. Почему водород является уникальным химическим элементом, не имеющим близких аналогов? Почему его размещают не только в седьмой, но и в первой группе периодической системы? Какие свойства водорода подобны свойствам галогенов, а какие – щелочных элементов?
102. Объясните химическую связь в молекуле водорода методом валентных связей и методом молекулярных орбиталей. Установите возможность существования молекулярных ионов
103. Опишите механизм ван-дер-ваальсового взаимодействия между молекулами водорода. Почему водород имеет очень низкие температуры плавления
104. Для обратимой реакции разложения водорода на атомы (H2 D 2H) вычислите: а) энергию Гиббса, константу равновесия и степень разложения H2 при 2000 К; б) температуру, выше которой прямой процесс (атомизация молекул) преобладает над обратным (рекомбинация атомов). Данные для расчетов:
105. Почему водород при его образовании в какой-либо реакции (в момент выделения) является более сильным восстановителем, чем обычный водород? Запишите по стадиям (с расстановкой стехиометрических коэффициентов) уравнения реакций, в которых восстановителем является водород в момент выделения:
а) Zn + KMnO4 + H2SO4 ® ZnSO4 + MnSO4 + K2SO4 + H2O
б) Al + NaNO3 + NaOH ® Na3[Al(OH)6] + NH3 + H2O
106. Приведите по 2–3 примера химических реакций, в которых водород является окислителем и восстановителем. Какова функция водорода при его взаимодействии с оксидами металлов? Вычислите объем водорода (при н.у.), который теоретически потребуется для получения 1 кг вольфрама из WO3. Какой объем будет занимать водород при условиях проведения реакции (800 0C; 101325 Па)?
107. Приведите по 2–3 примера химических реакций, в которых водород является окислителем и восстановителем. Какова функция водорода при получении гидридов? Какое количество, объем (при н.у.) и какая масса водорода потребуются для получения гидридов натрия и кальция из одного кг каждого металла?
108. Опишите взаимодействие водорода с кислородом: механизм реакции, влияние катализаторов и т.д. Какая смесь водорода с кислородом называется «гремучим» газом? Определите парциальные давления H2 и O2 в гремучем газе и его относительную плотность по водороду и воздуху.
109. Какая смесь водорода с воздухом является наиболее взрывоопасной? Какая реакция протекает при взрыве этой смеси и каков ее механизм? Вычислите состав этой смеси в объемных процентах, считая, что воздух состоит из азота
110. При каких условиях водород взаимодействует с галогенами, серой, азотом? Вычислите энтальпию, энергию Гиббса и константу равновесия реакции водорода с йодом при 500 ºC.
111. Какие соединения водорода называют гидридами, по каким признакам они подразделяются на ионные, ковалентные и металлические? Напишите уравнения реакций:
112. Объясните, как и почему изменяются свойства гидридов, образованных элементами одного периода, например в ряду: NaH - MgH2 - AlH3 - SiH4 - PH3 - H2S - HCl. Приведите уравнения реакций, иллюстрирующие изменение свойств гидридов.
113. Важнейшим соединением водорода является вода. Опишите химическую связь в молекуле H2O и её строение, химические свойства воды (основно-кислотные, окислительно-восстановительные, каталитические, как растворителя и т.д.). Напишите продукты реакций, укажите условия их проведения:
114. Водород входит в состав гидроксидов – оснований, кислот и амфолитов. Приведите их примеры, напишите схемы их электролитической диссоциации.
115. Водород входит с состав гидро– и гидроксосолей. Приведите примеры таких солей и напишите схемы их электролитической диссоциации. Вычислите массовую долю водорода в гидрокарбонате натрия и в сульфате гидроксожелеза (II).
116. Водород хорошо растворяется в некоторых металлах. Например, в одном объёме палладия при н. у. растворяется 800 объемов водорода. Вычислите растворимость водорода в палладии в граммах на 100 г металла.
117. Напишите уравнения реакций, продуктом которых является водород:
Какие из этих реакций используются для получения водорода в промышленности, а какие – в лабораториях?
118. Сколько электричества (в ампер-часах) необходимо затратить на получение одного м3 водорода при электролизе воды, если выход по току равен 92,5 %? Какой объем кислорода выделяется при этом?
119. Какой объем водорода, приведенный к н.у., можно получить из одного м3 метана при его каталитическом взаимодействии с водяным паром? Какой объем водорода можно получить дополнительно, если проводить конверсию оксида углерода (II), образующего в этой реакции?
120. Какой объем водорода (приведенный к н.у.) выделится при взаимодействии цинка массой 163,5 г с одним литром 30%-й HCl (r = 1,15)? 121. Какой объем водорода (приведенный к н.у.) выделится при взаимодействии одного килограмма гидрида кальция с водой?
122. Какой объем водорода (н.у.) получен при взаимодействии водяного пара с железными стружками, если масса железа увеличилась на 8,0 кг?
123. Взаимодействие водяного пара с раскаленным углем – перспективный метод получения водорода: C + H2O D CO + H2. Вычислите, при какой температуре в этом процессе возможно протекание прямой реакции.
124. Водород в больших количествах используется в производстве аммиака и метанола. Напишите уравнения реакций и вычислите объем водорода (н.у.), теоретически необходимый для получения одной тонны аммиака и одной тонны метанола.
125. Чему равна теплотворная способность водорода как топлива? Почему дальнейший технический прогресс связывается с переходом на водородную энергетику?
126. Какая температура возникает при горении водорода в кислороде и где используется эта высокая температура?
127. Что представляют собой и в каких целях используются водородный электрод и водородно-кислородный топливный элемент?
128. Какое отношение к водороду имеет водородный показатель (pH)? Что характеризует этот показатель и как он определяется? Вычислите рН децимолярных растворов соляной и уксусной кислот, гидроксидов калия и аммония.
129. В современных отраслях техники применяются изотопы водорода дейтерий и тритий. Чем они отличаются от обычного водорода и каково их применение?
130. Какие ядерные реакции с участием изотопов водорода являются источником солнечной энергии и света звезд? ФТОР И ЕГО СОЕДИНЕНИЯ
131. Почему фтор находится в седьмой группе Периодической системы? Почему он во всех соединениях одновалентен и имеет степень окисления -1? Напишите формулы следующих соединений: фтороводород, фторид кремния, гидрофторид калия, гексафтороплатинат (IV) аммония.
132. Объясните химическую связь в молекуле F2 методами валентных связей и молекулярных орбиталей. Имеется ли в этой молекуле дополнительное донорно-акцепторное взаимодействие между атомами, укрепляющее основную связь? Чему равна энергия связи в молекуле фтора? Увеличивается или уменьшается энергия связи в процессе: F2 - e = F2+?
133. Чем объясняется высочайшая реакционная активность фтора и максимальное значение (2,87 В) окислительно-восстановительного потенциала полуреакции: F2 + 2e = 2F-?
134. Напишите уравнения реакций фтора с кальцием, железом и золотом. Почему фтор до 300 ºС не взаимодействует с медью и до 600 ºC – с никелем, хотя с менее активными металлами, например с золотом, он взаимодействует при обычных условиях?
135. Опишите взаимодействие фтора с неметаллами: водородом, серой, фосфором и кремнием. Определите массу серы, которая взаимодействует с 112 л фтора (н.у.) и объем образующегося газообразного гексафторида серы. С какими неметаллами фтор не взаимодействует при любых условиях?
136. Показателем высочайшей химической активности фтора является его взаимодействие с благородными газами: криптоном, ксеноном и радоном. При каких условиях фтор взаимодействует с ксеноном и какие продукты при этом образуются? Напишите уравнения реакций.
137. Показателем высокой химической активности фтора является его взаимодействие с другими галогенами. Напишите уравнения всех возможных реакций фтора с хлором и йодом. Используя теорию гибридизации и метод отталкивания электронных пар валентной оболочки (ОЭПВО), опишите образование молекул ClF5, имеющих форму пирамиды.
138. При каких условиях фтор взаимодействует с кислородом и какие продукты при этом образуются? Напишите уравнения реакций.
139. Показателем высочайшей активности фтора является его взаимодействие с таким инертным веществом как диоксид кремния: аморфный SiO2 в атмосфере фтора самовоспламеняется. Напишите уравнение реакции и проведите расчет её стандартных термодинамических параметров.
140. При взаимодействии фтора с водой образуется фтороводород, а также OF2 (при взаимодействии со льдом), O3 (при взаимодействии с жидкой водой) и O2 (при взаимодействии с водяным паром). Напишите уравнения соответствующих реакций. Для реакции фтора с водяным паром вычислить энтальпию, энтропию и энергию Гиббса при 200 ºC.
141. В каком виде фтор находится в природе и как его получают в молекулярном виде? Почему невозможно получить фтор из его соединений химическим путем? Какое количество электричества расходуется на получение одного м3 фтора электролизом расплава KHF2, если выход по току равен 90 %? Напишите схемы электродных процессов и общее уравнение электролиза. Почему невозможно получить фтор электролизом раствора KHF2?
142. Фтороводород получают из флюорита, содержащего 92 % CaF2. При этом используется 96%-я серная кислота (r = 1,96), которую берут в 40%-м избытке. Выход реакции составляет 95 %. Вычислите объем HF (н.у.), получаемого из
143. Фтороводород, в отличие от HCl, характеризуется необычно высокой теплотой испарения (32,6 кДж/моль) и неограниченной растворимостью в воде. Чем объясняются эти особенности фтороводорода?
144. Как объяснить тот факт, что одноосновная фтороводородная кислота образует ионы HF
145. Напишите схему диссоциации фтороводородной кислоты в водном растворе и вычислите водородный показатель ее децимолярного раствора. Почему эта кислота, в отличие от соляной, бромоводородной и йодоводородной, является слабой?
146. Напишите уравнения реакций фтороводородной кислоты с цинком, гидроксидом алюминия, раствором KOH и газообразным аммиаком. Какой объем 20%-й HF(r = 1,07) расходуется на взаимодействие с одним молем аммиака, какая масса гидрофторида аммония при этом образуется?
147. Фтороводородную кислоту отличает от остальных кислот её способность взаимодействовать с диоксидом кремния и кремнийсодержащими минералами и «разъедать» стекло. Напишите уравнения двух стадий взаимодействия фтороводородной кислоты с SiO2. Какую функцию выполняет эта кислота на первой и второй стадии взаимодействия?
148. Смесь фтороводородной и азотной кислот взаимодействует с металлами (W, Nb, Ta) и неметаллами (B, Si), которые устойчивы даже в царской водке.
149. Фториды каких металлов растворяются в воде, а каких относятся к малорастворимым веществам? Наблюдается ли гидролиз растворимых фторидов? Вычислите константу гидролиза фторида калия, степень его гидролиза в 0,1 М растворе и pH этого раствора.
150. Какие фториды растворяются в воде, а какие относятся к малорастворимым веществам? Определите растворимость фторида кальция, произведение растворимости которого равно 4,0∙10–11. Ответ выразите молярной концентрацией насыщенного раствора и в граммах на 100 г воды.
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 968; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.154.171 (0.094 с.) |
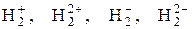 .
. и кислые соли? Можно ли утверждать, что существует молекула H2F2? Какое строение имеет эта «молекула», каков механизм образования химических связей в ней и чему равны характеристики связей (длина, энергия, валентные углы)?
и кислые соли? Можно ли утверждать, что существует молекула H2F2? Какое строение имеет эта «молекула», каков механизм образования химических связей в ней и чему равны характеристики связей (длина, энергия, валентные углы)?


