
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Эквивалент кислоты и основания в реакциях нейтрализации
Реакция нейтрализации заключается в связывании гидроксильных ионов катионами гидроксония (водорода):
1 моль катионов водорода а)
б) так как катион
в)
Пример 6. На нейтрализацию 1 г кислоты израсходовано 0,313 г Решение: По закону эквивалентов
Задачи для самостоятельного решения 11. В оксиде кальция массой 0,7 г на долю кальция приходится 0,5 г. Чему равна молярная масса эквивалента металла? 12. Мышьяк образует два оксида, из которых один содержит 65,2% (по массе) 13. В оксиде свинца содержится 7,81 % кислорода по массе. Найти молярную массу эквивалента металла. 14. Массовая доля алюминия в его хлориде 20,2 %. Чему равна молярная масса эквивалента металла? 15. В двух оксидах серы массовые доли серы 40 и 50 % соответственно. Найти 16. В бромиде металла массовая доля брома 89,88 %. Найти металл. 17. В сульфиде металла массовая доля серы 29,48 %. Найти металл. 18. Сульфид исследуемого элемента содержит 28,84% серы. Водородное соединение этого элемента представляет собой газ, плотность которого при н. у. 3,614 г/л. Установите химический элемент.
В заданиях 19 - 25 найти
26*. Напишите формулы трех гидридов, содержащих 12,5 % по массе водорода. 27.* Обсудите правильность утверждения: «молярная масса эквивалента кислоты равна отношению молярной массы кислоты к числу атомов водорода в молекуле кислоты». 28.* Чему равна молярная масса эквивалента ортофосфорной кислоты в реакциях с гидроксидом натрия, которые приводят к образованию дигидрофосфата, гидрофосфата и фосфата натрия? //☺ Молярная масса эквивалента металла может быть найдена на основе реакции замещения, когда более активный металл вытесняет менее активный из растворов его солей. В этом случае необходимо учитывать положение металла в электрохимическом ряду напряжений.//
29. Найдите молярную массу эквивалента двух металлов, если при массе навесок по 1,000 г каждая один из них вытесняет из солей кобальт массой 0,9014, а другой – медь массой 2,264 г. 30. В раствор, содержащий 2,24 г металла в виде сульфата, погрузили цинковую пластинку. После полного выделения металла на пластинке ее масса увеличилась на 0,94 г. Рассчитайте молярную массу эквивалента металла 40. Какая масса цинка потребуется для вытеснения меди из раствора, содержащего медный купорос, количество вещества эквивалента которого равно 0,1 моль. 41. 0,0873 г металла вытеснили из раствора кислоты 35 мл 42. 1,96 г металла вытеснили из раствора кислоты 0,672 л 43. 1 г двухвалентного металла вытеснил из раствора кислоты 0,921 л 44. При 20°С и 101100 Па 1,2 г металла вытеснили из раствора кислоты 442 мл 45. При 18°С и 101325 Па 1,37 г двухвалентного металла вытеснили из раствора кислоты 0,5 л 46. Рассчитать атомную массу трехвалентного металла, если 3,36×10-3 кг его вытесняют из раствора щелочи 2,244 л 47. 0,350 г металла вытеснили из кислоты 230 мл
В задачах 48 – 54 найти
48. Из 1 г оксида получено 3 г сульфата. 49. Из 5,7 г сульфата получено 2,6 г гидроксида. 50. Из 1,00 г карбоната получено 1,71 г нитрата. 51. Из 1,4 г гидроксида получено 4,15 г иодида. 52. Из 5,21 г сульфата получено 3,61 г гидроксида. 53. Из 2 г гидроксида получено 3,74 г сульфата. 54. Из 8,4 г гидрокарбоната получено 5.3 г карбоната. 55. Вычислите молярную массу эквивалента карбоната калия в двух реакциях ионного обмена с йодоводородной кислотой, если в результате реакций образуются: а) гидрокарбонат калия, б) карбонат калия. 56. При взаимодействии 0,2408 г металла с горячей концентрированной азотной кислотой получилось 0,3663 г нитрата, из которого после разложения выделилось 0,2594 г оксида металла. Найдите молярную массу эквивалента металла. 57. Для нейтрализации щавелевой кислоты гидроксидом калия на 1,24г кислоты потребовался 1 г
58. На нейтрализацию 2 г основания израсходовано 3,04 г соляной кислоты. 59. 1,96 г металла вытеснили из раствора кислоты 0,672 л 60. 1 г двухвалентного металла вытеснил из раствора кислоты 0,921 л 61. При 20°С и 101100 Па 1,2 г металла вытеснили из раствора кислоты 442 мл 62. При 18°С и 101325 Па 1,37 г двухвалентного металла вытеснили из раствора кислоты 0,5 л 63. Рассчитать атомную массу трехвалентного металла, если 3,36×10-3 кг его вытесняют из раствора щелочи 2,244 л 64. 0,350 г металла вытеснили из кислоты 230 мл 65. *. Образец сплава двух легких металлов массой 1,05 г обработали хлоридной кислотой; выделилось 1337,6 мл водорода, измеренного при температуре 27,3 оС и давлении 770 мм рт. ст. Образец такой же массы частично растворился в концентрированном растворе гидроксида натрия, причем выделилось 1,080 л водорода при температуре 18оС и давлении 756 мм рт. ст. Какие металлы находились в сплаве? 66*. При взаимодействии 0,26 г исследуемого двухвалентного металла на воду было получено 162,8 мл водорода, измеренного при температуре 25 оС и давлении 713,2 мм рт. ст. Известно, что это металл растворяется в жидком аммиаке, соединяется с кислородом, азотом, водородом и другими веществами. Назовите этот металл.
Контрольный тест
1. Укажите значение фактора эквивалентности для: а) серы в водородном соединении; б) фосфора в высшем оксиде; в) магния в хлориде; г) натрия в гидриде; д) углерода в ацетилене.
2. Укажите эквивалентное число катиона и аниона в солях: а) сульфид натрия; б) бромид алюминия; в) нитрат кальция; г) сульфат аммония; *д) гидрокарбонат кальция.
3. Рассчитайте фактор эквивалентности для солей в реакциях ионного обмена: а) ортофосфат калия; *б) дигидрофосфат кальция; в) сульфат железа (III); г) хлорид магния; д) сульфат бария.
4. Изобразите структурную формулу и вычислите молярную массу эквивалента химического элемента в простом веществе: а) кислород б) азот *в) белый фосфор Р4; г) сера ромбическая *д) алмаз
5. Какая формула правильно отражает закон эквивалентов: а) 6. Чему равно эквивалентное число серы в соединениях:
7. Чему равен фактор эквивалентности веществ в их водородных соединениях для следующих неметаллов:
8. Чему равен фактор эквивалентности элементов в реакциях полной нейтрализации для:
9. Укажите фактор эквивалентности солей в реакциях ионного обмена:
10. Укажите фактор эквивалентности
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 898; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.169.94 (0.03 с.) |

 =
=  или упрощенно:
или упрощенно:
 =
= 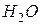
 эквивалентен 1моль анионов гидроксила
эквивалентен 1моль анионов гидроксила  .
.
 .
.
 замещает только один катион водорода
замещает только один катион водорода ,
, ;
;  г/моль.
г/моль.
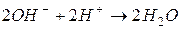
 ,
, 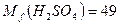 г/моль.
г/моль. . Вычислить эквивалент кислоты.
. Вычислить эквивалент кислоты.
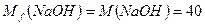 г/моль, тогда
г/моль, тогда г/моль.
г/моль. , а другой 75,7%
, а другой 75,7%  в обоих оксидах.
в обоих оксидах. по результатам электролиза. По возможности установить металл.
по результатам электролиза. По возможности установить металл. , А
, А

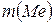 , г
, г
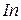
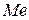
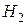 (н.у.). Найти металл.
(н.у.). Найти металл.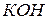 .
. 

 ;
; ;
; ;
;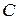 .
. ; б)
; б)  .
.
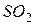
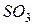







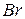

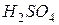

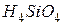

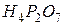
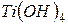



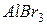
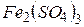



 фосфорной кислоты в реакциях нейтрализации:
фосфорной кислоты в реакциях нейтрализации:





