Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кафедра технологии и оборудования производства жиров и эфирных маселСтр 1 из 14Следующая ⇒
ЮЖНЫЙ ФИЛИАЛ НАЦИОНАЛЬНОГО УНИВЕРСИТЕТА БИОРЕСУРСОВ И ПРИРОДОПОЛЬЗОВАНИЯ УКРАИНЫ «КРЫМСКИЙ АГРОТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ» Технологический факультет Кафедра технологии и оборудования производства жиров и эфирных масел Часть 1 Методические указания и комплекс заданий к организации самостоятельной работы по дисциплине «Общая и неорганическая химия» по темам: · 1. Газовые законы. Газовые смеси · 2. Моль. Эквивалент · 3. Основные классы неорганических соединений · 4. Тепловые эффекты химических реакций, химическая термодинамика · 5. Основы химической кинетики · 6. Химическое равновесие · 7. Ионное произведение воды · 8. Произведение растворимости для студентов 1 курса специальностей: «Технология бродильных производств и виноделия», «Технология жиров и жирозаменителей», «Технология хранения, консервирования и переработки молока» 7 091 700
Симферополь 2011 Методические указания разработаны к.т.н., доцентом кафедры технологии и оборудования производства жиров и эфирных масел Ножко Е.С. и учителем – методистом Керченской общеобразовательной школы № 26 Сугатовым А. П. Издание 2-е исправленное и дополненное
Методические указания рассмотрены и одобрены на заседании кафедры технологии и оборудования производства жиров и эфирных масел, протокол № __ от ________2010 г.
Методические указания рассмотрены и рекомендованы к использованию в учебном процессе методической комиссией технологического факультета, протокол № ____ от _________2011 г.
Рецензент: доцент кафедры общей и агрономической химии, к.т.н. Т.Г. Пономарева
Ответственный за выпуск: заведующий кафедрой технологии и оборудования производства жиров и эфирных масел д.т.н., профессор Шляпников В.А. Введение Самостоятельная проработка заданного объема теоретического материала должна сопровождаться обязательными практическими заданиями. Это могут быть типовые задачи минимального уровня, упражнения для приобретения конкретных навыков в написании уравнений реакций разных типов, набор вопросов и т. д. Такие, традиционно используемые приемы, не всегда достигают желаемого эффекта. При переходе к тестированному контролю знаний задания для самоподготовки должны быть максимально адаптированы к предъявляемым требованиям. В связи с этим определенный интерес представляют обучающие тестовые задания. Чем они отличаются от обычных тестов и какова их структура?
Во-первых, дается краткий фрагмент учебного материала, который необходимо усвоить. Это может быть развернутое определение, выдержка из учебника, схема и пр. Во- вторых составляется ряд вопросов, ответом на которые и является данное определение. В-третьих, формируются усложненные задания, предполагающие сравнительную характеристику данного понятия со сходными или противоположными понятиями. В результате поиска верного ответа достигается желаемая цель: качественное усвоение учебного материала. Подобные обучающие тесты можно использовать при дистанционном обучении. Они же могут составить основу итоговых контрольных заданий. В использовании тестового контроля знаний привлекает объективность, простота и формальность процедуры проверки знаний. Однако для этого надо пройти сложный и увлекательный путь составления тестовых заданий. Залогом успешного внедрения тестирования является, прежде всего, достаточно большой объем заданий разной степени сложности, который позволяет формировать тесты. Хотя методика составления тестов подробно описана в учебно-методической литературе, каждый раз подготовка тестовых заданий является творческим актом. В нем проявляется индивидуальность педагога, его собственное видение предмета, логичность в последовательности вопросов. При этом важным моментом является равноценность заданий при вариативном подходе. В предлагаемом методическом руководстве даны разнообразные вариативные задания разной степени сложности, позволяющие максимально оптимизировать учебный процесс. Теоретический материал представлен в виде опорных конспектов.
Озонированный кислород В химической практике для усиления окислительной способности вместо воздуха или чистого кислорода используется частично озонированный кислород. Для этого поток кислорода пропускают через озонатор. При этом до 20 -25% кислорода превращается в озон по реакции:
3 О2 ↔ 2 О3 (1.21) Объем озонированного кислорода, согласно уравнению 5.1, должен быть меньше, чем объем чистого кислорода. Пример 9. При прохождении через озонатор 10 л кислорода 9% его превратились в озон. Вычислите объем озонированного кислорода. Решение: Согласно уравнению 5.1 из 10 л кислорода в озон превратилось 10 ּ0,09 =0,9 л кислорода, а озона образовалось 0,9 2/3 = 0,6 л. В смеси осталось 10 – 0,9 = 9,1 л кислорода. Суммарный объем полученной смеси газов составил 0,6 + 9,1 = 9,7 л. Задачи для самостоятельного решения 29. (Обратная задача). Какой объем занимает кислород после разложения 600 мл озонированного кислорода, содержащего 30% озона? 30. Смесь озона и кислорода имеет плотность по водороду 18. Определите объемные доли газов в смеси. 31. Какой объем озонированного кислорода, содержащего 24% озона по объему, потребуется для сжигания 11,2 водорода? 32. Для полного сжигания 2 л этана используется 6,23 л озонированного кислорода. Найдите массовую долю озона в газовой смеси. 33. Если кислород, содержащийся в воздухе (объемная доля 24%) полностью перейдет в озон, чему будет равна плотность полученной газовой смеси относительно обычного воздуха?
Контрольный тест
1. Укажите значение фактора эквивалентности для: а) серы в водородном соединении; б) фосфора в высшем оксиде; в) магния в хлориде; г) натрия в гидриде; д) углерода в ацетилене.
2. Укажите эквивалентное число катиона и аниона в солях: а) сульфид натрия; б) бромид алюминия; в) нитрат кальция; г) сульфат аммония; *д) гидрокарбонат кальция.
3. Рассчитайте фактор эквивалентности для солей в реакциях ионного обмена: а) ортофосфат калия; *б) дигидрофосфат кальция; в) сульфат железа (III); г) хлорид магния; д) сульфат бария.
4. Изобразите структурную формулу и вычислите молярную массу эквивалента химического элемента в простом веществе: а) кислород б) азот *в) белый фосфор Р4; г) сера ромбическая *д) алмаз
5. Какая формула правильно отражает закон эквивалентов: а) 6. Чему равно эквивалентное число серы в соединениях:
7. Чему равен фактор эквивалентности веществ в их водородных соединениях для следующих неметаллов:
8. Чему равен фактор эквивалентности элементов в реакциях полной нейтрализации для:
9. Укажите фактор эквивалентности солей в реакциях ионного обмена:
10. Укажите фактор эквивалентности
Оксиды 1. Какие соединения называют оксидами? Дайте несколько вариантов определения оксидов. 2. Какие из перечисленных соединений оксиды: CO2, BaO2, N2O3, CrO3, SO3, N2O4, КО3, Cl2O, H2O2? 3. Назовите оксиды, используя метод Штока и метод численных приставок, зная, что в оксидах электроотрицательной составляющей является кислород: P2O5, SO2, ZnO, Cr2O3, MoO3, Re2O7, N2O. 4. Можно ли по положению элемента в периодической таблице предсказать химическую природу его оксидов? Как именно? 5. Как изменяются кислотно-основные свойства оксидов переходных металлов в зависимости от степени окисления металла? 6. Перечислите основные способы получения оксидов. Приведите примеры, укажите условия осуществления реакций.
7. Допишите схемы реакций: N2O5 + H2O = Li2O + SiO2 = Fe2O3 + HClO4 = Cl2O + H2O = Mn2O7+ BaO = Al2O3 + NaOH = CrO3 + H2O = ZnO + Na2O = Li2O + H2O = Fe3O4 + H2SO4 = NO2 + H2O = Cl2O + Ca(OH)2 =
Основания 1. Дайте определение основаниям. На какие группы делятся основания в зависимости от свойств? 2. Перечислите химические свойства оснований. Ответ подтвердите уравнениями химических реакций. 3. Какие методы получения оснований вам известны? Приведите примеры. 4. Допишите схемы реакций: NaOH + Cl2O7 = La(OH)3 + CH3COOH = Fe(OH)2 + P2O5 = NH3 H2O + MnSO4 = KOH + ZnO = NaOH + Cr(OH)3 = 5. С какими из перечисленных веществ может реагировать едкий натр: Fe, Zn, Cl2, KHCO3, CrO3, BaO, CaCO3? Составьте уравнения реакций. 6. *) Можно ли получить гидроксид (основание, амфотерный гидроксид), действуя на соль кислотой? 7. *) Допишите схемы реакций: NaOH + Fe(OH)3 →(to) Na[Al(OH)4] + CO2 = Sn(OH)2 + KOH(избыток) = Be(OH)2 + J2O5 = BaO + Cr(OH)3 = K2[Zn(OH)4] + HNO3 =
Кислоты 1. Дайте определение кислотам. Как классифицируют кислоты? Какова их номенклатура? Назовите кислоты: H3PO3, HBO2, HClO2, H3AsO4, HAuCl4, H2Cr2O12. 2. Чем определяется заряд кислотного остатка? Укажите заряды кислотных остатков, которые входят в состав кислот (задание 1). 3. Насколько правильно утверждение, что основность кислоты определяется количеством атомов водорода в её молекуле? Укажите основность следующих кислот: HNO3, H3PO3, H3PO4, H2S, CH3COOH. 4. В каких кислотах (Смотри предыдущее задание) не все атомы водорода способны замещаться на металл? 5. Какие из реакций возможны и почему? Cu + H2SO4 (разб.) = Fe + CH3COOH = Ag + HNO3(разб.) = Zn + H3PO4(избыток) = Mg + HNO3(конц.) = Fe + HCl = 6. Какие кислотные оксиды соответствуют кислотам: HClO4, HClO, H3BO3, H2B4O7, H4P2O7, H2MnO4, H3V3O9, H6TeO6? 7. * Всегда ли возможно проведение реакции нейтрализации в водном растворе?
Соли 1. Дайте определение солям. Как классифицируют соли в зависимости от полноты замещения атомов водорода в кислотах или гидроксогрупп в основаниях? 2. Каковы правила номенклатуры солей? 3. Составьте формулы следующих солей: сульфат купрума(П), нитрат аммония, бромид алюминия, карбонат натрия, ортофосфат магния, хлорид феррума(Ш), гидроксохлорид кальция, гидрофосфат кальция, дигидрофосфат кальция, гидрокарбонат купрума(П), дихромат калия, перманганат калия. 4. Какие условия необходимо выполнить, чтобы осуществить реакцию между солью и основанием? 5. Получите всеми возможными способами: хлорид калия, сульфат купрума(П), карбонат плюмбума(П), дигидрофосфат аммония, гидроксохлорид магния.
6. Осуществите превращения: а) Al→ Na[Al(OH)4] → Al(OH)3→Al(OH)SO4→Al2(SO4)3→AlCl3 б) Zn→ Zn(NO3)2→ ZnO→ ZnCl2→ ZnSO4→ ZnCO3 в) S→ SO2→ SO3→ H2SO4→ NaHSO4→ Na2SO4→ NaCl
2. Задания для подготовки к модульной контрольной работе Оксиды Даны кислородсодержащие бинарные соединения: 1.Li2O, 2. Al2O3, 3. CaO, 4. BaO2, 5. KO3, 6. SO3, 7. FeO, 8. Cr2O3, 9. MnO2,10.Mn2O7, 11. MnO, 12. CO, 13. N2O, 14. N2O5, 15. Pb3O4, 16.NO2, 17. CoO, 18.ZnO, 19. P2O5, 20. Cl2O 1. Рассчитайте степени окисления элементов, связанных с кислородом. Какие из бинарных соединений не являются оксидами? 2. Укажите характер оксида (основный, кислотный, амфотерный). Запишите рядом с формулой оксида формулу соответствующего ему гидроксида (основания, кислоты или амфотерного гидроксида). Какие из перечисленных оксидов не являются кислотообразующими? 3. Как изменяется характер свойств оксидов d-металлов в зависимости от степени окисления металла? Поясните на примере соединений 9,10,11. 4. Вещества 3,18,19 – порошки белого цвета. Как различить эти вещества при помощи химических реакций? 5. К какому классу соединений относится продукт реакции сплавления 2 и 17 – тенарова синь? Напишите уравнение реакции. 6. Как взаимодействуют с раствором едкого кали 14 и 16. В чем различие этих реакций? 7. Как взаимодействует 15 с раствором соляной кислоты? 8. Запишите не менее пяти реакций попарного взаимодействия оксидов из предложенного списка.
Кислоты Даны кислоты: 1. H2SO4, 2. H4SiO4, 3. H3PO3, 4. H2Cr2O7, 5. HClO4, 6. CH3COOH, 7. HPO3, 8. H2B4O7, 9. H4P2O7, 10. HNO3, 11. H3PO4, 12. HClO, 13. HCl, 14. H4V2O7, 15. HAuCl4 1. Рассчитайте степени окисления кислотообразующих элементов и запишите формулы соответствующих им оксидов. 2. Назовите кислоты двумя способами. 3. Запишите уравнения реакций полной диссоциации кислот в водном растворе и укажите основность кислот. За счет чего кислоты изменяют окраску индикатора? 4. Изобразите структурные формулы кислот 1, 2, 3, 11. 5. Расположите кислоты 1, 2, 5, 11 в порядке увеличения активности. Чем обусловлена сила кислот? 6. Как связана молярная масса эквивалента кислот с их основностью? Рассчитайте двумя способами Мэ кислот 9 и 12. 7. С какими из перечисленных веществ взаимодействует кислота 13: CaO, N2O3, AgNO3, CuSO4, FeS, (CuOH)2CO3, Cr(OH)3, Cu, Zn, K3[Cr(OH)6]? Запишите уравнения реакций. 8. Чем отличаются состав и структурные формулы кислот 7, 9, 11? При каких условиях происходят их взаимопревращения? Химические реакции протекают самопроизвольно в направлении достижения равновесия. При этом состояние равновесия определяется одновременно двумя факторами – минимальной энергией и максимальной беспорядочностью движения. В равновесных условиях скорость прямой реакции равна скорости обратной реакции. Для реакции aA + bB ↔ cC + dD Константа равновесия химической реакции, выраженная через молярные концентрации исходных и конечных веществ, является математическим выражением закона действия масс Гульдберга и Вааге:
При КС>>1 реакция идет глубоко, при КС<<1 выход ничтожно мал. Для реакций, протекающих в газовой фазе, константа равновесия записывается через парциальные давления реагирующих веществ Кр. Обе константы связаны между собой уравнением:
Кр = Кс(RT)Δn, где Δn = (с + d) – (a + b) – разность между числом молей газообразных продуктов реакции и числом молей газообразных исходных веществ. При Δn =1 Кс = Кр/ RT. Пример 1. Для реакции 2СО2 ↔ 2СО + О2 при 2000оС состав равновесной смеси в объемных долях (φ%) составил: 85,2 СО2, 9,9 СО, 4,9 О2, а общее давление в системе P = 1, 13×105 Па. Найти Кс и КР. Решение: Найдем парциальные давления газов в смеси: pi = P×φi Р(СО2) = 1,013 105×0,852 = 0,863 ×105 Па Р(СО) = 1,013 105×0,099 = 1,100 ×105 Па Р(О2) = 1,013 105 ×0,049 = 0,050 ×105 Па Найдем выражение для константы скорости через парциальные давления:
Δn = 3 -2 =1, следовательно, Кс = Константу равновесия можно выразить через мольные (молярные) доли веществ в реакционной смеси Кχ. Она связана с константой, выраженной через парциальные давления соотношением: Кχ = Кр –Δn. Пример 2. Выведите соотношение между константами равновесия Кс и Кр, а затем Кр и Кχ для реакции 3Н2(г.) + N2(г.) ↔ 2NH 3(г.). Решение: Константа равновесия, выраженная через равновесные концентрации веществ, участвующих в реакции, [газ] = Константа равновесия, выраженная через мольные доли веществ в реакционной смеси где
Парциальное давление можно выразить через мольную долю вещества и общее давление смеси Р: р(NH 3) = χ(NH 3) × Р, р(Н2) = χ(Н2) × Р, р(N2) = χ(N2) × Р, причем Р = р(NH 3) + р(Н2) + р(N2).
Упражнение. Запишите выражение, связывающее константу Кр и степень диссоциации водяного пара α для реакции: 2Н2О(г.) ↔ 2Н2(г.) + О2(г.) при Р = const.
Решение расчетных задач Типовые расчетные задачи по теме «Химическое равновесие» наиболее удобно решать табличным способом, разбивая процесс на три этапа: 1 - начало реакции, 2 - изменение концентрации реагирующих веществ и продуктов реакции в ходе реакции, 3 – наступление равновесия. Общая постановка задачи: Дано уравнение равновесной реакции. Заданы начальные концентрации реагентов и условие наступления равновесия. Найти равновесные концентрации всех веществ в системе. Уровень (простейшие) 1. В состоянии равновесия в системе N2 + 3H2 ↔ 2NH3 равновесные концентрации составили, моль/л: [N2] = 3; [H2] = 9; [NH3] = 4. Найти исходные концентрации водорода и азота. 2. Вычислите начальные концентрации хлора и оксида углерода(П) в реакции СО + Сl2 ↔ СОСl2, если равновесные концентрации составили, моль/л: [Cl2] = 0,5; [CO] = 0,3; [COCl2] =1,2. 3. Равновесные концентрации реакции 2SO2 + O2 ↔ 2SO3 составили, моль/л: [SO2] = 0,0002; [O2] = 0,004; [SO3] = 0,003. Найти исходные концентрации кислорода и оксида серы(П). 4. Вычислите равновесные концентрации веществ в реакции H2 + I2↔ 2НI, если начальные концентрации, моль/л: [H2] = 1,2; [I2] = 0,8 и известно, что в реакцию вступило 50% водорода. 5. Начальные концентрации веществ в реакции 2SO2 + O2 ↔ 2SO3 были равны, моль/л: [SO2] = 1,6; [O2] = 1,2. Найти концентрации веществ в момент, когда образовалось 0,6 моль/л SO3. 6. Равновесная смесь веществ в реакции H2 + I2↔ 2НI содержит в объемных долях (φ%): водорода – 32, йода -38, йодоводорода – 30. Найти начальные концентрации водорода и йода в этих же единицах.
Задание для расчетной контрольной работы 1. Рассчитайте равновесный выход продукта реакции 3О2(г) ↔ 2О3(г), если известны начальная масса и равновесное количество вещества О2.
2. Рассчитайте константу равновесия реакции 3А(г) + 4В(г) ↔ С(г) + 2D(г), если при постоянной температуре известны равновесные концентрации веществ (моль/л).
3. По следующим данным при постоянной температуре для реакции 2NF3(г) + 3H2(г)↔ 6 HF(г) + N2(г) определите равновесные концентрации фтороводорода и начальные концентрации (моль/л) реагентов.
4. Даны гомогенные реакции. Заданы константы равновесия и начальные концентрации, одинаковые для обоих реагентов. Определите равновесные концентрации всех веществ (моль/л).
Опорный конспект №7. Тема:«Ионное произведение воды. Водородный показатель рН» Самоионизация молекул воды или реакция диссоциации – равновесный процесс - описывается уравнением: 2 Н2О ↔ Н3О+ + ОН- (Упрощенно: Н2О ↔ Н+ + ОН-) Константа равновесия реакции диссоциации при 220С:
В 1 л воды содержится n(Н2О) =1000/18 = 55,56 моль. Это значительно больше концентраций ионов гидроксила и водорода. Константа воды или ионное произведение воды – выражение: КW = К [H2O] = [H+][OH-]; КW(220С) = 1,8×10-16 × 55,56 = 1×10-14 Следовательно, [H+] = [OH-] = 1×10-7 Водородным показателем является выражение: рН = -lg[H3O+] (Упрощенно: рН = -lg[H+]). По аналогии: рОН = -lg[OН-] Таким образом, в чистой воде (нейтральная среда) имеем соотношения: рН = рОН =7, рН + рОН = 14 100 Кислая среда 10-7 Щелочная среда 10- 14 [ H3O+],моль/л РН 1. рН разбавленных растворов сильных кислот (с < 0,05 моль/л): Разбавленные растворы сильных кислот диссоциированы нацело: НА = Н+ + А-, поэтому [H+] = С(НА) и рН = - lg С(НА) 2. рН растворов слабых кислот и оснований: Диссоциация слабых кислот – обратимый процесс: НА ↔ Н+ + А- Начальные концентрации, моль/л: С 0 0 Равновесные - С(1-α) αС αС α – степень диссоциации – отношения числа диссоциированных молекул к общему числу взятых молекул. Константа диссоциации Подставив равновесные значения, имеем:
В состоянии равновесия [H+] = [A-], откуда легко вывести соотношения: 1) 2) 3)
Задачи для самостоятельного решения 1. Установите связь между константой и степенью диссоциации слабой кислоты (выведите закон разведения Оствальда) при концентрации раствора С моль/л. 2. Во сколько раз необходимо разбавить раствор слабого электролита АВ, чтобы удвоить степень его диссоциации? 3. Как изменится рН раствора при добавлении к нему равного объема воды? 4. Во сколько раз необходимо увеличить или уменьшить концентрацию водородных ионов, чтобы рН раствора: а) увеличилась на единицу; б) уменьшилась на 2 единицы? 5. Для каких электролитов разбавление их растворов в 10 раз приводит к повышению рН на единицу? 6. Для каких электролитов разбавление их растворов в 10 раз приводит к понижению рН на единицу? 7. В раствор КОН добавлено некоторое количество хлорида аммония. Изменится ли рН раствора и как? 8. Число ионов водорода в растворе в 100 раз больше, чем ионов гидроксила. Чему равен рН раствора? 9. Покажите, что рН водного раствора слабой одноосновной кислоты НА равен: рН = ½ (рК + рСК), где рСК = -lgС(кислоты). 10.Покажите, что рН водного раствора натриевой соли слабой одноосновной кислоты НА равен: РН = 7 + ½ (рК – рС(соли)).
Если раствор содержит два иона, способные осаждаться при добавлении осадителя, то оба осадка одновременно будут выпадать только при условии, что концентрации ионов относятся между собой как произведения растворимости образующихся осадков. В противном случае в осадок выпадет только одно, наименее растворимое, вещество. (Kn+)1 / (Kn+)11 = ПР (K1mAn) / ПР (K11mAn) (4)
Пример 5. При каком соотношении концентраций ионов Sr2+ и Ва2+ их сульфаты будут осаждаться одновременно? ПР (SrSО4) = 3,6.10-7, ПР (ВаSО4) = 10-10 Решение: В соответствии с уравнением (4) (Sr2+) / (Ва2+) = ПР (SrSО4) / ПР (ВаSО4); 3,6.10-7 / 10-10 = 3600
Условие растворения осадка Вопросы для обсуждения 1.1. При каких условиях осадки -выпадают, -растворяются, находятся в равновесии с насыщенным раствором? 1.2. Как связаны между собой произведение растворимости и растворимость для бинарных трех-, четырех- и пятиионных труднорастворимых электролитов? 1.3. Как влияет на растворимость вещества введение в его насыщенный раствор одноименного иона? 1.4. В каких случаях происходит растворение осадков с образованием комплексных соединений?
Задания для контрольной работы
Приложение
Таблица 1. Давление насыщенного водяного пара при различных температурах
Таблица 2. Константы диссоциации слабых электролитов в водных растворах при 25оС
Таблица 3. Ионное произведение воды при различной температуре
Литература 1. Витинг Л. М., Резницкий Л. А. Задачи и упражнения по общей химии: учебное пособие. - М.: Изд-во МГУ, 1995. – 221с. 2. Глинка Л. М. Задачи и упражнения по общей химии. Л.: Химия, 1987. – 272 c. 3. Лидин Р. А., Аликберова Л. Ю., Логинова Г. П. Неорганическая химия в вопросах. Учебное пособие для вузов. – М.: Химия, 1991. – 256 с. 4. Любимова Н. Б. Вопросы и задачи по общей и неорганической химии. М.: Выс. шк., 1990, 351 с. 5. Недилько С. А. Попель П. П. Общая и неорганическая химия: Сборник задач. – К.: Выща школа. Головное издательство,1988. – 256 с. 6. Пузаков С. А., Попков В. А. Пособие по химии для поступающих в вузы.- М.: Высш. шк. 2001. – 575 с. 7. Хімія: завдання і тести / Амірханов В. М., Білодід О. І., Верховод М. М. та ін.; під ред. Корнілова М. Ю./ - К.: Школяр, 2000. – 512 с.
Подписано к печати: _______2011 г. Формат 1/16, объем 3,5 п/л. Заказ № …. Тираж 300 экз. Отпечатано в ЮФ «КАТУ» НУБиП Украины г. Симферополь. Исполнитель Васецкая М.С.
ЮЖНЫЙ ФИЛИАЛ НАЦИОНАЛЬНОГО УНИВЕРСИТЕТА БИОРЕСУРСОВ И ПРИРОДОПОЛЬЗОВАНИЯ УКРАИНЫ «КРЫМСКИЙ АГРОТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ» Технологический факультет Кафедра технологии и оборудования производства жиров и эфирных масел Часть 1 Методические указания и комплекс заданий к организации самостоятельной работы по дисциплине «Общая и неорганическая химия» по темам: · 1. Газовые законы. Газовые смеси · 2. Моль. Эквивалент · 3. Основные классы неорганических соединений · 4. Тепловые эффекты химических реакций, химическая термодинамика · 5. Основы химической кинетики · 6. Химическое равновесие · 7. Ионное произведение воды · 8. Произведение растворимости для студентов 1 курса специальностей: «Технология бродильных производств и виноделия», «Технология жиров и жирозаменителей», «Технология хранения, консервирования и переработки молока» 7 091 700
Симферополь 2011 Методические указания разработаны к.т.н., доцентом кафедры технологии и оборудования производства жиров и эфирных масел Ножко Е.С. и учителем – методистом Керченской общеобразовательной школы № 26 Сугатовым А. П. Издание 2-е исправленное и дополненное
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 230; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.135.63 (0.296 с.) |
 ;
; ;
; ;
;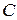 .
. ; б)
; б)  .
.
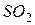
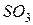







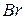

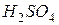

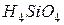


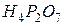
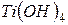



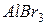
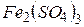



 фосфорной кислоты в реакциях нейтрализации:
фосфорной кислоты в реакциях нейтрализации:


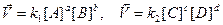 .
.
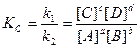
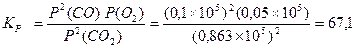
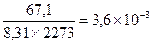 моль/м3.
моль/м3.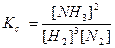 . Константа равновесия, выраженная через парциальные давления газообразных веществ,
. Константа равновесия, выраженная через парциальные давления газообразных веществ, 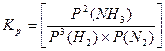 равн. Концентрацию газа можно выразить через его давление при помощи уравнения состояния идеального газа: PV = nRT. Из этого уравнения следует:
равн. Концентрацию газа можно выразить через его давление при помощи уравнения состояния идеального газа: PV = nRT. Из этого уравнения следует: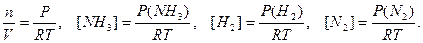
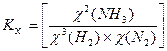 равн.,
равн.,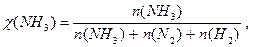
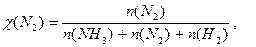
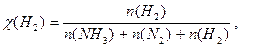
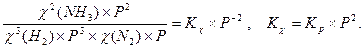

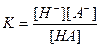
 - закон разведения Оствальда
- закон разведения Оствальда
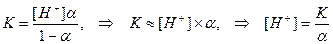 (при значениях α << 1)
(при значениях α << 1)