
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Газы, насыщенные водяными парами
Парциальные давления газов в смеси необходимо учитывать при проведении экспериментов с газами. Так, например, если газ собран над жидкостью, то при расчётах следует иметь в виду, что его давление является парциальным и равно разности общего давления газовой смеси (Р) и парциального давления пара жидкости - р(Н2О):
Согласно закону Дальтона объем сухого газа составляет:
Объемная доля сухого газа равна:
Объединив уравнения 1.16 и 1.17, получим формулу для вычисления объема сухого газа в условиях опыта:
Для приведения объема влажного газа к нормальным условиям необходимо воспользоваться объединенным газовым законом (формула 1.4):
Уравнение Менделеева – Клайперона для влажного газа будет выглядеть следующим образом:
Пример 6. В газометре над водой при температуре 25°С находятся 5,20 л кислорода под давлением 102,4 кПа. Каков объем сухого кислорода, если Решение: Объемная доля кислорода в газовой смеси пропорциональна парциальному давлению газа:
Объем сухого газа
Пример 7. Какой объем займут при н.у. 120 мл азота, собранного над водой при 20°С и 100 кПа, если Решение:
Объемная доля азота в смеси: φ = 97,7/100 = 0,997, а объем сухого азота: V(N2) = 120 × 97,7 = 117,24 мл
Пример 8. 1 л сухого газа при н. у.имеет массу 2 г. Какова масса 1 л влажного газа при этих условиях? РН2О =0,61 кПа. Решение: 1) Молярная масса газа при н. у. составит: m/V×22,4 =2/1×22,4 =44,8г/моль 2) Количество вещества воды в 1 л влажного газа: n(H2O) = φ(H2O)×V*/Vm, φ(H2O) = РН2О/Po n(H2O) = 0,61×1/101,325×22,4 = 0,27×10-3 моль 3) Изменение массы составит: Δm = m(газа) – m (H2O) = n(H2O)×(Mгаза –MH2O) Δm = 0,27×10-3(44,8 – 18) = 0,007 г 4) m(вл. газа) = 2 – 0,007 = 1,993 г Задачи для самостоятельного решения 21. Над водой при 27оС и давлении 100 кПа собрано 450 мл водорода. Найдите, какой объем будет занимать сухой водород при нормальных условиях? (Для решения задачи воспользоваться данными таблицы 1 Приложения). 22. Чему равна масса метана объемом 10 л, насыщенного водяными парами при 200С и давлении 0,986 105 Па? (Для решения задачи воспользоваться данными таблицы 1Приложения). 23. Каков объем 400 г кислорода, насыщенного водяными парами при 27оС и давлении 740 мм рт. ст.? (Для решения задачи воспользоваться данными таблицы 1 Приложения).
24. 200 м3 газовой смеси 3Н2 + 7СН4 находятся при 27оС и Р = 780 мм рт. ст. Газ насыщен водяными парами. Вычислить: а) массу газовой смеси в сухом состоянии; б) массы водорода и метана. 25. Какова масса 100 м3 СО, взятого при 20оС и Р = 720 мм рт. ст., если газ насыщен водяными парами?.? (Для решения задачи воспользоваться данными таблицы 1 Приложения). 26. Масса некоторого объема сухого СО2 при н.у. 10 г. Найти массу такого же объема газа при 25оС и давлении 110 кПа после насыщения водяными парами. Взаимодействием углекислого газа с водой пренебречь! (Для решения задачи воспользоваться данными таблицы 1 Приложения). 27. Сколько граммов воды заключается заключается в 1 м3 воздуха, насыщенного водяными парами при 28оС?.? (Для решения задачи воспользоваться данными таблицы 1 Приложения). 28. Сколько граммов сухого кислорода содержится в 1 л влажного газа при 18оС и давлении 732 мм рт. ст, если РН2О18оС = 15,48 мм рт. ст. //Подсказка: Воспользуйтесь формулой 1.20// Озонированный кислород В химической практике для усиления окислительной способности вместо воздуха или чистого кислорода используется частично озонированный кислород. Для этого поток кислорода пропускают через озонатор. При этом до 20 -25% кислорода превращается в озон по реакции: 3 О2 ↔ 2 О3 (1.21) Объем озонированного кислорода, согласно уравнению 5.1, должен быть меньше, чем объем чистого кислорода. Пример 9. При прохождении через озонатор 10 л кислорода 9% его превратились в озон. Вычислите объем озонированного кислорода. Решение: Согласно уравнению 5.1 из 10 л кислорода в озон превратилось 10 ּ0,09 =0,9 л кислорода, а озона образовалось 0,9 2/3 = 0,6 л. В смеси осталось 10 – 0,9 = 9,1 л кислорода. Суммарный объем полученной смеси газов составил 0,6 + 9,1 = 9,7 л. Задачи для самостоятельного решения 29. (Обратная задача). Какой объем занимает кислород после разложения 600 мл озонированного кислорода, содержащего 30% озона? 30. Смесь озона и кислорода имеет плотность по водороду 18. Определите объемные доли газов в смеси. 31. Какой объем озонированного кислорода, содержащего 24% озона по объему, потребуется для сжигания 11,2 водорода?
32. Для полного сжигания 2 л этана используется 6,23 л озонированного кислорода. Найдите массовую долю озона в газовой смеси. 33. Если кислород, содержащийся в воздухе (объемная доля 24%) полностью перейдет в озон, чему будет равна плотность полученной газовой смеси относительно обычного воздуха?
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 737; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.36.141 (0.01 с.) |
 (1.15)
(1.15) (1.16)
(1.16) (1.17)
(1.17)
 (1.18)
(1.18)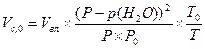 (1.19)
(1.19) (1.20)
(1.20) кПа?
кПа? ;
; кПа;
кПа;
 ;
; л.
л. кПа?
кПа? к/Па
к/Па мл.
мл.


