
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Інструкція до навчальної практики №14 -15
Дата__________________ Тема: Метод йодометрії Мета: Закріпити теоретичні знання, набути практичних умінь та навичок проведення хімічного аналізу методом йодометрії
В.В. Болотов Аналітична хімія X.: Оригінал, 2004, с Д.Д. Луцевич Аналітична хімія К.: Здоров'я, 2003, с План. 1.Приготування вихідного розчину калій діхромату СN = 0,1 моль екв/дм3. 2.Стандартизація робочого розчину натрій тіосульфату. 3. Аналіз контрольної задачі
Характеристику методу за алгоритмом. Методику проведення кількісного визначення
Провести кількісне визначення досліджуваної речовини у розчині даним методом. ЛАБОРАТОРНА РОБОТА 1.Приготування вихідного розчину – K2Cr2O7
2.Стандартизація робочого розчину Na2S2O3 за вихідним розчином K2Cr2O7 K2Cr2O7+6KI+7H2SO4= Cr2(SO4)+4K2SO4+3I2+7H2O– реакція, яка відбувається до титрування I2 +2Na2S2O3= Na2S4O6+2NaI;(блідо-зелене забарвленння) реакція, яка відбувається підчас титрування
T
3.Аналіз досліджуваної речовини: (Спосіб титрування прямий)
_____________________________________________________________________________________________________
_____________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Підпис викладача:_____________________________
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 136; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.187.233 (0.011 с.) |
 Література
Література Знати:
Знати: Уміти:
Уміти:

 ;
; 

 =0,1• 49,04•1=4,904г
=0,1• 49,04•1=4,904г





 1. 2. 3.
Зважити (q) у бюксі на: техно-хімічних терезах(1),
Зважити(q) у бюксі на аналітичних терезах(2) (mаналіт) =
Висипати (q) у вимірювальну колбу(3),
Зважити порожній бюкс на аналітичних терезах(mб.)=
q(практ) = m(аналіт) – m(б.); q(практ)=
1. 2. 3.
Зважити (q) у бюксі на: техно-хімічних терезах(1),
Зважити(q) у бюксі на аналітичних терезах(2) (mаналіт) =
Висипати (q) у вимірювальну колбу(3),
Зважити порожній бюкс на аналітичних терезах(mб.)=
q(практ) = m(аналіт) – m(б.); q(практ)=
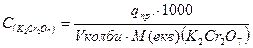 ;
;  =
=

 ;
;
 ; К=
; К=  Т=
Т=
 =0,1моль/дм3
=0,1моль/дм3
 Na2S2O3
KI
+H2SO4
К2Сr2О7
Na2S2O3
KI
+H2SO4
К2Сr2О7

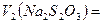

 ; Vс. =
; Vс. = ;
;
 – об’єм, який взято для титрування
– об’єм, який взято для титрування – середній об’єм, який затрачено на титрування
– середній об’єм, який затрачено на титрування ;
;  =
= ; К
; К  ) =10-15 cм3
) =10-15 cм3
 ;
V(
;
V(





 1 2 3 4
3.Зважити (q) у бюксі на: техно-хімічних терезах(1),m=______
4.Зважити(q) у бюксі на аналітичних терезах (2) mаналіт =___
5.Висипати (q) у вимірювальну колбу(3),
6.Зважити порожній бюкс на аналітичних терезах(mб.)=_____
7.q(практ) = m(аналіт) – m(б.); q(практ)=________________
8. Точний об’єм (10см3 )досліджуваного розчину помістити у колбу для титрування.
9.Протитрувати (тричі) натрій тіосульфатом у присутності розчину крохмалю до зміни забарвлення_____________
Обчислення:
1 2 3 4
3.Зважити (q) у бюксі на: техно-хімічних терезах(1),m=______
4.Зважити(q) у бюксі на аналітичних терезах (2) mаналіт =___
5.Висипати (q) у вимірювальну колбу(3),
6.Зважити порожній бюкс на аналітичних терезах(mб.)=_____
7.q(практ) = m(аналіт) – m(б.); q(практ)=________________
8. Точний об’єм (10см3 )досліджуваного розчину помістити у колбу для титрування.
9.Протитрувати (тричі) натрій тіосульфатом у присутності розчину крохмалю до зміни забарвлення_____________
Обчислення:
 ; V(досл.) (10,00 см3)
C( ) =
; V(досл.) (10,00 см3)
C( ) =
 q ( ) =
q ( ) =
 ; w()=
; w()=
 q =
2.У 100г. р-ну 5% міститься – 5 г. (досл.)
х(m)– q г.
х(m)=
3.
q =
2.У 100г. р-ну 5% міститься – 5 г. (досл.)
х(m)– q г.
х(m)=
3.  V піп.к. =
4.Наважку у (см3) х 10
V піп.к. =
4.Наважку у (см3) х 10



 V (досл) (10,00 см3)
5.Протитрувати
Обчислення:
V (досл) (10,00 см3)
5.Протитрувати
Обчислення:
 ;
C(
;
C( )=
)=
 Q (
Q ( ; w(
; w(





