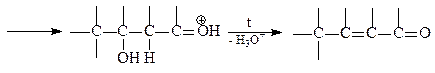Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая схема взаимодействия нуклеофила с альдегидами и кетонами. Кислотный и основной катализ. Особенности взаимодействия нуклеофила с 2,3-непредельными карбонильными соединениями.
Протонирование атома кислорода С=О группы («кислотный катализ») приводит к увеличению положительного заряда на атоме углерода и увеличению способности атома кислорода принимать электроны. Катализ осуществляют, как правило, органическими кислотами, т.к. нуклеофилы являются основаниями и с минеральными кислотами образуют соли, которые нуклеофилами не являются. Поэтому при понижении рН скорость реакции сначала повышается, а затем уменьшается. Катализ реакции основаниями («основной катализ») связан с активацией нуклеофилов (например, конденсация альдольная, Кляйзена и др.). В случае взаимодействия нуклеофила с 2,3-непредельными карбонильными соединениями реакция может идти как по 1,2- (см. выше), так и по 1,4-механизму (для кетонов в основном по 1,4-механизму):
Альдольная и кротоновая конденсации (конденсации Бородина, Кляйзена, Кновенагеля и др.). Кислотный и основной катализ. Эти реакции являются разновидностью реакции нуклеофильного присоединения по карбонильной группе альдегидов и кетонов. При этом образуется связь С-С. Карбонильные соединения, имеющие a-водородный атом, являются амфотерными соединениями (основания – за счет электронных пар кислорода С=О группы; С-Н кислоты – за счет диссоциации a-С – Н связи). Они образуют соли как с кислотами, так и основаниями. Это позволяет им даже в нейтральной среде за счет межмолекулярного взаимодействия образовывать ЕН-ОЛ ы:
В присутствии кислот и оснований равновесие смещается в сторону енола:
Енолы выступают как в роли нуклеофила (за счет повышенной электронной плотности у a-углеродного атома), так и в роли электрофила (за счет дефицита электронов у карбонильного атома углерода). Альдольная конденсация идет в слабо щелочной среде. Если реакцию вести при нагревании, альдоль отщепляет воду (кротоновая конденсация):
Кротоновая конденсация может идти и в кислой среде:
Кротоновую конденсацию между ароматическими альдегидами и кетонами и алифатическими альдегидами, кетонами, сложными эфирами и ангидридами алифатических карбоновых кислот называют конденсациями Кляйзена, Перкина и др.
|
|||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 207; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.147.215 (0.004 с.) |
 Присоединение нуклеофила по p-связи карбонильной группы объясняется способностью атома кислорода принимать электроны. Реакционная способность карбонильных соединений зависит от величины положительного заряда на атоме углерода С=О группы и пространственных препятствий. В связи с этим альдегиды реагируют с нуклеофилами значительно активнее, чем кетоны.
Присоединение нуклеофила по p-связи карбонильной группы объясняется способностью атома кислорода принимать электроны. Реакционная способность карбонильных соединений зависит от величины положительного заряда на атоме углерода С=О группы и пространственных препятствий. В связи с этим альдегиды реагируют с нуклеофилами значительно активнее, чем кетоны.