Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация, номенклатура и изомерия координационных соединений
Классификация координационных соединений. Комплексные ионы могут входить в состав молекул различных классов химических соединений: кислот, оснований, солей и др. В зависимости от заряда комплекса различают катионные, анионные и нейтральные комплексы. В катионных комплексах центральными атомами-комплексообразователем являются катионы или положительно поляризованные атомы комплексообразователя, а лигандами — анионы и нейтральные молекулы, чаще всего воды и аммиака. Комплексные соединения, в которых лигандом выступает вода, называются аква-комплексами, например [Mg(H2O)6]Cl2, [Fe(H2O)6](NO3)3. Один из наиболее многочисленных классов комплексных соединений – аммино-комплексы (аммиакаты) и аминаты, лигандами в которых являются молекулы аммиака или амина, например [Cu(NH3)4]SO4, [Pt(NH3)6]Cl4, [Cd(NH2CH2CH2NH2)3]Cl2. В анионных комплексах внутренняя сфера заряжена отрицательно, а в качестве лигандов преобладают анионы. К анионным комплексам относятся: а) комплексные кислоты (H[BF4], H2[SiF6], H[Ag(CN)2]); б) гидроксосоли К[Аl(ОН)4], Na2[Sn(OH)6]; в) полигалогениды: K[I(I)2], Cs[I(I2)]. К нейтральным комплексам относятся соединения, не имеющие внешней сферы и не дающие в водных растворах комплексных ионов: [Pt(NH3)2Cl4], [Co(NH3)3(NO2)3], [Fe(CO)5], [W(CO)6]. Некоторые комплексные соединения могут одновременно содержать как комплексный катион, так и комплексный анион, например [Pt(NH3)4][PtCl4], [Ni(NH3)6][Fe(CN)6]. Хелатные комплексы (хелаты) — устойчивые комплексы металлов с полидентатными лигандами, в которых лиганд образует с атомом-комплексообразователем один или несколько гетероциклов. Иными словами, хелаты — координационные соединения, в которых центральный атом связан одновременно с двумя или более координирующими атомами одного и того же лиганда. Лиганды, образующие хелатные циклы, называются хелатирующими (хелатообразующими) реагентами. Замыкание хелатного цикла такими лигандами называется хелатированием (хелатообразованием). Наиболее обширный и важный класс хелатов — хелатные комплексы металлов. Способность координировать лиганды присуща металлам всех степеней окисления. Хелатирующие реагенты содержат два основных типа электронодонорных центров: а) группы, содержащие подвижный протон, например —СООН, —ОН, —O3Н; при их координации к центральному иону возможно замещение протона;
б) нейтральные электронодонорные группы, например —C(O)R, —NR2. Обычно комплексы, содержащие хелатирующие лиганды, обладают повышенной устойчивостью по сравнению с комплексами, не содержащими таких лигандов. Согласно правилу циклов Чугаева наиболее устойчивые хелатные комплексы образуются в том случае, когда в состав цикла входит пять или шесть атомов. Так, в случае диаминов H2N—(СН2)n—NH2 наиболее устойчивые комплексы образуются для n = 2 (пятичленный цикл) и n = 3 (шестичленный цикл). Хелаты, в которых при замыкании хелатного цикла лиганд использует и протон-содержащую, и нейтральную группы и связан с центральным атомом ковалентной и донорно-акцепторной связью, ранее назывались внутрикомплексными соединениями. Такие соединения могут образовывать полидентатные лиганды с кислотными функциональными группами. Внутрикомплексные соединения — это хелаты, замыкание цикла в которых сопровождается вытеснением из кислотных функциональных групп одного или нескольких протонов ионом металла. В частности, внутрикомплексным соединением является глицинат меди (II):
В отдельную группу выделяют комплексы с макроциклическими лигандами. Макроциклические лиганды — это гетероциклические соединения, содержащие несколько донорных атомов, связанных мостиками таким образом, что образуется полость определенного размера. Такие лиганды образуют еще более устойчивые комплексы. Гемоглобин и хлорофилл (зеленый пигмент растений, ответственный за процесс фотосинтеза) также являются внутрикомплексными соединениями с макроциклическими лигандами (рис. 8.2). Синтетическими макроциклическими лигандами являются краун-эфиры и криптанды (рис. 8.3), которые образуют прочные комплексы даже с ионами щелочных металлов. Биологическим аналогом 18-краун-6 является валиномицин, который участвует в осуществлении активного транспорта (движение против градиента концентрации) катионов К+ в организме. Комплексы, в которых лиганды связывают два или более центральных атомов, называются биядерными и соответственно полиядерными. В качестве примера можно привести биядерные комплексы кобальта (III):
с одной мостиковой гидроксогруппой — [(NH3)5Co(μ-OH)Co(NH3)5]Cl5 и с двумя мостиковыми гидроксогруппами — [(NH3)4Co(μ-OH)2Co(NH3)4]Cl4 (рис. 4). Символ «μ» перед формулой или названием лиганда указывает на то, что данный лиганд является мостиковым
Рис. 8.2. Гем — простетическая группа гемоглобина (а) и молекула хлорофилла (б) .
Рис. 8.3. Макроциклические эфиры и криптанды: макроциклический полиэфир 18-краун-6 (а) и его комплекс с катионом К+ (б); [2,2,2]-криптанд (в); валиномицин (г)
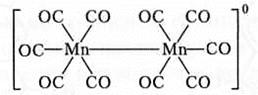
Рис. 8.4. Биядерные комплексы Со (III): а — с одной мостиковой гидроксогруппой [(NH3)5Co—ОН—Co(NH3)5]C l 5; б — с двумя мостиковыми гидроксогруппами [(NH3)4Co—(ОН)2—Co(NH3)4]C l 4 Кроме того, существуют многоядерные комплексы, содержащие непосредственно связанные между собой центральные атомы. Такие комплексы принято называть кластерами. Например, марганец образует димерный карбонил [Мn(СО)5]2. За счет непарных электронов атомов марганца образуется σ-связь Мn—Мn, соединение стабилизируется и образуется кластер [(СО)5МnМn(СО)5]:
Номенклатура координационных соединений. Согласно правилам ИЮПАК систематическое название координационного соединения может состоять из одного слова (для нейтральных комплексов) или двух слов (для катион-анионных комплексов). При этом следует придерживаться следующих правил: · формулу комплексного иона записывают в квадратных скобках, первым указывают символ центрального атома. В названии систематические или тривиальные названия анионных, катионных и нейтральных лигандов следуют в алфавитном порядке; · для нейтральных лигандов используют немодифицированные названия: пиридин C5H5N, метиламин CH3NH2, мочевина (NH2)2C(О) и т.д. Исключения: вода — аква -, аммиак — амин, СО — карбонил -, NО — нитрозил - и некоторые другие; · названия анионных лигандов образуются путем замены окончаний «-ид», «-ит» или «-ат» в названиях соответствующих анионов (хлор ид, сульф ит, оксал ат и т.п.) на окончания «-о», «-ито» или «-ато» соответственно (хлор о, сульф ито, оксал ато и т.п.); · если в состав внутренней координационной сферы входит несколько однотипных лигандов, то перед названием лиганда указывается соответствующий префикс (ди-, три-, тетра- и т.д.); · если префикс совпадает с первыми буквами названия лиганда или может создать неопределенность при слитном написании, то название лиганда заключается в скобки, а вместо префиксов ди-, три-, тетра- и т.д. используются соответственно префиксы бис-, трис-, тетракис- и т.д., например (dien)2 — бис(диэтилентриамин), (еn)3 — трис(этилендиамин); · центральный атом в катионных и молекулярных комплексах не имеет отличительного суффикса, например [Fe(CO)5] — пентакарбонилжелезо, [PtCl2(NH3)2]0 — диамминдихлороплатина. В анионных комплексах: латинский корень + суффикс «-ат»: Fe — ферр ат, Сu — купр ат, Ag — аргент ат, Аu — аур ат; · название комплексного аниона образуется из названий лигандов, русского или латинского названия центрального атома и окончания «-ат», например [Fe(CN)6]4- — гексацианоферрат(II), [Аl(Н2O)2(OН)4]- — диакватетрагидроксоалюминат (III). Приведем еще несколько примеров названий координационных соединений. [Сr(С6Н6)2] дибензолхром [PtBr2(en)] дибромо(этилендиамин)платина [Co2(CO)8] октакарбонилдикобальт
[Fe(H2O)6]SO4 гексаакважелеза(II сульфат [Ag(NH3)2]Cl диамминсеребра(I) хлорид [CoBr(NH3)5]Br2 пентаамминбромокобальта(III) бромид K4[Fe(CN)6] калия гексацианоферрат(II) (NH4)2[HgI4] аммония тетраиодомеркурат(II) Н[АuСl4] водорода тетрахлороаурат(III) [Со(еn)3]Сl3 трис(этилендиамин)кобальта(III) хлорид Na2[Ca(edta)] натрия этилендиаминтетраацетатокальциат [Cu(NH3)4]2[Fe(CN)6] тетраамминмеди(II) гексацианоферрат(II) Пространственное строение комплексных соединений. Согласно модели Кеперта, позволяющей предсказывать форму комплекса, координирующие атомы располагаются в вершинах полиэдра, в центре которого находится ион металла. Основные структурные типы основаны на: · линейном расположении — для двух донорных атомов; · тригональном плоском расположении — для трех донорных атомов; · тетраэдрическом расположении — для четырех донорных атомов; · тригонально-бипирамидальном или квадратно-пирамидальном расположении — для пяти донорных атомов; · октаэдрическом расположении — для шести донорных атомов. Исключением из этого правила являются некоторые четырехкоординированные комплексы, например [PtCl4]2- и [АuСl4]-, имеющие строение плоского квадрата. Типы гибридизации, основные геометрические формы молекул или ионов и их структура приведены в табл.3. Таблица 3
|
|||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 61; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.23.130 (0.017 с.) |