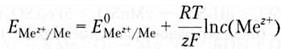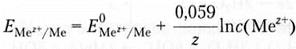Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метод электронно-ионного баланса .
При использовании данного метода нет необходимости определять степени окисления элементов. Для составления баланса достаточно знать заряды ионов, участвующих в реакции. Если реакция протекает в кислой среде, то для уравнивания полуреакций используют ионы Н+ и молекулы воды, если в щелочной — ионы ОН- и молекулы воды, а если в нейтральной — молекулы воды и ионы Н+ или ОН-. Для уравнивания реакций методом электронно-ионного баланса необходимо выполнить следующую последовательность операций: • найти молекулы и ионы, участвующие в окислительно-восстановительном процессе; • написать полуреакции окисления и восстановления в ионно-молекулярном виде, рассчитывая число переносимых электронов по разности суммарного заряда частиц в левой и в правой части полуреакции; • уравнять число отданных и полученных электронов, умножив эти полуреакции на соответствующие множители; • написать суммарное уравнение в ионном виде и сократить соответствующее число одинаковых молекул и ионов в левой и правой части уравнения; • перенести коэффициенты в уравнение реакции. Удобство этого метода заключается в том, что можно получать коэффициенты практически для всех веществ, участвующих в реакции. Уравняем реакции, приведенные выше в примерах 8.1 и 8.2, методом электронно-ионного баланса. Пример 7.3. КМnO4 + FeSO4 + H2SO4 → MnSO4 + Fe2(SO4)3 + K2SO4 + H2O MnO4 + 2Fe2+ +... → Mn2+ + 2Fe3+ +... (участники окислительно-восстановительного процесса)
2MnO4 + 10Fe2+ + 16Н+ → 2Mn2+ + 10Fe3+ + 8Н2О (суммарная реакция в ионном виде) 2КМnO4 + 10FeSO4 + 8H2SO4 → 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O (окончательное уравнение реакции) Пример 7.4. 3H2O2 + 2КМnO4 → 2МnO2 + 2КОН + 3O2 + 2Н2O Н2O2 + МnO4- +... → МnO2 + O2 +... (участники окислительно-восстановительного процесса)
2MnO4- + 4Н2O + 3Н2O2 + 6ОН- → 2MnO2 + 8OН- + 6Н2O + 3O2 (суммарная реакция в ионном виде) 2MnO4- + 3Н2O2 → 2 MnO2 + 2 OН- + 2 Н2O + 3O2 (суммарная реакция в ионном виде после сокращения числа одинаковых частиц справа и слева) 3H2O2 + 2КМnO4 → 2МnO2 + 2КОН + 3O2 + 2Н2O (окончательное уравнение реакции) Обратите внимание, что при обозначении степени окисления сначала ставится знак «+» или «-», а затем цифра; при обозначении иона в растворе — наоборот. Электродный потенциал. Если пластинку металла погрузить в воду или в раствор его соли, то некоторое количество ионов металла с поверхности перейдет в раствор или из раствора на поверхность металла. Этот процесс будет сопровождаться гидратацией ионов.
Me D Меz+ + z e Mez+ + n Н2O D [Ме(Н2O)n]z+ Таким образом на границе металл — раствор устанавливается равновесие Me + n Н2O D [Ме(Н2O)n]z+ + z e Пластинка металла при этом заряжается отрицательно или положительно. Например, в том случае, когда ионы металла уходят с пластинки, положительно заряженные ионы концентрируются у поверхности за счет сил электростатического притяжения, в результате чего образуется двойной электрический слой, и на границе металл — раствор возникает скачок электрического потенциала, который называется электродным потенциалом.
где E(Mez+/Me) — электродный потенциал; E0(Mez+/Me) — стандартный электродный потенциал (соответствует активности ионов металла 1 моль/л); R – универсальная газовая постоянная, Дж/моль-К; T — абсолютная температура; z — заряд иона металла; F — постоянная Фарадея (96 500 Кл/моль); C — молярная концентрация ионов. После подстановки значений констант и перехода к десятичным логарифмам для температуры 298 К получим упрощенную форму уравнения Нернста:
|
|||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 42; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.196.59 (0.007 с.) |
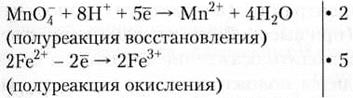
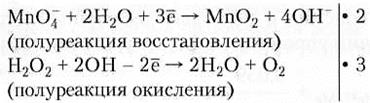
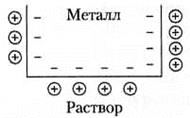 Величина этого потенциала зависит от природы металла, концентрации (активности) ионов металла в растворе (при высокой концентрации ионов металла может происходить осаждение металла на пластинке и она зарядится положительно) и температуры. Для математического выражения этой зависимости В.Г. Нернстом в 1888г. было предложено следующее выражение:
Величина этого потенциала зависит от природы металла, концентрации (активности) ионов металла в растворе (при высокой концентрации ионов металла может происходить осаждение металла на пластинке и она зарядится положительно) и температуры. Для математического выражения этой зависимости В.Г. Нернстом в 1888г. было предложено следующее выражение: