
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислородсодержащие соединения фосфора
Фосфор образует несколько оксидов, из которых наиболее устойчивы два оксида Р2О3 и Р2О5. Даже в парах оксиды являются димерами, их формулы записывают также Р4О6 и Р4О10. Оксид фосфора (III) - Р2О3 (Р4О6) - белое кристаллическое вещество (t пл = 24°С, t кип = 174°С), легко возгоняющееся, очень ядовитое. Получают его сжиганием белого фосфора в недостатке кислорода на воздухе. Молекула Р4О6 содержит четыре атома фосфора, ее структура напоминает структуру белого фосфора (Р4) с той разницей, что четыре атома фосфора соединены через кислородные мостики. Атомы кислорода расположены вне прямых, соединяющих атомы фосфора:
Химические свойства. При температуре 20 – 50°С Р4О6 окисляется кислородом воздуха: Р4О6 + 2О2 = Р4О10. При взаимодействии с холодной водой образует фосфористую кислоту H3PO3: Р4О6 + 6H2O = 4H3PO3. Взаимодействие Р4О6 с горячей водой приводит к диспропорционированию: Р4О6 + 6Н2О Свойства кислотного оксида: 4CaO + P4O6 + 2H2O = 4CaHPO3; 4Ca(OH)2 + P4O6 = 4CaHPO3 + 2H2O. Р4О6 обладает восстановительными свойствами: 4HgCl2 + P4O6 + 10H2O = 4H3PO4 + 4Hg + 8HCl. Оксид фосфора (V) – белая снегоподобная масса, не имеет запаха. Очень гигроскопичен. При контакте с воздухом расплывается в сиропоподобную жидкость (HPO3) n. Применяется как осушитель. В структуре P4O10 четыре тетраэдра [РО4] (sp 3-гибридизация валентных орбиталей атома фосфора) соединены через общие атомы кислорода в клетку из четырех гетероциклов.
Химические свойства. При взаимодействии с водой образует ряд кислот: Р4О10 + 2H2O = H4P4O12 (циклотетрафосфорная); Р4О10 + 4H2O = 2H4P2O7 (дифосфорная); Р4О10 + 6H2O Свойство Р4О10 активно взаимодействовать с водой позволяет использовать его для осушения газов, жидкостей и твердых веществ. Важно отметить, что Р4О10 способен отнимать от веществ «химически связанную» воду, поэтому оксид фосфора (V) применяют в качестве дегидратирующего реагента, например: 4HNO3 + P4O10 = 2N2O5 + 4НРО3. Свойства кислотного оксида: 6CaO + P4O10 = 2Ca3(PO4)2; 6Ca(OH)2 + P4O10 = 2Ca3(PO4)2 + 6H2O. Фосфор по числу кислородсодержащих кислот превосходит все другие элементы периодической системы. Кислоты фосфора (V) состоят из одного или нескольких тетраэдров РО4, соединенных друг с другом в цепи и кольца разного размера. Некоторые из кислот имеют молекулярное строение (H3PO4, H4P2O7), некоторые являются полимерами, например (HPO3) n.
Во всех кислотах атом фосфора имеет координационное число четыре и находится в центре тетраэдра, образованного атомами кислорода. В фосфористой и фосфорноватистой кислотах существуют связи фосфора с водородом Р–Н. При взаимодействии фосфорного ангидрида с водой на первой стадии в молекуле Р4О10 происходит разрыв двух кислородных мостиков с образованием четырех связей Р-ОН: Р4О10 + 2Н2О = Н4Р4О12 или (НРО3)4. Циклотетрафосфорная кислота (тетраметафосфорная) Н4Р4О12 имеет циклическое строение:
Дальнейшая гидратация циклотетрафосфорной кислоты протекает с разрывом цикла и образованием шестиосновной тетрафосфорной кислоты: Н4Р4О12 + Н2О = Н6Р4О13.
Далее гидратация идёт через стадии последовательного отщепления мономеров Н3РО4: Н6Р4О13 + Н2О = Н3РО4 + Н5Р3О10 (трифосфорная кислота); Н5Р3О10 + Н2О = Н3РО4 + Н4Р2О7 (дифосфорная кислота) с образованием в конечном итоге ортофосфорной кислоты: Н4Р2О7 + Н2О = 2Н3РО4. Описанная гидратация полифосфорных кислот ускоряется при кипячении раствора, а также в присутствии сильных кислот. При дегидратации ортофосфорной кислоты (например, при нагревании) вышеописанные процессы протекают в обратном направлении: 2Н3РО4 Поликонденсация завершается образованием полифосфорных кислот, представляющих собой линейные полимеры, циклы и разветвленные структуры. Из фосфорных кислот наибольшее практическое значение имеет ортофосфорная кислота Н3РО4 (часто ее называют просто фосфорной) ‒ белое твердое вещество, хорошо растворимое в воде. Н3РО4 не ядовита. Молекулы Н3РО4 в водном растворе имеют форму искажённых тетраэдров, которые объединены водородными связями:
Образование водородных связей объясняет высокую вязкость концентрированных растворов Н3РО4. В водном растворе она диссоциирует ступенчато, как слабая трехосновная кислота: Н3РО4 ⇄ H+ + Н2РО Н2РО НРО Химические свойства Н3РО4. Ортофосфорная кислота при обычных условиях малоактивна и реагирует лишь с гидроксидами и карбонатами. Большинство металлов холодная Н3РО4 не растворяет, так как при взаимодействии на их поверхности образуется защитная фосфатная плёнка (солевая пассивация).
Горячие растворы ортофосфорной кислоты (t > 80°С) способны растворять даже неактивные оксиды (Al2O3, SiO2 и др.), стекло и силикаты: 2Н3РО4 + 3Ba(OH)2 = Ba3(PO4)2 + 6H2O; 2Н3РО4 + 3BaO = Ba3(PO4)2 + 3H2O; 2Н3РО4 + 3Mg = Mg3(PO4)2 + 3H2; Н3РО4 + NH3 = NH4Н2PO4. Поскольку степень окисления +5 для фосфора очень устойчива, то даже концентрированная Н3РО4 не проявляет окислительных свойств. Получение в промышленности – обработка фосфоритов и апатитов концентрированной серной кислотой: Сa3(PO4)2 + 3H2SO4(конц) = 3СaSO4 + 2H3PO4. Из оксида Р4О10, полученного сжиганием фосфора: Р4О10 + 6H2O Потребителям кислота поставляется в виде сиропообразного 75‒85%-ного раствора. Как трехосновная, фосфорная кислота образует три типа солей: дигидроортофосфаты (NаН2РО4); гидроортофосфаты (Nа2НРО4); ортофосфаты (Na3РО4). Все дигидроортофосфаты растворимы в воде. Из гидроортофосатов и ортофосфатов в воде растворимы только соли щелочных металлов и аммония. Растворимые соли фосфорной кислоты подвергаются гидролизу: Na3РО4 + Н2О ⇄ Na2НРО4 + NaОН (рН > 7); РО При гидролизе ортофосфатов и гидроортофосфатов создается щелочная среда, в растворах дигидроортофосфатов создается кислая среда. У растворов дигидроортофосфатов процесс диссоциации иона Н2РО Ортофосфорная кислота и её соли очень удобны для приготовления серии буферных растворов, позволяющих создавать кислую, нейтральную и щелочную среду: Н3РО4 + NaH2PO4 (pH» 2); NaH2PO4 + Na2HPO4 pH» 7); Na2HPO4 + Na3PO4 (pH» 12). Средние ортофосфаты устойчивы при нагревании до температур плавления (свыше 1000°С). Исключение составляют Hg3(PO4)2 и (NH4)3PO4: (NH4)3PO4 = 3NH3 + H3PO4; При нагревании кислых солей образуются конденсированные фосфаты: NaН2РО4 2Na2НРО4 Полифосфаты цепочечного строения при плавлении образуют смешанные полифосфаты. Циклические полифосфаты при прокаливании отщепляют Р2О5: 2Ca3(P3O9)2 3Ca2P2O7 Качественная реакция на ортофосфат-ионы – образование желтого осадка Ag3РО4: 3AgNO3 + Na3PO4 = Ag3РО4↓ + 3NaNO3. Фосфористая кислотаН3РО3. Степень окисления фосфора равна +3. Молекула имеет форму тетраэдра с атомом фосфора в центре, в вершинах тетраэдра находится один атом водорода, атом кислорода и две гидроксогруппы.
Подвижными являются только атомы водорода гидроксогрупп, которые могут замещаться на атомы металлов. Поэтому фосфористая кислота является двухосновной слабой кислотой ( Получают фосфористую кислоту реакцией гидролиза хлорида фосфора (III), растворением P4O6 (P2O3) в холодной воде или взаимодействием фосфитов с серной или соляной кислотами: РCl3 + 3Н2О = Н3РО3 + 3НСl; P2O3 + 3H2O = 2H3PO3. При температуре около 50°С H3PO3 разлагается: 4H3PO3 = PH3 + 3H3PO4. Соли фосфористой кислоты называются фосфитами. Большинство фосфитов малорастворимы в воде (кроме фосфитов щелочных металлов). Известны кислые соли (гидрофосфиты, например NaH2PO3) и средние соли (фосфиты,например Na2HPO3): H3PO3+ Ba(OH)2 = BaНРО3 + 2H2O. Растворимые соли в водных растворах гидролизуются: K2НРО3 + Н2О ⇄ KН2РО3 + KОН. Соединения фосфора +3 являются достаточно сильными восстановителями:
Н3РО3 + Н2О – 2 e – = Н3РО4 + 2Н+, Е Н3РО3 + 4AgNO3 + 2Н2О = 4Ag + Н3РО4 + 4НNO3; K2Cr2O7 + 3Н3РО3 + 4Н2SО4 = Cr2(SО4)3 + 3Н3РО4 + K2SО4 + 4Н2О. Фосфорноватистая кислотаН3РО2. Степень окисления фосфора равна +1. Молекула имеет форму тетраэдра с атомом фосфора в центре, в вершинах тетраэдра находятся два атома водорода, атом кислорода и гидроксогруппа:
Способным к заменене на атомы металлов является только атом водорода гидроксогруппы. Поэтому фосфорноватистая кислота, несмотря на наличие трех атомов водорода, является одноосновной (K = Химические свойства. Сильный восстановитель: H3PO2 + 2Н2О – 4 e – = Н3РО4 + 4Н+, E 5H3PO2 + 4KMnO4 + 6H2SO4 = 5H3PO4 + 4MnSO4 + 2K2SO4 + 6H2O. Восстановление никеля гипофосфитом, используемое для покрытия никелем деталей любой конфигурации, протекает по реакции: NiCl2 + NaH2PO2 + H2O → NaH2PO3 + 2HCl + Ni. При температуре около 50°С разлагается: 3H3PO2 Получение H 3 PO 2: 2P4 + 3Ba(OH)2 + 6H2O = PH3 + 3Ba(H2PO2)2; Ba(H2PO2)2 + H2SO4 = 2H3PO2 + BaSO4. Кислоты, характеризующиеся чередованием атомов P–O–P, можно получить, конденсируя две или более молекул ортофосфорной кислоты с удалением воды. Таким образом получается ряд линейных кислот, имеющих общую формулу H n +2P n O3 n +1, где n = 2 или более (дифосфорная H4P2O7, трифосфорная H5P3O10) и циклических кислот, имеющих общую формулу (HPO3) n, где n = 3 или более (циклотрифосфорная H3P3O9, циклотетрафосфорная H4P4O12 и т. д.). Дифосфорная кислота (пирофосфорная кислота) H4P2O7 образуется при регулируемом нагревании ортофосфорной кислоты. Она неустойчива на влажном воздухе и легко превращается в ортофосфорную кислоту: H4P2O7 + Н2О = 2H3PO4. H4P2O7 – четырехосновная кислота:
H5P3O10 – трифосфорная кислота – имеет аналогичное строение, содержит два мостика P–O–P. Является пятиосновной кислотой, образует средние соли трифосфаты, например, Na5P3O10, кислые соли с различным числом атомов водорода в составе. Циклические кислоты, например, цикло трифосфорная (тр и метафосфорная) кислота H3P3O9 и цикло тетрафосфорная кислота (тетр а метафосфорная) H4P4O12 присутствуют в незначительных количествах в смесях полифосфорных кислот:
Ледяная полифосфорная кислота (техническая метафосфорная кислота) представляет собой смесь полифосфорных кислот (в основном линейных) неопределенного химического состава.
Фосфор образует также фосфорноватую (гипофосфорную) кислоту Н4Р2О6, в которой атомы фосфора имеют степень окисления +4 и непосредственно связаны друг с другом:
Это слабая четырехосновная кислота. Н4Р2О6 – бесцветное очень гигроскопичное и легко растворимое в воде вещество (t пл = 73оС), при попадании на кожу вызывает тяжелые, медленно заживающие ожоги. Сама фосфорноватая кислота и ее средние и кислые соли устойчивы, для них характерны восстановительные свойства. В кристаллическом виде кислоту получают обменной реакцией из гипофосфата свинца (II): Pb2P2O6 + 2H2S = H4P2O6 + 2PbS¯. Раствор фосфорноватой кислоты можно получить осторожным окислением водной суспензии красного фосфора хлоритом натрия: 2P + 2NaClO2 + 2H2O = 2NaCl + H4P2O6. Ортофосфорная кислота и ее кислые соли входят в состав препаратов для удаления продуктов коррозии с поверхности металлических изделий и создания защитных фосфатных пленок с высокими антикоррозионными свойствами. Электрохимической обработкой металлов (анодирование) в растворах фосфорной кислоты на них получают защитные и декоративные покрытия. Ортофосфорная кислота используется в пищевой промышленности как консервант, как компонент питательной среды дрожжей и заквасок, а также в качестве регулятора кислотности в безалкогольных напитках. Фосфаты применяются в производстве моющих средств (Na5P3O10), зубных паст, стекла, умягчителей воды, флокулянтов, цементов, огнестойких пропиток тканей и деревянных конструкций. Широко применяются фосфаты в качестве минеральных удобрений. Минеральные фосфорные удобрения
Мышьяк, сурьма, висмут В ряду N – P – As – Sb – Bi с увеличением размеров атомов уменьшается энергия ионизации, связь электронов наружного слоя с ядром ослабевает, все это приводит к ослаблению неметаллических и усилению металлических свойств элементов в данном ряду. Простые вещества мышьяк, сурьма, висмут, как и фосфор, существуют в нескольких аллотропных модификациях. У мышьяка и сурьмы имеются неметаллические модификации – «желтый мышьяк» и «желтая сурьма», которые по строению подобны белому фосфору и состоят из молекул As4 и Sb4. Эти модификации неустойчивы и самопроизвольно превращаются соответственно в «серый мышьяк» и «серую сурьму», которые обладают металлическим блеском и электропроводностью. Слоистая структура, аналогичная черному фосфору, придаёт им значительную хрупкость. Так металлическая сурьма при растирании легко измельчается в порошок. У висмута существуют только металлические модификации. В обычных условиях висмут - хрупкий с красноватым оттенком металл. При температурах выше 120°С висмут приобретает ковкость и пластичность.
Усиление металлических признаков у простых веществ данного ряда видно на примере их взаимодействия с азотной кислотой: As + 5НNО3(конц) = Н3AsО4 + 5NО2 + Н2О; 2Sb + 10НNО3(конц) = Sb2О5 · n Н2О + 10NО2. Висмут в концентрированной азотной кислоте пассивируется, но в разбавленной кислоте растворяется с образованием нитрата висмута (III): Bi + 4НNО3(разб) = Bi(NО3)3 + NО + 2Н2О. Мышьяк, сурьма и висмут являются слабыми восстановителями, характеризуются положительными электродными потенциалами. Поэтому вода и разбавленные кислоты на них не действуют. Они реагируют, кроме азотной, с концентрированной cерной кислотой: 2As + 3Н2SО4(конц) = 2Н3AsО3 (или НAsО2) + 3SО2; 2Sb + 6Н2SО4(конц) = Sb2(SО4)3 + 3SО2 + 6Н2О; 2Bi + 6Н2SО4(конц) = Bi2(SО4)3 + 3SО2 + 6Н2О. Металлические сурьма и висмут могут реагировать с концентрированной соляной кислотой в присутствии окислителя, например, пероксида водорода: 2Sb + 12HCl + 3H2O2 → 2H3[SbCl6] + 6H2O. С активными металлами Аs и Sb взаимодействуют, образуя арсениды и стибиды (или антимониды): 3Мg + 2As = Mg3Аs2; 3Са + 2Sb = Са3Sb2. С водородом непосредственно Аs, Sb и Bi не соединяются. Но при взаимодействии арсенидов и стибидов с кислотами образуются неустойчивые соединения AsH3 (арсин), SbH3 (стибин): Mg3Аs2 + 6НС1 = 3MgС12 + 2АsН3. AsH3 можно получить восстановлением оксида (проба Марша, определение As): Аs2О3 + 6Zn + 12НС1 = 6ZnС12 + 2АsН3 + 3Н2О. Арсин (AsH3) и стибин (SbH3) в обычных условиях – газообразные вещества с резким запахом, практически нерастворимые в воде. Висмутин (BiH3) при получении очень быстро разлагается. Все расматриваемые вещества очень токсичны, особенно арсин. Их молекулы имеют такое же строение, как и молекула РН3. Валентные углы Н-Э-Н близки к 90°, что позволяет сделать вывод об отсутствии гибридизации атомных орбиталей у центрального атома. Поэтому у молекул практически отсутствуют донорные свойства, а следовательно, и основные свойства. AsH3, SbH3 и BiH3 не взаимодействуют с водой и кислотами. Напротив, у стибина проявляются слабые кислотные свойства и, при пропускании через раствор нитрата серебра, он образует черный осадок малоустойчивого стибида серебра: SbH3 + 3AgNO3 = Ag3Sb¯ + 3HNO3. Водородные соединения мышьяка и сурьмы термически неустойчивы ( 2ЭН3 = 2Э + 3Н2. Арсин и стибин проявляют сильные восстановительные свойства. Они горят на воздухе: 2ЭН3 + 3О2 = Э2О3 + 3Н2О, легко окисляются галогенами, серой, перманганатом калия, нитратом серебра (I): 2AsH3 + 12AgNO3 +3H2O = 12Ag + As2O3 + 12HNO3. Соединения мышьяка, сурьмы и висмута с металлами - арсениды, стибиды (антимониды) и висмутиды можно разделить на солеподобные и металлоподобные. Солеподобные соединения образуются с Кислородсодержащие соединения. У мышьяка, сурьмы и висмута существуют оксиды As2O3, As2O5, Sb2O3, Sb2O4, Sb2O5, Bi2O3, Bi2O5. Высшие оксиды имеют кислотный характер, а характер оксидов Э2О3 при движении по группе вниз изменяется от преимущественно кислотного к основному. В ряду кислородсодержащих соединений Оксид мышьяка (III) - As 2 O 3 - твердое вещество белого цвета («белый мышьяк»), легко возгоняется (t возг = 218°С). В газообразном и твердом виде состоит из молекул As4O6 (кубическая модификация, t пл.= 274°С). Существуют и менее летучие модификации - моноклинная (t пл = 315°С) и стеклообразная (t кип = 46°С), представляющие собой слоистые полимеры. As2O3 амфотерен, однако преобладают кислотные свойства. As2O3 растворяется в воде (2 г на 100 г воды при 20°С), ещё лучше - в щелочах и в галогеноводородных кислотах: As2O3 + 3H2O = 2H3AsO3; As2O3 + 6KOH = 2K3AsO3 + 3H2O; As2O3 + 2KOH + 3H2O = 2K[As(OH)4] (в избытке щелочи); As2O3 + 8HCl = 2H[AsCl4] + 3H2O. Несмотря на то, что оксид мышьяка (III) легко образуется при сгорании мышьяка и его сульфидов в кислороде воздуха: 4As + 3O2 = 2As2O3, на практике его получают гидролизом AsCl3 в кипящей воде: 2AsCl3 + 3H2O = As2O3¯ + 6HCl. Ортомышьяковистая кислота (мышьяковистая) - H 3 AsO 3 - существует лишь в водных растворах. Мышьяковистая кислота - слабая трехосновная кислота, слабее угольной ( H3AsO3 + 3NaOH = Na3AsO3 + 3H2O. Растворимы в воде только ортоарсениты щелочных металлов. Метаформа мышьковистой кислоты HAsO2 не выделена, однако известны ее производные - метаарсениты. Метаарсениты щелочных и щелочноземельных металлов легко получаются при дегидратации гидроксокомплексов: Na[As(OH)4] Взаимодействием мышьяковистой кислоты с концентрированными галогеноводородными кислотами можно получить галогенидные комплексы. Эта реакция протекает через стадию образования галогенангидридов AsГ3: H3AsO3 + 3HCl = AsCl3 + 3H2O; AsCl3 + HCl = H[AsCl4]. H3AsO3 и арсениты проявляют слабые восстановительные свойства и могут быть окислены до соединений мышьяка (V): H3AsO3 + Br2 + H2O = H3AsO4 + 2HBr. Получают растворы ортомышьяковистой кислоты растворением в воде As2O3. Оксид сурьмы (III) - твердое вещество (t пл = 655°С) белого цвета, малорастворимое в воде (0,002 г в 100 мл Н2О при 17°С). В газообразном и твердом виде оксид состоит из молекул Sb4O6 и подобен кубической модификации As2O3. В отличие от As2O3, Sb2O3 проявляет ярко выраженные амфотерные свойства: Sb2O3 + 3H2SO4(конц) = Sb2(SO4)3 + 3H2O; Sb2O3 + 2NaOH + 3H2O = 2Na[Sb(OH)4]. В галогеноводородных кислотах оксид сурьмы (III), также как и As2O3 растворяется с образованием комплексов: Sb2O3 + 12HCl = 2H3[SbCl6] + 3H2O. Гидроксид сурьмы (III) образуется в виде белого осадка неопределенного состава Sb 2 O 3 × n H 2 O при действии растворов щелочей на соли сурьмы (III) или трихлорид сурьмы: 2SbCl3 + 6NaOH +(n - 3)H2O = Sb2O3 × n H2O¯ + 6NaCl. Он проявляет амфотерные свойства, легко растворяясь в кислотах и щелочах аналогично Sb2O3. Соли Sb3+ в водных растворах неустойчивы и гидролизуются с образованием смеси основных солей, содержащих оксо- и гидроксогрупы. Например, гидролиз SbCl3 идет по двум ступеням и дальнейшим разложением Sb(ОН)2Cl на хлорид антимонила и воду: SbCl3 + Н2О ⇄ НС1 + SbОНCl2; SbОНCl2 + Н2О ⇄ НС1 + Sb(ОН)2Cl; Sb(ОН)2Cl = SbОCl↓ + Н2О. Оксид висмута Bi 2 O 3 - бледно-желтое кристаллическое вещество, существует в четырех модификациях. При комнатной температуре устойчива a-модификация (t пл = 824°С, t кип = 1890°С, летуч при t > 950°С). Bi2O3 не растворяется в воде, но растворим в сильных кислотах: Bi2O3 + 6HNO3 = 2Bi(NO3)3 + 3H2O. Оксид висмута (III) относят к основным оксидам. Получают Bi2O3 термическим разложением нитрата висмута (III): 4Bi(NO3)3 Гидроксид висмута (III) имеет переменный состав, но ему обычно приписывают формулу Bi (OH)3. Это белое малорастворимое в воде вещество, при нагревании отщепляет воду, превращаясь в оксид. Гидроксид висмута (III) является основанием с очень слабо выраженными амфотерными свойствами. В растворах соли Bi3+ при кипячении полностью гидролизуются, образуя неустойчивые основные соли, разлагающиеся с образованием солей висмутила: Bi(NO3)3 + Н2О ⇄ BiONO3¯ + 2НNO3. В присутствии галогенид-ионов соли Bi3+ гидролизуются с образованием малорастворимых осадков оксогалогенидов висмута (III): Bi3+ + Cl- + H2O ⇄ BiOCl¯ + 2H+. Гидроксид висмута (III), в отличие от гидроксида сурьмы (III), проявляет слабые окислительные свойства и может быть восстановлен соединениями олова (II): 2Bi(OH)3 + 3Na2[Sn(OH)4] = 2Bi¯ + 3Na2[Sn(OH)6]. Эта реакция используется в аналитической химии для обнаружения ионов висмута (III). Гидроксид висмута (III) получают приливанием раствора нитрата висмута (III) к раствору щелочи: 3NaOH + Bi(NO3)3 = Bi(OH)3¯ + 3NaNO3. При обратном порядке сливания растворов осаждается малорастворимая основная соль: Bi(NO3)3 + 2NaOH = (BiO)NO3¯ + 2NaNO3 + H2O. Оксид мышьяка (V) - As 2 O 5 - гигроскопичное белое стекловидное вещество, похожее на оксид фосфора (V). При нагревании выше 315°С разлагается: As2O5 Это кислотный оксид, при растворении в воде он образует ортомышьяковую кислоту: As2O5 + 3H2O = 2H3AsO4. Получают мышьяковый ангидрид из H3AsO4 осторожным нагреванием при температуре 280-300°С: 2H3AsO4 Ортомышьяковая кислота - H 3 AsO 4 -кристаллическое вещество белого цвета (t пл = 35,5°С), очень гигроскопичное и хорошо растворимое в воде. По строению и кислотным свойствам напоминает ортофосфорную кислоту: При нагревании, по мере повышения температуры, H3AsO4 превращается в димышьяковую кислоту, затем в полимерную метамышьяковую кислоту, с образованием в конечном итоге As2O5: H3AsO4
Ортомышьяковая кислота, в отличие от H3PO4, проявляет слабые окислительные свойства: H3AsO4 + 2H+ + 2 e – = H3AsO3 + H2O, Е H3AsO4 + 2KI + H2SO4 ⇄ H3AsO3 + I2 + K2SO4 + H2O. Это обратимая окислительно-восстановительная реакция - в щелочной среде она протекает справа налево. Получают H3AsO4 взаимодействием элементарного мышьяка или As2O3 с концентрированной азотной кислотой: As2O3 + 2HNO3 + 2H2O → NO2 + NO + 2H3AsO4. Оксид сурьмы (V) – Sb 2 O 5 –бледно-жtлтый порошок, малорастворимый в воде (0,2 г в 100 мл H2O при 20°С). Это кислотный оксид, его водный раствор имеет кислую реакцию. При нагревании (t > 350°С) оксид сурьмы (V) разлагается с образованием смешанного оксида сурьмы (III,V) – Sb2O4: 2Sb2O5 При растворении Sb2O5 в растворах щелочей образуются гидроксокомплексы: Sb2O5 + 2NaOH + 5H2O = 2Na[Sb(OH)6]. Соединения сурьмы (V) проявляют окислительные свойства, поэтому при взаимодействии Sb2O5 c концентрированной соляной кислотой протекает обратимая окислительно-восстановительная реакция: Sb2O5 + 16HCl ⇄ 2H3[SbCl6] + 2Cl2 + 5H2O. Сплавлением Sb2O5 с оксидами металлов получаются соли стибаты (антимонаты) – как мета-, так и ортоформы, например NaSbO3, AlSbO4. Получают Sb2O5 обезвоживанием сурьмяной кислоты: 2H3SbO4 Сурьмяная кислота – Sb 2 O 5 × n H 2 O (условная формула H 3 SbO 4) – плохо растворимый в воде белый порошок, который получают окислением металлической сурьмы концентрированной азотной кислотой: 2Sb + 2 n HNO3 = Sb2O5 × n H2O¯ + 2 n NO2, либо гилролизом SbCl5 при нагревании: 2SbCl5 + (5 + n)H2O → Sb2O5 × n H2O¯ + 10HCl. При нагревании (t < 400°С) кислота переходит в оксид сурьмы (V). Растворением сурьмяной кислоты в концентрированных растворах щелочи получают стибаты (антимонаты), которые существуют в форме гексагидроксостибат-ионов [Sb(OH)6]–: Sb2O5 × n H2O + 2NaOH +(5 – n)H2O ⇄ 2Na[Sb(OH)6]. Оксид висмута (V) – Bi2 O 5 – красно-коричневое твердое вещество, его можно получить взаимодействием Bi2O3 с озоном: 2Bi2O3 + 2O3 = 2Bi2O5 + O2. Bi2O5 очень плохо растворяется в воде, при нагревании разлагается с постепенным отщеплением кислорода: 2Bi2O5 Достоверные данные о существовании гидроксида висмута (V) отсутствуют. Однако окислением соединений висмута (III) в щелочной среде сильными окислителями можно получить соединения висмута (V) неопределённого состава – висмутаты, которым для простоты приписывают условную формулу MIBiO3: Bi2O3 + 2Na2O2 = 2NaBiO3 + Na2O; Bi2O3 + 6NaOH + 2Br2 = 2NaBiO3¯ + 4NaBr + 3H2O. Оксид висмута (V) и висмутаты – сильные окислители, что широко используется в лабораторной практике. Например, для качественного обнаружения ионов Mn2+ в растворе применяют реакцию: 2Mn(NO3)2 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + 5NaNO3 + 7H2O. Таким образом, в ряду соединений элементов в степенях окисления +3 от мышьяка к висмуту восстановительные свойства уменьшаются, а для соединений в степенях окисления +5 окислительные свойства усиливаются:
Сульфиды этих элементов в воде нерастворимы. Их образование, а также растворение сульфидов мышьяка и сурьмы в сульфидах натрия и аммония с образованием тиосолей используется в аналитической химии для отделения мышьяка и сурьмы от сульфидов других элементов: 2Na3AsO3 + 3Na2S + 6Н2О = Аs2S3↓ + 12NaОН; 2Na3AsO4 + 5Na2S + 8Н2О = Аs2S5↓ + 16NaОН; As2S3 + Na2S = 2NaAsS2; Sb2S5 + 3Na2S = 2Na3SbS4; Аs2S5 + 3(NH4)2S = 2(NH4)3АsS4 (тиоарсенат аммония).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 99; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.70.157 (0.18 с.) |

 РН3↑ + ЗН3РО4.
РН3↑ + ЗН3РО4.


 Н4Р2О7
Н4Р2О7 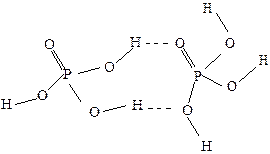
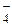 ,
, 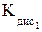 = 6,92 · 10–3;
= 6,92 · 10–3; ⇄ H+ + НРО
⇄ H+ + НРО  ,
,  = 6,17 · 10–8;
= 6,17 · 10–8;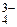 ,
,  = 4,79 · 10–13.
= 4,79 · 10–13.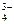 + Н2О ⇄ НРО
+ Н2О ⇄ НРО  > KГ).
> KГ).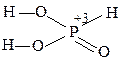
 = –0,276 В;
= –0,276 В;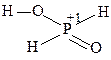

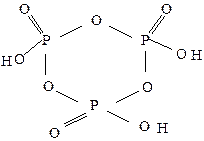
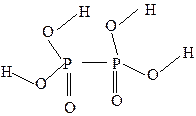
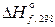 > 0):
> 0): NaAsO2 + 2H2O.
NaAsO2 + 2H2O.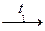 H4As2O7
H4As2O7 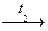 (HAsO3) n
(HAsO3) n 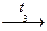 As2O5.
As2O5. As+3 ← Sb+3 ← Bi+3
As+3 ← Sb+3 ← Bi+3
 As+5 → Sb+5 → Bi+5
As+5 → Sb+5 → Bi+5



