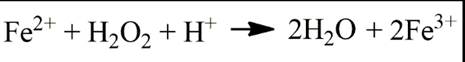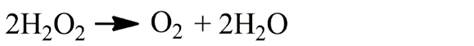Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-восстановительные системы
Окислительно-восстановительные системы нашли в настоящее время широкое применение для инициирования цепных радикальных процессов, особенно процесса полимеризации в водных и в водно-эмульсионных средах при низких температурах. Все окислительно-восстановительные системы можно разделить на три типа. К первому типу относятся системы, в которых реакция между окислителем и восстановителем сопровождается образованием одного радикала. В системах этого типа участвуют ионы металлов переменной валентности, причем реакция сопровождается переходом металла в низшую или высшую степень окисления [5, 6]. Второй тип систем характеризуется тем, что реакция между окислителем и восстановителем сопровождается образованием двух радикалов. Благоприятствующим энергетическим фактором в этих реакциях является образование более стабильного радикала и продуктов окисления экзотермического характера. Системы третьего типа характеризуются тем, что реакция между компонентами системы непосредственно не приводит к образованию свободных радикалов. Первичным продуктом реакции является новое промежуточное соединение, термически менее стойкое, чем исходные продукты, спонтанно распадающееся на свободные радикалы. Большинство окислительно-восстановительных реакций, протекающих через радикальные стадии, сопровождается образованием ионов, что делает их энергетически более выгодными в водных средах [5]. Существуют различные окислительно-восстановительные системы. Среди элементорганических инициаторов окислительно-восстановительного типа можно выделить композиции на основе алкильных производных бора и алюминия [7]. Из органических окислительно-восстановительных можно отметить гидрохинон. Из неорганических систем особо часто используется система Fe2+-H2O2(реактив Фентона).
1.1.2. Система Fe 2+ - H 2 O 2 – реактив Фентона Ионы переходных металлов являются катализаторами разложения перекиси водорода. Система Fe2+-H2O2 (реактив Фентона) вызывает окисление различных гидроксилсодержащих соединений. Установлено, что если подкисленный раствор перекиси водорода вводить в избыточное количество подкисленного сульфата железа (II), то 1 моль разложившейся перекиси водорода окисляется 2 моля Fe2+, то есть n = ∆H2O2/∆Fe2+ = 0,5 [8]. Суммарное уравнение реакции:
Если же, напротив, раствор соли Fe2+ вводить в раствор перекиси водорода, то число молей разложившейся перекиси водорода на 1 моль израсходованного Fe2+ превышает 0,5 в этих условиях (при недостатке Fe2+) разложение перекиси водорода сопровождается выделением кислорода:
Распад перекиси водорода под влиянием солей закисного железа инициирует полимеризацию акрилонитрила, стирола, метакриловой кислоты и других мономеров в водных растворах или в водной эмульсии при комнатной или более низких температурах [5]. Реакция протекает в кислых средах. Авторы работ изучали взаимодействие перекиси водорода с Fe2+ в присутствии мономера и установили, что при достаточной концентрации последнего число молей Fe2+, окисляемых одним молем перекиси водорода, падает от максимального 2 до минимального 1. Следовательно, в присутствии мономера имеет место конкуренция между Fe2+ и мономером за реакции с гидроксильным радикалом:
(1)
(2)
При достаточно высокой концентрации мономера реакция, протекающая по схеме (1) полностью подавляется. В случае полимеризации акрилонитрила реакция, протекающая по схеме (2), протекает примерно в 5 раз быстрее реакции (1). Метилметакрилат несколько менее активен в этой реакции. Инициирование полимеризации реактивом Фентона осуществляется гидроксильными радикалами, а обрыв цепи в большинстве случаев – путем рекомбинации двух растущих полимерных радикалов. Системы с участием перекиси водорода не нашли широкого применения для инициирования полимеризации в связи с их малой эффективностью. Это обусловлено, по-видимому, тем, что оба реагента, пероксид водорода и соль металла с переменной валентностью, находятся в водной фазе и лишь небольшое количество радикалов, мигрирующих к поверхности не растворимого в воде мономера, оказывается использованным для полимеризации [8].
|
|||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 57; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.162.179 (0.004 с.) |