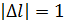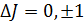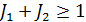Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Систематика энергетических уровней атомных частиц в приближении LS-связи
Энергетические уровни характеризуются набором квантовых чисел: n – главное квантовое число – определяет возможные значения энергии; l – орбитальное квантовое число – определяет форму электронного облака; m – магнитное квантовое число – характеризует ориентацию в пространстве орбитального момента импульса электрона; s – спин – собственный момент импульса электрона. При заданном значении l состояния электрона в порядке возрастания энергии принято нумеровать главным квантовым числом n, принимающим значения l +1, l +2,…. Надо отметить, что последовательность возрастания уровней энергии у сложных атомов иная, чем у атомов водорода. У атома водорода энергия E зависит только от n и не зависит от l, причем всегда En +1 > En. У сложных атомов часто имеет место другая последовательность уровней энергии – энергия электрона в состоянии n, l +2 больше, чем в состоянии n +1, l (En, l+ 2 > En +1, l). Как правило, энергия электрона тем больше, чем больше сумма n +l. О распределении электронов в атоме по состояниям с различными значениями n и l говорят как об электронной конфигурации. Приняты следующие спектроскопические обозначения одночастичных электронных состояний. По значению главного квантового числа n состояния обозначаются так:
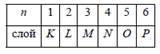
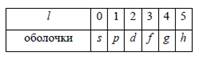
Слоем называют группу состояний с одинаковым n. Для обозначения состояний с разными значениями орбитального числа l использовали строчные латинские буквы, согласно таблице:
Оболочкой называют состояния с одинаковым l. В спектроскопических обозначениях квантовое число n записывается числом, а l – орбитальное квантовое число буквой согласно таблице. Например, запись 3 d означает, что n = 3 (М –слой) и l = 2 (d –оболочка). Число возможных состояний:
Применяется модель самосогласованного поля – каждый электрон движется в эффективном центрально симметричном поле, созданном ядром и отдельными электронами. Для каждого электрона, находящегося в произвольном центрально-симметричном поле, уравнение Шредингера имеет вид:
Помимо электростатического взаимодействия частиц существует также спин-орбитальное взаимодействие. Применяют три приближения. Приближение LS -связи – считают, что преобладает электростатическое взаимодействие. Приближение jj -связи – считают, что преобладает спин-орбитальное взаимодействие.
Приближение jL -связи – промежуточный, между LS и jj. С ростом атомного номера спин-орбитальное взаимодействие начинает преобладать над электростатическим. Электростатическое взаимодействие приводит к расщеплению уровней на подуровни. В приближении LS -связи применяют следующие характеристики: Полный орбитальный момент электронов:
Полный спин электронов:
У замкнутых электронных оболочек полный орбитальный момент и полный спин равны нулю.
Полный момент электронов:
Если Если
Правила отбора – правила, определяющие возможность оптических переходов: 1) 2) 3) Переходы четный-нечетный, нечетный-четный. 4) 5) 6) 7) Величина (2 s +1) называется мультиплетностью терма.
|
|||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 262; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.47.221 (0.007 с.) |
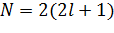
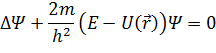
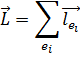
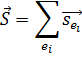
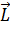 и
и 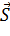 вызывают дополнительное (мультиплетное) расщепление.
вызывают дополнительное (мультиплетное) расщепление.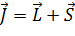
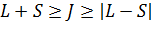
 , то имеется
, то имеется 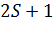 решений.
решений.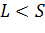 , то имеется
, то имеется 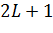 решений.
решений.