
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
К какому виду электродов относится платиновый электрод? Дайте определение этому виду электродов. Что собой представляет стандартный водородный электрод, чему равен его стандартный потенциал?
Платиновый электрод – индикаторный электрод; Индикаторный электрод – электрод, потенциал которого зависит от концентрации определяемого (потенциалопределяющего) вещества в анализируемом растворе; Водородный электрод ( газовый электрод) - представляет собой платиновую пластинку, покрытую платиновой чернью, на которую подается газообразный водород с давлением в 1 атм. Потенциал обратимо работающего газового водородного электрода определяется активностью ионов водорода, т.е. величиной рН раствора, и при комнатной температуре равен: E = E o + 0,059 lg a(H3O+) = 0,059 lg a(H3O+) = – 0,059 pH, Е0=0 (для водородного электрода);
41. Рассчитайте потенциал стеклянного электрода (E const = 0,350 В) в растворе с рН 4,0 относительно хлорсеребряного электрода сравнения (E o = 0,222 B). К какому виду электродов относится хлорсеребряный электрод? Опишите устройство хлорсеребряного электрода. Какую функцию в гальванической ячейке он чаще всего выполняет?
Хлорсеребряный электрод (электрод второго рода, обратимый по аниону) состоит из серебряной проволоки, покрытой малорастворимой в воде солью AgCl, погруженной в водный раствор хлорида калия. Электроды второго рода рассмотренного вида обладают высокой обратимостью и стабильны в работе, поэтому их часто используют в качестве электродов сравнения, способных устойчиво поддерживать постоянное значение потенциала.
И ТУТ ПОСЛЕДНЕЕ ДЕЙСТВИЕ: 0,114-0,222= - 0,108 Где 0,114 — ЭДС стекл. эл-да, 0,222 — хлорсеребр.
42. Потенциал стеклянного электрода в буферном растворе с рН 4,00 ра · К какому виду электродов относится стеклянный электрод? · Дайте определение этому виду электродов. · Какие процессы определяют потенциал этого вида электродов?
· Стеклянный электрод относится к электродам сравнения · Ионоселективные электроды (ИСЭ), чувствительные к катионам и анионам, представляют собой электрохимические системы, в которых потенциал определяется процессами распределения ионов между мембраной и раствором. · В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов; ионоселективные электроды могут быть обратимы как по катиону, так и по аниону. Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны ее потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны.
43. Навеску пробы массой 5,700 г, содержащую оксид мышьяка(III), растворили и оттитровали As(III) электрогенерированным иодом. На титрование затрачено 17 мин 20 с при силе тока 96,5 мА. Рассчитайте массовую долю оксида мышьяка(III) (М = 197,841 г/моль) в процентах в пробе. Число Фарадея 96500 Кл/моль. · Какой электрический параметр определяют в кулонометрическом анализе? · Какие процессы, протекающие на поверхности электрода, используют в кулонометрии. · Каково происхождение титранта?
t= 17*60+20=1040 c i= 96,5/1000=0,0965 A => Q= 0,0965*1040=100,36 Кл m = 100,36*197,841/ 96500*4 = 0,051 г W = 0,051*100/5,700= 0,89%
· Кулонометрический анализ заключается в определения количества электричества, расходуемого в ходе электрохимической реакции. Количество электричества Q равно произведению силы тока I на время его прохождения через раствор t: Q = I * t. · Чтобы обеспечить протекание электрохимической реакции, рабочий электрод электролитической ячейки должен быть электронообменным. При проведении анализа электроды ячейки помещают в раствор электролита, через который пропускают электрический ток. При этом катионы движутся к катоду (–), а анионы - к аноду (+). На катоде происходит полуреакция восстановления, а на аноде - полуреакция окисления ионов. Количественные расчеты в кулонометрии базируются на законах Фарадея, которые устанавливают зависимость между массой вещества, выделившегося при электролизе, и количеством электричества, прошедшего через электролитическую ячейку.
44. Для определения содержания фенола использовали кулонометрическое титрование по реакции бромирования. Для этого 100,0 мл пробы анализируемого раствора оттитровали электрогенерированным бромом. При силе тока 50,5 мА на титрование затрачено 10 мин 32 с. Рассчитайте содержание фенола (мкг/мл) в растворе, принимая его плотность равной 1 г/мл. М(фенола) = 94,11 г/моль, число Фарадея 96500 Кл/моль. · Какие разновидности имеет кулонометрический анализ. · Какой закон является теоретической основой метода? · Каков физический смысл числа Фарадея
n=6; i = 50,5/1000 = 0,0505; t = 10*60+32 = 632 c Q= 0,0505*632 = 31,916 Кл m= 31,916*94,11/6*96500 = 5,188*10^-3 г C (фенола) = (m(фенола)/V(пробы))*10^6= (5,188*10^-3/100)*10^6 = 51,88 мкг/мл
· Существует метод прямой и косвенной кулонометрии. Прямая кулонометрия. В прямой кулонометрии определяемое вещество реагирует непосредственно на поверхности электрода, поэтому этот метод пригоден для определения только электроактивных веществ. В методах косвенной кулонометрии определяемое вещество не участвует в реакции, протекающей непосредственно на электроде. В результате электрохимической реакции, проходящей на электроде, генерируется промежуточный реагент, который взаимодействует с определяемым веществом в объеме раствора. Косвенная кулонометрия применяется значительно чаще, чем прямая, как способ введения в раствор некоторого количества электричества, необходимого для осуществления титрования. · В их основе лежат законы Фарадея, которые формулируются следующим образом: 1. Масса вещества, выделившегося на электроде, прямо пропорциональна количеству электричества Q, прошедшего через электролит. 2. Массы различных веществ, выделенных или растворенных при прохождении одного и того же количества электричества, пропорциональны их электрохимическим эквивалентам. · Суть законов Фарадея заключается в том, что для превращения 1 грамм-эквивалента любого вещества необходимо пропустить через раствор одно и то же количество электричества. Эта величина, равная 96487 Кл/моль, была названа впоследствии постоянной Фарадея — F. F =
|
||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 984; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.229.113 (0.007 с.) |

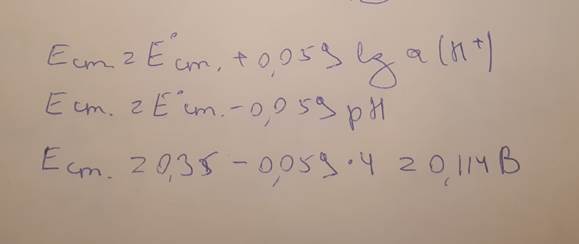
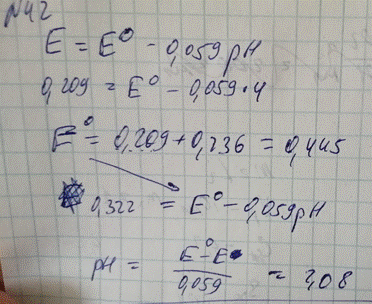 вен 0,209 В при 25оС. В растворе с неизвестным рН потенциал равен 0,322 В. Рассчитайте рН раствора.
вен 0,209 В при 25оС. В растворе с неизвестным рН потенциал равен 0,322 В. Рассчитайте рН раствора.





