Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные классы монофункциональных производных органических соединенийСтр 1 из 8Следующая ⇒
Тема: Алканы (предельные, насыщенные углеводороды) Простейшим представителем алканов служит метан СН4. Атом углерода находится в состоянии sp3 –гибридизации, образуя 4 одинаковые s-связи с атомами углерода. Начиная с метана, можно построить гомологический ряд, в котором каждый последующий углеводород отличается от предыдущего на одну группу - СH2 –, которая называется гомологическая разность. Общая формула гомологического ряда алканов СnН2n+2 Если от алкана отщепляется водород, образуется реакционно-способная частица, имеющая неспаренный электрон, которая называется радикал. Тема: Алкены (этиленовые углеводороды, непредельные, олефины) Общая формула гомологического ряда алкенов CnH2n. В отличие от предельных углеводородов, алкены содержат двойную связь С=С. В образовании такой связи участвуют атомы углерода в sp2-гибридизованном состоянии С=С: σ-связь и π-связь. Простейшие представители:
σ-Связи, образуемые sp2-гибридными орбиталями, находятся в одной плоскости под углом 120°. Поэтому молекула этилена имеет плоское строение:
По своей природе π-связь резко отличается от σ-связи: π-связь менее прочная вследствие меньшей эффективности перекрывания р-орбиталей. Номенклатура алкенов По международной номенклатуре ИЮПАК названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ен: 2 атома С → эт ан → эт ен;
Главная цепь углеродных атомов выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной). Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –ен. Например:
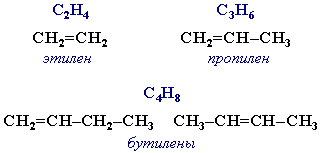
Для простейших алкенов применяются также исторически сложившиеся названия: этилен (этен), пропилен (пропен), бутилен (бутен-1), изобутилен (2-метилпропен) и т.п. В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкенов:
Изомерия алкенов Структурная изомерия алкенов 1. Изомерия углеродного скелета (начиная с С4Н8):
2. Изомерия положения двойной связи (начиная с С4Н8):
3. Межклассовая изомерия с циклоалканами, начиная с С3Н6:
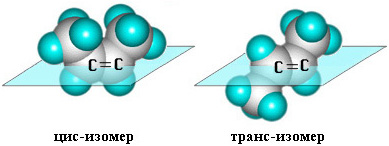
Пространственная изомерия алкенов Цис -транс-изомерия обусловлена наличием в молекуле двойной связи, когда у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости π-связи Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения π-связи (π-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется. Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы -СН3 могут находиться либо по одну сторону от двойной связи – это цис-изомер; либо по разные стороны – это транс -изомер:
Цис-транс -изомерия не проявляется, если хотя бы один из атомов С при двойной связи имеет 2 одинаковых заместителя. Физические свойства алкенов По физическим свойствам алкены мало отличаются от алканов с тем же числом атомов углерода в молекуле. Низшие гомологиС2—С4 при нормальных условиях — газы,С5—С17 — жидкости, высшие гомологи — твердые вещества. Алкены нерастворимы в воде, хорошо растворимы в органических растворителях.
Способы получения алкенов
1) Крекинг алканов. Крекинг алканов является важнейшим промышленным способом получения алкенов из высококипящих фракций нефти. Под действием сильного нагревания (до 700 °С) в молекулах алканов гомолитически расщепляются s-связи С—С, при этом образуется смесь низкомолекулярных алканов и алкенов:
2) Реакции элиминирования. Эта группа реакций лежит в основе большинства способов получения алкенов. 3) Дегидрогалогенирование происходит при действии спиртовых растворов щелочей на моногалогениды, согласно правила Зайцева.
4) Дегидратация спиртов (происходит при нагревании спиртов с серной кислотой)
5) Дегалогенирование (происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с двухвалентными металлами) 6) Дегидрирование алканов ( проводят при 500 °С в присутствии катализатора)
Химические свойства алкенов Определяются наличием в их молекулах двойной связи. Электронное облако π -связи подвергается атаке электрофильными агентами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения. 1) Гидрогалогенирование. При взаимодействии алкенов с галогеноводородами (НСl, НВr) образуются галогеналканы, причем если исходный алкен несимметричен, то реакция протекает по правилу Марковникова.
2) Гидратация.
При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Присоединение воды идет по правилу Марковникова. 3) Галогенирование. При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь: 4) Окисление. · При окислении алкенов перманганатом калия КMnO4 в нейтральной или щелочной среде окрашенный раствор перманганата калия быстро обесцвечивается (буреет). Эта реакция также является качественной на двойную связь (р. Вагнера).
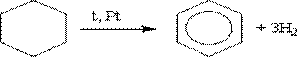
· При окислении перманганатом калия в кислой среде или хромовой смесью происходит полный разрыв двойной связи с образованием карбоновых кислот. 5) Восстановление (гидрирование). Эта реакция протекает в присутствии катализатора — мелко раздробленного никеля, платины или палладия — при комнатной температуре:
6) Реакции полимеризации. 7) Изомеризация алкенов Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3). Изомеризация алкенов приводит или к перемещению π–связи:
или к перестройке углеродного скелета:
Применение алкенов Этилен применяется для получения этилового спирта, полиэтилена, политетрафторэтилена (тефлона), уксусного альдегида, галогенопроизводных и многих других органических соединений. Он ускоряет созревание плодов (помидоров, цитрусовых и др.) при введении небольших количеств его в воздух теплиц. Этилен и его гомологи используются как химическое сырье для синтеза полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ. Тема 2.4 Алкадиены (диены) Алкадиены – класс непредельных алифатических углеводородов, содержащих две двойные связи в молекуле. Общая формула гомологического ряда алкадиенов СnН2n-2.
Номенклатура алкадиенов По правилам международной номенклатуры ИЮПАК главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода), в которых последняя буква «н» заменяется на суффикс –диен. Заместители в цепи указывают в начале названия, а местоположение двойных связей – в конце.
Классификация алкадиенов: 1. Диены с кумулированными двойными связями - две двойные связи расположены у одного атома углерода; (неустойчивы). СН2 = С = СН2 (аллен)
2. Диены с изолированными двойными связями – двойные связи разделены двумя и более одинарными связями; (свойства как у алкенов).
СН2=СН–СН2–СН=СН2
3. Диены с сопряженными двойными связями - две двойные связи разделены одной одинарной; (особые свойства).
СН2= СН—СН = СН2.
Эти соединения широко используются в производстве для получения синтетических каучуков и других органических веществ. Изомерия сопряженных диенов Структурная изомерия 1. Изомерия положения сопряженных двойных связей:
2. Изомерия углеродного скелета:
3. Межклассовая изомерия с алкинами и циклоалкенами. Например, формуле С4Н6 соответствуют следующие соединения:
Пространственная изомерия Диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис - транс -изомерию.
Номенклатура алкинов По систематической (международной) номенклатуре ИЮПАК названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ин: 2 атома С → эт ан → эт ин; 3 атома С → проп ан → проп ин и т.д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь (т.е. она может быть не самой длинной). Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение тройной связи, ставится обычно после суффикса –ин. Например:
Изомерия алкинов Структурная изомерия 1. Изомерия положения тройной связи (начиная с С4Н6):
2. Изомерия углеродного скелета (начиная с С5Н8):
3. Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
Пространственная изомерия в алкинах относительно тройной связи не проявляется, т.к. заместители могут располагаться только одним способом – вдоль линии связи. Способы получения алкинов Ацетилен и его гомологи являются важнейшими исходными продуктами в производстве многих органических веществ и материалов. Их получают в больших количествах, используя ряд промышленных и лабораторных методов: 1. Пиролиз метана:
2. Пиролиз этана или этилена:
3. Гидролиз карбида кальция:
4. Дегидрогалогенирование дигалогеналканов спиртовым раствором щелочи (щелочь и спирт берутся в избытке):
5. Удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами:
Физические свойства алкинов Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2Н2 - С4Н6 – газы, С5Н8 - С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов. Алкины плохо растворимы в воде, лучше – в органических растворителях. Химические свойства алкинов Свойства алкинов сходны со свойствами алкенов, что обусловлено их ненасыщенностью, поэтому для них характерны реакции электрофильного присоединения. Примеры реакций присоединения к алкинам: 1. Гидрирование В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая π-связь), а затем алканов (разрывается вторая π-связь):
2. Галогенирование Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая π-связь разрывается труднее, чем вторая):
Алкины обесцвечивают бромную воду (качественная реакция на кратную связь). 3. Гидрогалогенирование Присоединение к несимметричным алкинам определяется правилом Марковникова:
Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида:
Винилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ). Особые реакции алкинов 1. Гидратация (реакция Кучерова): Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена):
или в кетон (в случае других алкинов):
2. Полимеризация: - Димеризация под действием водно-аммиачного раствора CuCl:
- Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
3. Образование солей: Замещение атома водорода у углерода с тройной связью на металл, проявление слабокислотных свойств; при этом образуются соли - ацетилениды:
При взаимодействии ацетилена (или R–C≡C–H) с аммиачными растворами оксида серебра или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:
Образование серовато-белого осадка ацетиленида серебра (или красно-коричневого – ацетиленида меди RC≡CCu) служит качественной реакцией на концевую тройную связь. Если тройная связь находится не на конце углеродной цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются:
4. Окисление алкинов: · При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
· Мягкое окисление без разрыва σ-связи С–С происходит при действии разбавленного раствора перманганата калия, который при этом обесцвечивается. Данная реакция доказывает ненасыщенность алкинов и является качественной на кратную связь, в этих условиях из ацетилена образуется щавелевая кислота:
· Полное окисление алкинов происходит при их сгорании до CO2 и H2O. Горение ацетилена сопровождается выделением большого количества тепла (Q = 1300 кДж/моль):
Температура ацетиленово-кислородного пламени достигает 2800-3000 °С. На этом основано применение ацетилена для сварки и резки металла. Ацетилен образует с воздухом и кислородом взрывоопасные смеси. Применение алкинов Ацетилен используется для получения самых разнообразных веществ: для синтеза винилхлорида, являющегося мономером для получения высокомолекулярного продукта – поливинилхлорида; для получения винил ацетилена – важного промежуточного продукта в производстве синтетического хлоропренового каучука; для производства уксусного альдегида, из которого получают уксусную кислоту; а также для автогенной сварки. Схема реакции получения хлоропренового каучука из винилацетилена:
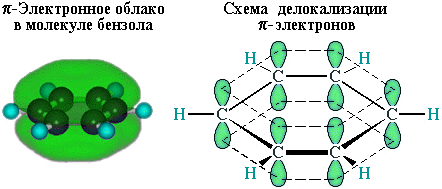
Строение бензола Бензол С6Н6 – родоначальник ароматических углеводородов.
р-электроны всех атомов углерода взаимодействуют между собой путем бокового перекрывания соседних 2р-АО, расположенных перпендикулярно плоскости σ-скелета бензольного кольца. Они образуют единое циклическое π-электронное облако, сосредоточенное над и под плоскостью кольца.
Все связи С–С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф.Кекуле), а все они выровнены (делокализованы). Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (σ-скелет) и кружка внутри него, обозначающего делокализованные π-связи.
Номенклатура аренов Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R):
Широко используются тривиальные названия (толуол, ксилол, кумол и т.п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень):
Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими. Дизамещенные производные существуют в виде трех изомеров, различающихся взаимным расположением заместителей. Положение заместителей указывают цифрами или приставками: 1,2 или орто- (о-); 1,3 или мета- (м-); 1,4 или пара- (п-).
Ароматические одновалентные радикалы имеют общее название " арил ". Из них наиболее распространены в номенклатуре органических соединений два: C6H5 - (фенил) и C6H5CH2 - (бензил). Изомерия аренов Структурная:
3) изомерия заместителей R, начиная с R = -С2Н5. Молекулярной формуле С8Н10 соответствуют 4 изомера: Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует. Способы получения аренов.
1.Дегидроциклизация — получение из алифатических углеводородов. При пропускании алканов с неразветвленной цепью, имеющих не менее шести атомов углерода в молекуле, над нагретой платиной или оксидом хрома происходит образование арена с выделением водорода:
2. Дегидрирование циклоалканов. Реакция происходит при пропускании паров циклогексана и его гомологов над нагретой платиной:
3. Сплавление солей ароматических кислот со щелочью: Физические свойства аренов Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом, нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях, они легче воды, огнеопасны. Бензол токсичен (поражает почки, печень, костный мозг, кровь). Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах. Химические свойства аренов. Особенностями строения бензольного кольца объясняется отличие химических свойств аренов от предельных и непредельных углеводородов. Делокализация шести π-электронов в циклической системе понижает энергию молекулы, что обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов. Для аренов более характерны реакции, идущие с сохранением ароматической системы, а именно, реакции замещения атомов водорода, связанных с циклом. Наличие областей повышенной электронной плотности с двух сторон плоского ароматического цикла ведет к тому, что бензольное кольцо является нуклеофилом и в связи с этим склонно подвергаться атаке электрофильным реагентом. Таким образом, для ароматических соединений наиболее типичны реакции электрофильного замещения. Для аренов возможны и другие реакции (присоединение, окисление). В них участвуют делокализованные углерод-углеродные связи бензольного кольца и нарушается его ароматичность, поэтому они протекают с трудом, при особых условиях.
Примеры реакций электрофильного замещения в бензоле: 1. Галогенирование Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, AlBr3, FeCl3 и т.п. (кислот Льюиса):
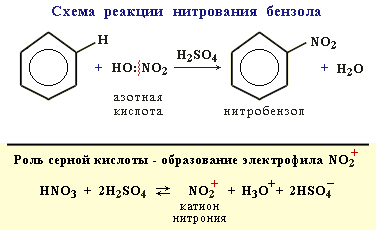
2. Нитрование Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
3. Алкилирование Замещение атома водорода в бензольном кольце на алкильную группу(алкилирование) происходит под действием алкилгалогенидов (реакция Фриделя-Крафтса) в присутствии катализаторов AlCl3, AlBr3, FeCl3 (кислот Льюиса).
Замещение в алкилбензолах Гомологи бензола (алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом. Например, при нитровании толуола С6Н5CH3 может происходить замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
Взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет + I -эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6:
и облегчает замещение именно в этих положениях. Заместители в бензольном кольце делятся на 2 группы: · ориентанты 1 рода (-R, -Hal, -OH) направляют заместители в орто- и пара-положения, · ориентанты 2 рода (-NO2,-COOH, SO3 H) направляют заместители в мета-положение. С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4. Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании):
Легче, чем в алканах, протекают реакции радикального замещения в боковой цепи алкилбензолов:
Применение аренов. Бензол С6Н6 используется как исходный продукт для получения различных ароматических соединений – нитробензола, хлорбензола, анилина, фенола – исходного вещества для получения фенолформальдегидных смол; стирола – мономера полистирола и т.д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ. Толуол С6Н5–СН3 применяется в производстве красителей, лекарственных и взрывчатых веществ (тротил, тол). Ксилолы С6Н4(СН3)2 в виде смеси трех изомеров (орто -, мета - и пара -ксилолов) применяются как растворитель и исходный продукт для синтеза многих органических соединений. Изопропилбензол (кумол) С6Н4СН(СН3)2 – исходное вещество для повещество для получения фенола и ацетона. Винилбензол (стирол) C6H5-CН=СН2 используется для получения ценного полимерного материала полистирола.
Контрольнае вопросы к разделу «Углеводороды»
Основные классы монофункциональных производных органических соединений
Номенклатура органических соединений. - Тривиальная – названия связаны с источником получения или другого происхождения (муравьиная, уксусная молочная кислоты, ацетон и др.) - Рациональная – соединение рассматривается как производное от простейшего представителя данного класса при замещении водорода у него на радикалы или на неуглеродные атомы или группы атомов. - Международная (систематическая) ИЮПАК: Для построения названия в первую очередь определяют тип характеристической группы (если она присутствует). Характеристическая группа — это функциональная группа, связанная с родоначальной структурой. Когда характеристических групп в соединении несколько, то выделяют старшую характеристическую группу. Для характеристических групп условно установлен порядок старшинства. В таблице эти группы приведены в порядке убывания старшинства. Затем определяют родоначальную структуру, в которую обязательно должна входить старшая характеристическая группа. Префиксы и суффиксы для обозначения некоторых характеристических групп:
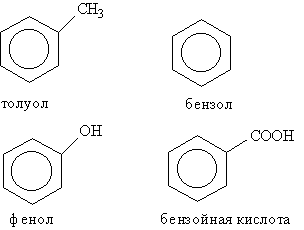
* Атом углерода, заключенный в скобки, входит в состав главной углеродной цепи. Как видно из таблицы, некоторые характеристические группы, а именно галогены, нитро- и алкоксигруппы, отражаются в общем названии только в виде префиксов, например бромметан, этоксиэтан, нитробензол. Нумерацию атомов углерода в главной цепи начинают с того конца цепи, ближе к которому расположена старшая группа. Если таких возможностей оказывается несколько, то нумерацию проводят таким образом, чтобы либо кратная связь, либо другой заместитель, имеющийся в молекуле, получили наименьший номер. В карбоциклических соединениях нумерацию начинают от того атома углерода, при котором находится старшая характеристическая группа. Если при этом невозможно выбрать однозначную нумерацию, то цикл нумеруют так, чтобы заместители имели наименьшие номера. В группе циклических углеводородов особо выделяются ароматические углеводороды, для которых характерно наличие в молекуле бензольного кольца. Некоторые широко известные представители ароматических углеводородов иих производных имеют тривиальные названия, использование которых разрешено правилами ИЮПАК: бензол, толуол, фенол, бензойная кислота.
Радикал С6Н5-, образованный из бензола, называется фенил, а не бензил. Бензилом называют радикал С6Н5СН2-, образованный из толуола.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 142; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.122.4 (0.151 с.) |

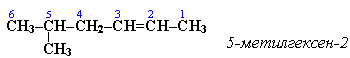
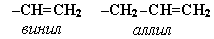













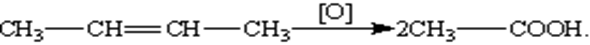
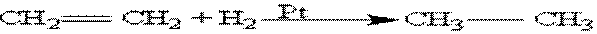

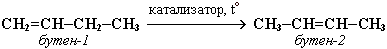




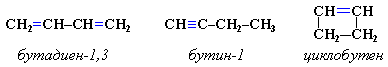

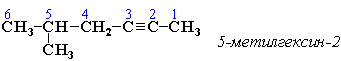





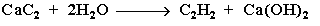
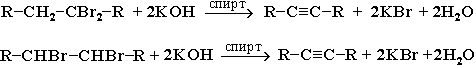


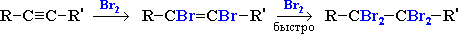












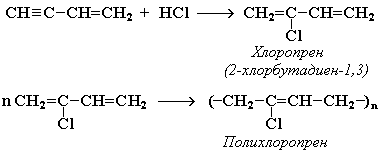
 Каждый из шести атомов углерода в его молекуле находится в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой π-связей равны 120°. Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости:
Каждый из шести атомов углерода в его молекуле находится в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой π-связей равны 120°. Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости: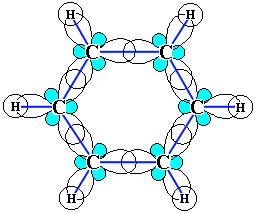




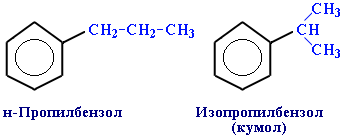
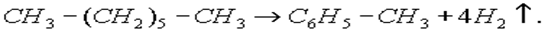

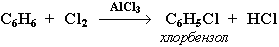

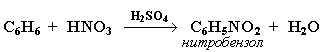
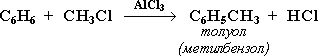

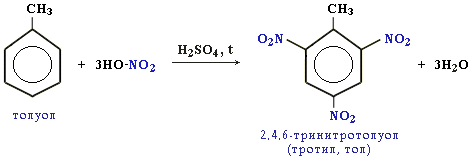



 -OH
-SH
- NH2
-OH
-SH
- NH2