Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Получение и применение муравьиного альдегида.
1. Окисление метанола.
2. Окисление метана.
Формальдегид используется для получения фенолформальдегидных и карбамидных смол и пластмасс на их основе, для получения лекарств, для дубления кожи, для хранения биологических препаратов. Получение и применение уксусного альдегида. 1. В лаборатории а) окисление этанола дихроматомкалия
б)окисление этанола оксидом меди
2. В промышленности. а) реакция Кучерова
б) окисление этилена
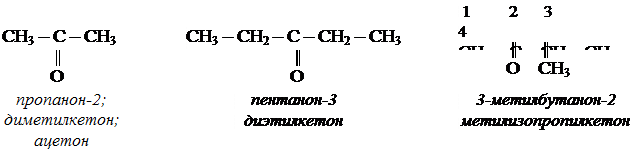
Ацетальдегид используется для получения уксусной кислоты, этанола, в органическом синтезе. КЕТОНЫ. Кетонами называют органические вещества, в молекулах которых карбонильная группа ( Изомерия и номенклатура кетонов.
Применение кетонов. Кетоны широко применяются в качестве растворителей и сырья для производства ядохимикатов, лекарственных препаратов, полимеров. АЛЬДЕГИДЫ. (самостоятельная работа) Вариант 1. 1. Составьте уравнения реакций по схеме: С2Н6 → С2Н4 → С2H5Cl → С2H5OH → С2H5 – O – СH3 2. Составьте уравнения реакций, подтверждающих химические свойства масляного альдегида. ТЕМА: ОДНООСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ. Предельными одноосновными карбоновыми кислотами называют органические соединения, содержащие карбоксильную группу – СООН, связанную с углеводородным радикалом. R – СООН – общая -формула одноосновных карбоновых кислот Гомологический ряд одноосновных карбоновых кислот. Предельные углеводороды |
Карбоновые кислоты | |||||
| СН4 | метан | Н – СООН | муравьиная, метановая | ||||
| С2Н6 | этан | СН3 – СООН | уксусная, этановая | ||||
| С3Н8 | пропан | С2Н5 – СООН | пропионовая, пропановая | ||||
| С4Н10 | бутан | С3Н7 – СООН | масляная, бутановая | ||||
| С5Н12 | пентан | С4Н9 – СООН | валериановая, пентановая | ||||
| С6Н14 | гексан | С5Н11 – СООН | капроновая, гексановая | ||||
Физические свойства.
Молекулы карбоновых кислот подобно спиртам могут образовывать водородные связи друг с другом и с молекулами воды. С возрастанием молекулярной массы растворимость карбоновых кислот в воде падает.
Высшие кислоты в воде практически нерастворимы.
Кислоты с число атомов углерода в молекуле от 1 до 9 при комнатной температуре-жидкости с неприятным, раздражающим запахом. Высшие карбоновые кислоты запаха не имеют.
|
|
Химические свойства.
1. Кислотные свойства:
а) диссоциация
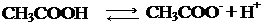
б)с металлами
2СН3СООН + Mg → (CH3COO)2Mg + H2
в) с основными оксидами
2СН3СООН + MgO → (CH3COO)2Mg + H2O
г) с основаниями
СН3СООН + NaOH → CH3COONa + H2O
д) с солями
2СН3СООН + CaCO3 → (CH3COO)2Ca + H2O + CO2
2. Реакция этерификации.

3. Реакции по углеводородному радикалу.
СН3 – СООН + Cl2 → Cl – CH2 – COOH + HCl
хлоруксусная кислота




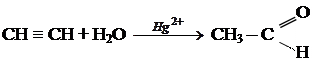
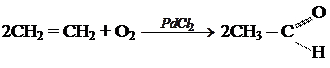
 )связана с двумя углеводородными радикалами.
)связана с двумя углеводородными радикалами.