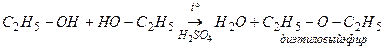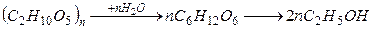Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел 2 «органическая химия»Стр 1 из 6Следующая ⇒
Конспект лекций по дисциплине «Химия»
РАЗДЕЛ 2 «ОРГАНИЧЕСКАЯ ХИМИЯ»
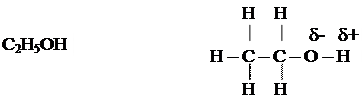
ТЕМА: КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА. Предельные одноатомные спирты. Этиловый спирт. 1. Строение молекулы.
2. Физические свойства. Жидкость, бесцветная, прозрачная, с характерным запахом, смешивается с водой в любых соотношениях, обладает наркотическим действием. Температура кипения 78,4ºС. 3. Химические свойства. 3.1 горение С2Н5ОН + 3О2 → 2СО2 + 3Н2О 3.2 взаимодействие с металлическим натрием 2С2Н5ОН + 2Na → 2 С2Н5ОNa + 2H2 этилат натрия 3.3 взаимодействие с кислотами С2Н5ОН + HBr → С2Н5Br + H2O бромэтан 3.4дегидратация а) образование этилена
б) образование диэтилового эфира
4. Получение этилового спирта. 4.1 брожение глюкозы. С6Н12О6 → 2С2Н5ОН + 2СО2 4.2 из крахмала и целлюлозы
4.3 получение синтетического этилового спирта С2Н4 + Н2О → С2Н5ОН t = 280º – 300ºC P = 7-8 МПа Катализатор Н3РО4
5. Применение этилового спирта. Для получения бутадиенового каучука, в медицине, в парфюмерии, в лакокрасочной промышленности, в авиации, для приготовления спиртных напитков, для производства уксусной кислоты.
6. Действие этилового спирта на организм. Борьба с алкоголизмом. Гомологический ряд предельных одноатомных спиртов. Одноатомные спирты - органические вещества, молекулы которых содержат одну гидроксильную группу, соединенную с углеводородным радикалом. R - ОН общая формула одноатомных спиртов. Предельные углеводороды | одноатомные спирты | |||||
| СН4 | метан | СН3ОН | метиловый,метанол | ||||
| С2Н6 | этан | С2Н5ОН | этиловый, этанол | ||||
| С3Н8 | пропан | С3Н7ОН | пропиловый, пропанол | ||||
| С4Н10 | бутан | С4Н9ОН | бутиловый, бутанол | ||||
| С5Н12 | пентан | С5Н11ОН | амиловый, пентанол | ||||
| С6Н14 | гексан | С6Н13ОН | гексиловый, гексанол | ||||
Изомерия и номенклатура спиртов.
Дляспиртов возможна два вида изомерии: изомерия положения гидроксильной группы и изомерия углеродного скелета.
В соответствии с правилами номенклатуры ИЮПАК выбирают самую длинную цепь атомов углерода и нумеруют ее с того конца, к которому ближе гидроксильная группа. Окончанием -ОЛ и цифрой после названия указывают наличие гидроксильной группы.
|
|
Химические свойства одноатомных спиртов.
1. взаимодействие с активными металлами
2R–OH + 2Na → 2R–ONa + H2↑
алкоголет натрия
2.взаимодействие с кислотами
R–OH + HCl → R – Cl + H2O
галогенпроизводные
3. взаимодействие с другими спиртами
R1–OH + НО – R2 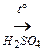 R1 – O–R2 + H2O
R1 – O–R2 + H2O
простой эфир
Общие способы получения спиртов.
1.гидратация этиленовых углеводородов

2. гидролиз галогенпроизводных
СН3Cl + NaOH → CH3OH + NaCl
Простые эфиры.
Простые эфиры - органические вещества, в молекулах которых два углеводородных радикала соединены через атом кислорода.
R1–O–R2 – общая формула простых эфиров
Простые эфиры образуются при взаимодействии молекул одного и того же спирта или различных спиртов при нагревании в присутствии серной кислоты.
ОДНОАТОМНЫЕ СПИРТЫ.
(самостоятельная работа)
Вариант 1.
1. Составьте уравнения реакций, протекающих при нагревании смеси метанола и бутанола в присутствии серной кислоты.
2. Составьте формулы по названиям:
2-метил-3-этилгексанол-2
ТЕМА: МНОГОАТОМНЫЕ СПИРТЫ.
1. Отдельные представители. Номенклатура
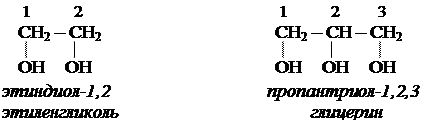
2. Физические свойства этиленгликоля и глицерина.
Этиленгликоль и глицерин бесцветные, прозрачные сиропообразные жидкости. Растворимы в воде, вкус сладкий. Этиленгликоль ядовит.
3. Химические свойства.
Многоатомными спиртам называют производные предельных углеводородов, в молекулах которых содержатся две или более гидроксильные группы.
Свойства многоатомных спиртов сходны со свойствами одноатомных. В реакцию может вступать одна или несколько гидроксильных групп.
Многоатомные спирты реагируют с щелочными металлами с выделением водорода, вступают в реакции замещения с галогеноводородами.
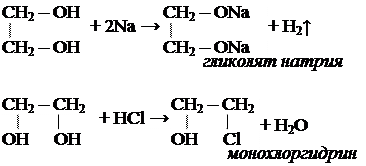
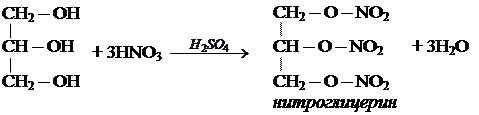
Многоатомные спирты могут образовывать сложные эфиры по всем гидроксильным группам.
ФЕНОЛ.
Фенолами называют производные ароматических углеводородов, в которых один или несколько атомов водорода бензольного кольца замещены на гидроксильные группы.
1. Строение молекулы фенола.

2. Физические свойства.
Фенол - твердое кристаллическое вещество, в результате окисления на воздухе имеет красный цвет, плохо растворяется в холодной воде, лучше в горячей. Ядовит.
|
|
3. Химические свойства.
3.1 Кислотные свойства.
2С6Н5ОН + 2Na → 2С6Н5ОNa + H2↑

3.2 Реакции электрофильного замещения.
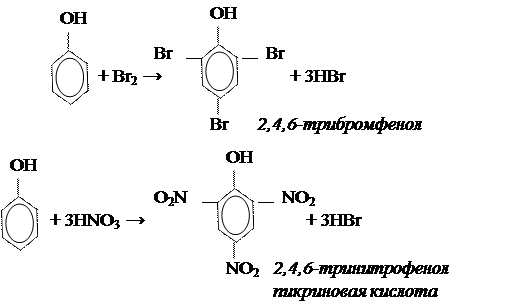
3.3 Качественная реакция на фенол.
Реактивом на фенол является хлорид железа (3). Результат реакции -фиолетовое окрашивание.
4. Получение фенола.
4.1 Большое количество фенола выделяют из каменноугольной смолы.
4.2 Кумольный способ.

4.3 Получение из бензола.
С6Н6 + Сl2  С6Н5Сl + HCl
С6Н5Сl + HCl
С6Н5Сl + NaOH  С6Н5OH + NaCl
С6Н5OH + NaCl
5. Применение фенола.
Фенол используют для получения фенолоформальдегидных смол, пластмасс, синтетических волокон, красителей, лекарственныхи взрывчатых веществ.
Упражнение.
Составьте уравнения реакций посхеме
СH4 → С2Н2 → С6Н6 → С6H5Cl → С6H5OH
Задача. Сколько мл азотной кислоты (плотность 1,4) с массовой долей НNO3 68 %вступит в реакцию с фенолом для получения 22,9 г 2,4,6-тринитрофенола?
МНОГОАТОМНЫЕ СПИРТЫ.
(самостоятельная работа)
Вариант 1.
1. Составьте формулы по названиям:
а) 3-метилбутантриол-1,2,4.
б) 2,3-диэтилпентандиол-1,5
2. Из 156 кг бензола получили 200 кг хлорбензола. Вычислить выход хлорбензола в %от теоретически возможного.
3. Составьте уравнения реакций по схеме:
С4H10 → С4Н8 → С4Н9Cl → С4H9OH
ТЕМА: АЛЬДЕГИДЫ.
Альдегидами называют органические соединения, содержащие альдегидную группу  связанную о углеводородным радикалом.
связанную о углеводородным радикалом.
Предельные углеводороды
Альдегиды

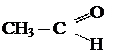
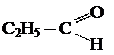



 общая формула альдегидов
общая формула альдегидов
1. Физические свойства.
Муравьиный альдегид - газ, остальные низшие альдегида - жидкости с резким запахом хорошо растворимые в воде.
2. Химические свойства.
2.1. Гидрирование
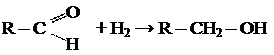
2.2 Реакции окисления:
а) сильными окислителями

б) реакция "серебряного зеркала"

в) окисление гидроксидом меди
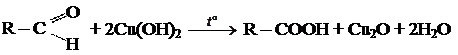
КЕТОНЫ.
Кетонами называют органические вещества, в молекулах которых карбонильная группа ( )связана с двумя углеводородными радикалами.
)связана с двумя углеводородными радикалами.
Применение кетонов.
Кетоны широко применяются в качестве растворителей и сырья для производства ядохимикатов, лекарственных препаратов, полимеров.
АЛЬДЕГИДЫ.
(самостоятельная работа)
Вариант 1.
1. Составьте уравнения реакций по схеме:
С2Н6 → С2Н4 → С2H5Cl → С2H5OH → С2H5 – O – СH3
2. Составьте уравнения реакций, подтверждающих химические свойства масляного альдегида.
Предельные углеводороды
Карбоновые кислоты
Физические свойства.
Молекулы карбоновых кислот подобно спиртам могут образовывать водородные связи друг с другом и с молекулами воды. С возрастанием молекулярной массы растворимость карбоновых кислот в воде падает.
|
|
Высшие кислоты в воде практически нерастворимы.
Кислоты с число атомов углерода в молекуле от 1 до 9 при комнатной температуре-жидкости с неприятным, раздражающим запахом. Высшие карбоновые кислоты запаха не имеют.
Химические свойства.
1. Кислотные свойства:
а) диссоциация
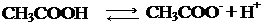
б)с металлами
2СН3СООН + Mg → (CH3COO)2Mg + H2
в) с основными оксидами
2СН3СООН + MgO → (CH3COO)2Mg + H2O
г) с основаниями
СН3СООН + NaOH → CH3COONa + H2O
д) с солями
2СН3СООН + CaCO3 → (CH3COO)2Ca + H2O + CO2
2. Реакция этерификации.

3. Реакции по углеводородному радикалу.
СН3 – СООН + Cl2 → Cl – CH2 – COOH + HCl
хлоруксусная кислота
ВЫСШИЕ КАРБОНОВЫЕ КИСЛОТЫ
С15Н31СООН – пальмитиновая кислота
С17Н35СООН – стеариновая кислота
С17Н33СООН – олеиновая кислота
С17Н31СООН – линолевая кислота
Высшие карбоновые кислоты вступают в те же реакции, чтои другие кислоты.
Соли высших карбоновых кислот называются мылами.
Мыла.
Мыла - соли высших карбоновых кислот.
1. Моющие мыла.
С17Н35СООNa – твердое мыло
С17Н35СООK –жидкое мыло
Мыла проявляют свойства солей, то есть реагируют с кислотами, щелочами и растворами других солей, а также подвергаются гидролизу.
СЛОЖНЫЕ ЭФИРЫ.
Производные карбоновых кислот, в которых атомы водорода карбоксильной группы замещены на углеводородные радикалы, называют сложными эфирами.
Общая формула сложных эфиров 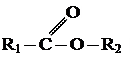
Физические свойства.
Сложные эфиры низших карбоновых кислот представляют собой летучие жидкости, многие из которых обладают приятным фруктовым или цветочным запахом. Они практически нерастворимы в воде.
Получение сложных эфиров.
В основе получения сложных эфиров лежит реакция этерификации между карбоновой кислотой и спиртом. Реакция катализируется сильными кислотами.

Химические свойства.
1. гидролиз

2. горение
2CH3 – CО – O – СH3 + 7О2 → 6СО2 + 6 H2O
уксуснометиловый эфир
ЖИРЫ
Жирами называют сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот.

1. Животные жиры.
Животные жиры обычно твердые вещества (исключение - рыбий жир). Животные жиры используются в пищу и для получения твердого мыл.
2. Растительные жиры (масла).
Растительные жиры обычно жидкие (исключение - пальмовое масло). Растительные жиры используются в пищу, для получения маргарина, для получения олифы.
Самостоятельная работа на тему
«КАРБОНОВЫЕ КИСЛОТЫ»
|
|
Вариант 1.
1. Составьте уравнения реакций по схеме:

ТЕМА: УГЛЕВОДЫ.
1. Моносахариды (глюкоза, фруктоза) - гидролизу не подвергаются.
2. Дисахарида (сахароза, лактоза) – при гидролизе образуют две молекулы моносахаридов.
3. Полисахарида (крахмал, целлюлоза) – при гидролизе образуют много молекул моносахаридов.
ГЛЮКОЗА
1. Физические свойства.
Твердое, белое f кристаллическое вещество, вкус сладкий, растворима в воде.
2. Строение молекулы.
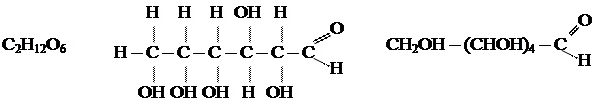
Глюкоза - альдегидоспирт.
3. Химические свойства.
3.1 Глюкоза как многоатомный спирт реагирует без нагревания с гидроксидом меди, при этом образуется темно-синий раствор глюконата меди.
3.2 Реакции по альдегидной группе.
а) реакция «серебряного зеркала»
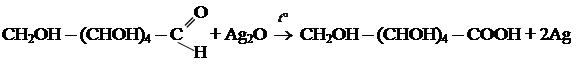
б) с гидроксидом меди
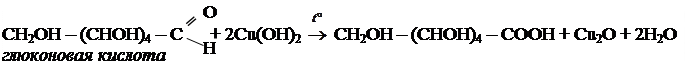
3.3 Брожение глюкозы.
а) спиртовое
С6Н12О6 → 2С2Н5ОН + 2СО2↑
б)молочнокислое

в) маслянокислое
С6Н12О6 → С3Н7СООН + 2СО2↑ + 2Н2↑
3.4 Полное окисление глюкозы.
С6Н12О6 + 6О2 → 2СО2 + 6Н2О
4. Получение и применение глюкозы.
(С6Н10О5)n + nН2О → nС6Н12О6
крахмал
Глюкоза используется в медицине, для получения этанола, при изготовлении зеркал.
ФРУКТОЗА.
Фруктоза является изомером глюкозы.

Фруктоза - кетоноспирт. Вместе с глюкозой входит в состав меда, имеет более сладкий вкус, чем глюкоза.
Задача. Сколько литров раствора этанола (плотность 0,79) с массовой долей С2Н5OH 95 %получится при спиртовом брожении 36 кг глюкозы?
САХАРОЗА.
Физические свойства.
Сахароза - твердое, белое, кристаллическое вещество, растворима в воде, вкус сладкий.
Сахароза в природе.
Сахароза входит в состав сока многих растении. Например, в соке сахарного тростника ее 14-16 %, а в соке сахарной свеклы 16-21 %.
Химические свойства.
1. Гидролиз.
С12Н22О11 + Н2О  С6Н12О6 + С6Н12О6
С6Н12О6 + С6Н12О6
глюкоза фруктоза
2. Сахароза как многоатомный спирт реагирует с гидроксидом меди, при этом образуется: ярко-синий раствор сахарата меди.
3. Сахароза реагирует с гидооксидом калция. Это свойство лежит в основе получения сахара их свеклы и его дальнейшей очистки.
С12Н22О11 + 2СА(ОН)2 → С12Н22О11 · 2СаО + Н2О
сахарат кальция
С12Н22О11 · 2СаО + 2СО2 → С12Н22О11 + 2 СаСО3↓
Применение сахарозы.
Сахароза используется в кондитерском производстве и для получения, этилового спирта.
Задача. Сколько тонн сахарной свеклы с массовой долей сахарозы 20 %будет подвергнуто гидролизу для получения глюкозы массой 1т?
КРАХМАЛ.
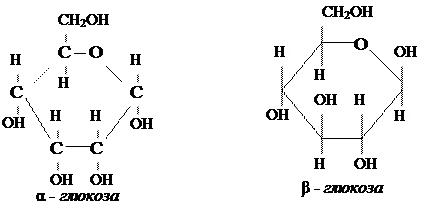
Крахмал - природный полимер, макромолекулы которого состоит из остатков α-глюкозы и имеют в основном разветвленное строение.
Физические свойства.
Крахмал - твердое, белое, аморфное вещество без вкуса и запаха. Крахмал нерастворим в холодной воде, в горячей воле образует коллоидный раствор (клейстер).
Крахмал в природе.
Крахмал является одним из продуктов фотосинтеза и поэтому широко распространена в природе. Зерна риса содержат до 86 %крахмала, пшеницы до 75 %, кукурузы - до 72 %. Вклубнях картофеля содержание крахмала достигает 24 %.
|
|
Химические свойства.
1. Гидролиз
(С6Н10О5)n + nН2О  nС6Н12О6
nС6Н12О6
2. Качественная реакция на крахмал.
Реактивом на крахмал является раствор йода. Результат реакции - синее окрашивание.
Применение крахмала.
Крахмал является одним из важнейших компонентов пищи. Значительное количество крахмала перерабатывается на патоку, глюкозу, пищевой спирт, молочную кислоту. Крахмал используют в текстильной промышленности дляотделки тканей.
Задача. Какую массу кукурузных зерен надо взять для получения спирта массой 115 кг, с массовой долей C2H5OH 96 %, если массовая доля крахмала в кукурузных зернах составляет 70 %?
ЦЕЛЛЮЛОЗА (КЛЕТЧАТКА).
Целлюлоза - природный полимер, макромолекулы которого состоят из остатков /3 -глюкозы и имеют линейное строение.
Физические свойства.
Целлюлоза - твердое, белое, аморфное вещество без вкуса и запаха. Она нерастворима в воде и органических растворителях, но растворима в аммиачном растворе сульфата меди.
Химические свойства.
1. Гидролиз
(С6Н10О5)n + nН2О  nС6Н12О6
nС6Н12О6
2. Образование сложных эфиров.
[С6Н7О2(OH)3]n + 3nНNО3  [С6Н7О2(ONO2)3]n + 3nН2О
[С6Н7О2(ONO2)3]n + 3nН2О
тринитрат целлюлозы
[С6Н7О2(OH)3]n + 3nСН3СООН → [С6Н7О2(OСОСН3)3]n + 3nН2О
триацетат целлюлозы
Целлюлоза в природе.
Целлюлоза является основной частью стенок растений, Относительно чистой целлюлозой являются волокна хлопчатника. Древесина содержит от 40 до 50 %целлюлозы.
Применение целлюлозы.
Из целлюлозы изготавливают искусственные волокна, полимерные пленки, пластмассы, бездымный порох, бумагу.
Образование крахмала и клетчатки в зеленых растениях.
6СО2 + 6Н2О  С6Н12О6 + 6О2
С6Н12О6 + 6О2
nС6Н12О6 → (С6Н10О5)n + nН2О
Физические свойства аминов.
Метиламин, диметиламин, триметиламин и этиламин - газообразные вещества. Следующие представители гомологического ряда - жидкости, а высшие амины - твердые вещества. Газообразные и жидкие амины обладают запахом, напоминающим запах аммиака.
Химические свойства аминов.
1. Основные свойства аминов.
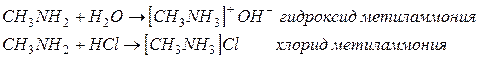
2. Горение.
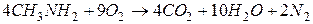
Получение аминов.
1. Восстановление нитросоединений.
C2H5NO2 + 3H2 → C2H5NH2 + 2H2O
2. Взаимодействие галогенпроизводных с аммиаком.
Применение аминов.
Амины широко применяются в органическом синтезе. Они служат промежуточными продуктами синтеза лекарственных средств, синтетических волокон, пластмасс, стимуляторов роста растений.
АНИЛИН.
Строение молекулы.

Физические свойства.
Маслянистая жидкость, бесцветная, но быстро темнеющая на воздухе, в воде малорастворим, ядовит.
Химические свойства.
1. Основные свойства.
C6H5NH2 + H2O → [C6H5NH3]OH
гидроксид фениламмония
C6H5NH2 + HCl → [C6H5NH3]Cl
хлорид фениламмония
2. Реакция замещения.

3. Горение.
4C6H5NH2 + 31О2 → 24СО2 + 14H2O + 2N2
Получение анилина.
1. Реакция Зинина.

2. Реакция Зайцева.

Анилин используется для получения лекарств, красителей, взрывчатых веществ.
ТЕМА: АМИНОКИСЛОТЫ.
Аминокислотами называют органические соединения, а молекулах которых содержатся карбоксильная группа (– СООH) и аминогруппа (– NH2)
Физические свойства.
Аминокислоты представляет собой белые, кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.
Химические свойства.
1. Амфотерные свойства аминокислот.
NH2 – CH2 – COOH + NaOH → NH2 – CH2 – COONa + H2O
NH2 – CH2 – COOH + HCl → [NH2 – CH2 – COOH]+Cl-
1. Образование сложных эфиров.
NH2 – CH2 – COOH + C2H5OH → NH2 – CH2 – CO – O – C2H5 + H2O
2. Реакция конденсации

Получение аминокислот.
1. Взаимодействие галогенпроизводных карбоновых кислот с аммиаком.
Cl – CH2 – COOH + NH3 → NH2 – CH2 – COOH + HCl
2. Гидролиз белков.
Применение аминокислот.
Аминокислоты и их производные используют в качестве лекарств. Синтетические аминокислоты - сырье для производства полиамидных синтетических волокон и изделий из этих полимеров.
БЕЛКИ.
Белками называют природные полимеры, состоящие из большого числа остатков α-аминокислот, связанных между собой пептидными связями.
Строение белка.
Первичная структура - это последовательность аминокислот в полипептидной цепи.
Вторичная структура - образование опирали.
Третичная структура - конфигурация, которую приобретает в пространстве свернутая в спираль молекула белка.
Физические свойства белков.
Молекулы фибриллярных белков вытянуты в длину, это основной строительный материал сухожилий, мускульных и покровных тканей. Такие белки в воде не растворимы.
Глобулярные белки свернуты в клубочки. Глобулярные белки растворимы в воде либо в растворах кислот или оснований.
Химические свойства белков.
1. Денатурация.
При нагревании, под действием сильных кислот или оснований, солей тяжелых металлов происходит необратимое осаждение (свертывание) белков.
2. Гидролиз.
Под действием ферментов, а также водных растворов кислот или щелочей происходит разрушение первичной структуры белка в результате гидролиза пептидных связей. Гидролиз приводит к образованию пептидов и аминокислот.
3. Качественные реакции белков.
а) биуретовая реакция - при действии на белки раствора солей меди (2) в щелочной среде возникает фиолетовое окрашивание.
б) ксантопротеиновая реакция - при действии на белки концентрированной азотной кислоты образуется желтая окраска.
ТЕСТОВАЯ РАБОТА
Вариант 1.
1. Функциональной группой фенолов является:

2. Общая формула предельного одноатомного спирта:
а) СnH2n+2 , в) СnH2n+1OH
б) CnHn-6 г) СnH2nO.
3.Основными реакциями, характерными для альдегидов являются:
а) замещение альдегидной группы;
б) окисление альдегидной группы
в) присоединение по альдегидной группе;
4. Какая из реакций невозможна для карбоновых кислот?
а) СН3СООН + Ag в) СН3СООН + Сu(ОН)2→
б)СН3СООН + Ag2О → г) СН3СООН + СН3ОН →
5. Качественная реакция на глицерин:
а) появление осадка серебра,
б) обесцвечивание бромной воды,
в) образование глицерата меди (II) ярко-синего цвета,
6. Сложный эфир глицерина и олеиновой кислоты относится к:
а) мылам в) синтетическим моющим средствам
б) твердым жирам; г) жидким жирам (маслам);
7. Глюкоза реагирует со следующим веществом:
а) СаСО3; б) NaOH в) Сu(ОН)2
8. Фенол проявляет свойства:
а) оксидов; б) слабых оснований; в) слабых кислот
9. К альдегидам относится:
а) этанол в) глицерин
б) метаналь г) фенол
10.Соединение, имеющее структурную формулу

имеет название: а) 2,5-диметилгептанол-2; в) 3,5-диметилгексанол-2
б) 2,4-диметилгексанол-5; г) 2,4-диметилгексаналь
11. В результате реакции этерификации образуется:
а) простой эфир в) спирт
б) сложный эфир г) кислота
12. Формула пропановой кислоты: а) СН3 – СООН в) С3Н7 – СООН
б) С2Н5 – СООН г) С2Н5 – СОН
13. Предельные одноатомные спирты являются изомерами:
а) альдегидов в) простых эфиров
б) кетонов г) сложных эфиров
Конспект лекций
по дисциплине «Химия»
РАЗДЕЛ 2 «ОРГАНИЧЕСКАЯ ХИМИЯ»