
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическое равновесие (стабильное, метастабильное, неустойчивое). Необходимые условия (возможности) достижения равновесия (скорость реакции, количества вещества, изолированность системы).
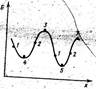
Рисунок показывает схему возможного изменения свободной энергии в некой системе при изменении какого-либо из ее параметров X (например, концентрации одного из веществ). В точках 1 изменение свободной энергии отрицательно и процесс происходит самопроизвольно слева направо (переводит систему в состояние, с большим рассматриваемым параметром и меньшей свободной энергией). В точках 2 при возрастании X свободная энергия возрастает, т.е. самопроизвольно процесс идти не может, требуется затрата энергии извне. В точках 3-5 свободная энергия не меняется ΔG = 0. Такие состояния системы называются равновесными. Отличием точек 3 от 4 и 5 является то, что любое изменение параметра сопровождается в них уменьшением G: при любом воздействии на систему начинается самопроизвольный процесс изменения параметра, сопровождающийся уменьшением свободной энергии. Следовательно, в точках максимумов система не может существовать конечное время. Такое равновесное состояние называется неустойчивым равновесием. В точках 4 и 4 изменения X приводят к увеличению G и система стремится возвратиться в исходное положение. Отличие точки 5 в том, что в ней система имеет свободную наименьшую энергию, она находится в стабильном равновесии. В остальных точках минимумов, которые не являются абсолютными, система находится в метастабильном состоянии. В метастабильном состоянии система может находиться сколь угодно долго, для перехода ее в стабильное состояние должен быть преодолен некоторый энергетический барьер - энергия активации ΔG. 14. Обратимые, необратимые и практически необратимые реакции. Дайте определение. Приведите по три примера каждого случая. Условия, обеспечивающие существование обратимости.
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, смещающее это равновесие, то равновесие смещается в сторону, указанную данным воздействием (ослабляющую его действие), до тех пор, пока нарастающее в системе противодействие не станет равно оказанному действию.
Принцип Ле-Шателье относится только к равновесным системам, т.е. таким, состояние 2NO + О2 ↔ 2NO2 Смесь этих газов находится в химическом равновесии при определенной температуре и давлении. Не изменяя температуры, увеличим давление так, чтобы объем, системы уменьшился в 2 раза. В первый момент парциальное давления и концентрации всех газов возрастут вдвое, но при этом изменится соотношение между скоростями прямой и обратной реакции - равновесие нарушится. В том случае, когда реакция протекает без изменения числа молекул газов, равновесие не нарушается при сжатии или при расширении системы. Например, в системе: Н2+ I2 ↔ 2HI равновесие не нарушается при изменении объема; выход HI не зависит от давления.
Так, например, синтез аммиака представляет собой экзотермическую реакцию: N2 + ЗН2 = 2NH3, ΔН = -92,4 кДж Поэтому при повышении температуры равновесие в системе Н2 - N2 - NH3 сдвигается влево - в сторону разложения аммиака, так как этот процесс идет с поглощением теплоты. И наоборот, синтез оксида азота (II) представляет собой эндотермической реакцию: N2 + О2 = 2NO, ΔН = 180,5 кДж. Поэтому при повышении температуры равновесие в системе N2 – О2 - NО сдвигается вправо - в сторону образования NО.
17. Влияние температуры на химическое равновесие. Причины влияния. Приведите 2 примера реального использования изменения температуры для смещения равновесия. Повышение или понижение температуры системы, находящейся в равновесном состоянии, значит приобретение или соответственно потерю энергии системой, т.е. изменение ее энергетического или, что то же, термодинамического, состояния. Таким образом, изменение температуры должно оказывать влияние на состояние термодинамического равновесия, в том числе на константу равновесия химической реакции, характеризуемой термодинамическими параметрами системы в соответствии с уравнением: ΔG = -RTInК Получаем: RTlnK = -ΔG = -ΔН + ТΔS ln К = -ΔH/RT + ΔS/R dInК/dТ =ΔН/RT2 Видим, что согласно уравнениям температурная зависимость константы равновесия определяется величиной и знаком энтальпии реакции. Чем больше абсолютное значение энтальпии, тем больше температурный коэффициент реакции, т.е. величина константы равновесия сильнее зависит от температуры. Если ΔН<0 (экзотермическая реакция), то ее температурный коэффициент DInК/dT<0, с повышением температуры константа равновесия уменьшается, равновесие смещается влево. Очевидно, что при ΔН>0 (эндотермическая реакция) повышение температуры смещает равновесие вправо. При более высокой температуре равновесие, соответствующее значению ΔG = 0, наступает при меньшей концентрации йодоводорода в смеси, т.е. равновесие при повышении температуры в данном случав смещается влево. Таким образом, повышение температуры, происходящее при поглощении системой извне, смещает равновесие в сторону процесса, поглощающего теплоту, т.е. эндотермического, а понижение температуры соответственно способствует большей степени протекания экзотермической реакции (пример реакций синтеза йодоводорода) Примеры см. в предыдущем вопросе. Среди процессов разделения дейтерия путем химического обмена наиболее широко применяется обмен между сероводородом и водой, который составляет 90%* мирового производства. В основе этого процесса лежит обратимая реакция. Равновесие этой реакции зависит от температуры, при снижении температуры равновесие смещается в сторону прямой реакции. Влияние температуры на равновесие используется для отделения дейтерия с помощью потока циркулирующей воды.
18. Влияние концентрации на химическое равновесие. Причины влияния. Приведите 2 примера реального использования изменения концентрации, реагента или продукта для смещения.
Рисунки от руки. При введении в равновесную систему реакционную смесь одного из веществ отношение активностей в выражении для свободной энергии реакции (1) ΔG = Δ G º + RTln (aXx · aYy …/ aMm · aNn …) изменится и нарушится соблюдавшееся при равновесии равенство (2) - Δ G º = RTlnΠai, (т. е. ΔG = 0,) изменение свободной энергии перестанет быть нулевым. Так, при прибавлении одного из исходных веществ увеличивается его активность, что приводит к уменьшению (3) Πai = (aXx · aYy …/ aMm · aNn …); это ведёт к уменьшению ΔG, которое становится отрицательным, и реакция пойдет слева направо; пока снова не станет Πai = К и Δ G = О. Прибавление исходного вещества сместило, таким образом равновесие вправо, в сторону образования большого количества продукта реакции. Здесь под смещением равновесий мы понимаем изменение относительных количеств веществ в реакционной смеси при неизменности константы равновесия. При введении в реакционную смесь одного из продуктов реакции произведение Πai возрастёт, ΔG увеличится, его значение станет положительным, и реакция пойдёт справа налево, пока не восстановятся снова равенства. Рассмотрим некоторые примеры.
При разбавлении раствора, в котором происходит диссоциация (электролита, комплексного соединения и т.п.), числитель выраженный вида (4) K = [CH3COO-]·[H3O+]/[CH3COOH] уменьшается всегда больше, чем знаменатель; это значит, что в момент разбавления становится ΔG<0 и с неизбежностью для восстановления величины Πai = К происходит дополнительная диссоциация. Таким образом, при уменьшении концентрации - степень диссоциации электролита всегда возрастает. Прибавим к раствору электролита второй электролит, содержащий одноименный ион с первым. Например, к раствору уксусной кислоты раствор ей соли - ацетата натрия. Очевидно, увеличение активности ацетат-ионов - одного из продуктов реакции диссоциации кислоты - сместит равновесие диссоциации влево, степень - диссоциации понизится. Проведём расчет. К 0,01М раствору CH3COOH прибавим CH3COONa в таком количестве, чтобы его концентрация в растворе стала 0,01 моль/л. Ск – концентрация кислоты в р-ре, Сс - соли, степень диссоциации кислоты - α; при этом полагаем, что соль диссоциировала полностью. Для получения оценочных результатов вместо активностей будем пользоваться концентрациями. Вычислим диссоциации кислоты вотсутствие соли: K = αСк·α Ск/(1-α) Ск = 1,8·10-5 Отсюда α = 0.04. В присутствии соли, когда диссоциация кислоты подавлена, можем считать, [CH3COO-] = Сс и [CH3COOH] = Ск: Сс·α Ск/ Ск = 1,8·10-5. Отсюда α = 0,002. Видим, что прибавление соли понизило степень диссоциации кислоты в 20 раз. При прибавлении к насыщенному раствору электролита одноименного иона уменьшается его растворимость. Например, в насыщенном растворе СаСОЗ, для которого ПР = 4.8·10-9.
[Cа2+] = [CO32-] = √ПР = 6,9·10-5 моль/л. Прибавим к этому раствору карбонат натрия а таком количестве, чтобы его концентрация стала 1 моль/л, т.е. увеличим концентрацию карбонат-ионов до 1 моль/л. Чтобы произведение концентраций не превысило ПР, неминуемо должна уменьшится концентрация ионов кальция (некоторая их часть перейдёт в осадок), и новое равновесие установится при значительно меньшей концентрации, чем в отсутствии карбоната натрия. Изменение концентраций в системах с газообразными веществами может быть осуществлено не только изменением количества одного из них, но и изменением объёма, происходящим при изменении давления. Равновесие при этом, однако, смещается не всегда, так как повышение давления (соответственно уменьшение объёма системы) изменяет одновременно концентрации всех реагентов. Увеличение (уменьшение) концентрации (активности) одного из веществ в реакционной смеси способствует процессу связывания, расходования (освобождения, образования) именно данного вещества. Иными словами, при увеличении (уменьшении) концентрации одного из исходных веществ равновесие смещается в сторону уменьшения (увеличения) его концентрации, т.е. соответственно вправо (влево). То же, очевидно, относится и к изменению концентраций продуктов реакции.
19. Влияние давления на химическое равновесие. Причины влияния. Приведите 2 примера реального использования изменения давления для смещения равновесия, (по одному для систем с участием газов и без такового).
Повышение давления (соответственно уменьшение объема системы) изменяет одновременно концентрации всех реагентов. Здесь может быть три случая: суммы стехиометрических коэффициентов при газообразных веществах в уравнении реакции 1) слева и справа равны, 2) слева больше, 3) слева меньше. При этом не учитываются вещества в конденсированном (жидком, твёрдом) состоянии, т. к. из-за малой сжимаемости они практически не изменяются при изменении давления. Рассмотрим пример обобщенной реакции: выразим парциальные давления компонентов через общее давление p и их концентрации. mM г + nN г = xX г + yY г, K = pXx · pYy / pMm · pNn = p ( x + y )-( m + n ) ·[ X ] x ·[ Y ] y /[ M ] m ·[ N ] n Первый случай: (х + у) = (m + n). Это значит, что первый множитель, включающий величину давления р, равен 1, и произведение концентраций - константа, равная К, независимо от давления. (1) Ск + Н2Ог ↔ СОг + Н2Г (2) Н2г+ I2г ↔ 2HIг Второй случай: (х + у) < (m + n). Показатель степени при р отрицательный, с ростом давления множитель уменьшается. Для сохранения постоянства всего произведения (равенств его К) должно увеличиваться отношение концентраций, т.е. увеличиваться содержание продуктов в равновесной реакционной смеси, что обозначает смещение равновесия вправо. Таким образом, если слева количество молекул газообразных веществ больше, чем справа, в уравнении реакции, то повышение давления смещает равновесие вправо, в сторону меньшего объёма, как это имеет место, например в реакциях:
(3) N2 + ЗН2 = 2NH3 (4) 2СО + О2 = 2СО2 Третий случай: (х + у) > (m + n). Течение реакции слева направо сопровождается увеличением объема. Аналогично вышесказанному можно показать, что в этом случае повышение давления сместит равновесие влево, например в реакциях: (5) Ск + Н2Ог ↔ СОг + Н2Г (6) CaCO3к = CaOк + СО2г Если увеличивать давление, которое, естественно, приводит к уменьшению объёма системы (отметим, что объём системы заметно зависит от давления, если в реакциях участвуют газообразные вещества), то в ней получает преимущество реакция, сопровождающаяся уменьшением объёма, как это имеет место в реакциях 3-6; в случаях 3 и 4 повышение давления смещает равновесие вправо, а в 5 и 6 - влево; равновесие реакций 1 и 2, несмотря на участие в них газов, не зависит от давления, так как объем веществ (без учета конденсированных) слева и справа в приближений идеальных газов одинаков - нет процесса, способствующего уменьшению объёма при, скажем, повышении давления и наоборот.
20. Скорость химической реакции, методы ееопределения (2конкретных примера экспериментального определения скорости реакции), основной закон химической кинетики.
Химическая реакция - процесс превращения одного (одних) веществ в другое (другие). Скорость химической реакции - скорость процесса превращения. Эту скорость естественно определять количеством превращенного (исчезнувшего или образовавшегося) вещества. Поэтому скоростью химической реакции называется количество изменяющегося в реакции вещества в единице реакционного пространства за единицу времени. При этом количество вещества выражается в молях, время в секундах, а единицей реакционного пространства в гомогенных системах, т.е. в случае, когда все реагенты находятся в одной фазе (жидкой, газообразной или твердой), считается объем - литр (тогда размерность скорости реакции моль/л·с), в случае гетерогенной системы, в которой реакция происходит на границе раздела фаз (газообразной и жидкой или твердой), единицей реакционного пространства служит единица площади межфазной поверхности (тогда размерность реакции моль/м2·с). Количество вещества к занимаемому им объему, есть молярная концентрация. Поэтому скорость гомогенной реакции можно определить как изменение концентрации одного из реагирующих веществ в единицу времени. Обозначив концентрацию реагирующего вещества в момент времени τ1 через С1 и в момент времени τ2 > τ1 через С2, получим для средней скорости реакции v в данный интервал времени: V = ± (С2 - С1)/(r 2 - r 1) = ±ΔС/Δ τ. Если С - концентрация исходного вещества, то ΔС < 0 и в приведенном уравнении Также: V = ± dC / dt Это так называемая истинная, или мгновенная скорость реакции. Обозначив коэффициент пропорциональности k, получим для реакций: А = X v = kCa А + В = X v = k СаС b А + В + С = X v = k СаС b Сс А + 2В = X v = k СаС b 2 Уравнения, записанные в правой колонке и показывающие зависимость скорости реакций от концентрации, называются кинетическими. Коэффициент пропорциональности k называется константой скорости, или удельной скоростью реакции. Он численно равен скорости реакции, когда произведение концентраций реагирующих веществ равно 1. Пример 1: разложение пероксида водорода: Н2О2 = (катализатор) Н2О + 1/2О2 В обычных условиях скорость разложения пероксида водорода мала, поэтому проводить реакцию следует в присутствии, катализатора — диоксида марганца МnО2. Измерение скорости разложения пероксида водорода основано на определении объема выделившегося в реакции кислорода. При этом необходимо учесть следующее: объем всего выделившегося в процессе реакции кислорода соответствует количеству пероксида водорода, взятого для проведения опыта. Разница между объемами всего выделившегося кислорода и выделившегося в определенный момент времени соответствует количеству не распавшегося к этому моменту времени пероксида водорода. Уравнения для расчета константы скорости: k = ln (v к /(v к - vτ))/ τ. Для экспериментального определения скорости этой реакции необходим специальный прибор для изучения скорости разложения пероксида водорода, который состоит из бюретки, двухколенной пробирки и уравнительного сосуда. После того, как вы собрали прибор, его надо проверить на герметичность. Для этого после сборки прибора опустите уравнительный сосуд на 15-20 см. Уровень воды а бюретке в первый момент несколько снизится и, если прибор герметичен, останется без изменения. Если уровень воды при опущенном уравнительном сосуде будет понижаться непрерывно, прибор негерметичен. Отмерьте цилиндром 4-мл 3%-го раствора пероксида водорода и перелейте его в одно из колен пробирки Оствальда, Возьмите стеклянную палочку диаметром 0,5-0,6-см и длиной примерно 2 см (стеклянная палочка должна легко проходить в одно, из колен пробирки Оствальда). Опустите кончик папочки в раствор коллодия. Дайте стечь его избытку и прикоснитесь к поверхности тонко измельченного порошка МnО2 так, чтобы конец стеклянной палочки покрылся тонким слоем катализатора. Дайте порошку просохнуть (5-7 мин). Поместите палочку с МnО2 в свободное колено пробирки Оствальда. Присоедините пробирку кприбору, еще раз проверьте его на герметичность и запишите положение уровня воды в бюретке по нижнему краю мениска с точностью до 0,01 мл. Поверните пробирку Оствальда таким образом, чтобы раствор пероксида водорода перелился в то колено пробирки, где находится катализатор, и одновременно включите секундомер. Измеряйте объем кислорода, выделяющегося в процессе реакции разложения пероксида водорода. Во время измерений постоянно совмещайте уровни воды в бюретке и уравнительном сосуде для того, чтобы давление внутри прибора было равно атмосферному. В течение первых 4-5 мин проводите измерения каждые 15с, затем 5-6 мин. — через 30 с, после чего интервал можно увеличить до 1-2 мин. Занесите результаты измерений втаблицу. Измерения можно прекратить, когда изменение уровня воды в бюретке в течение 2-3 мин перестанет быть заметным. Чтобы определить объем кислорода выделившегося при практически полном разложении пероксида водорода, опустите колено пробирки Оствальда с реакционной смесью в стакан с горячей водой. Повышение температуры ускорит разложение пероксида водорода. После окончания реакции выньте пробирку из стакана с горячей водой, дайте ей остыть до комнатной температуры (на это требуется около 10 мин), приведите давление в бюретке к атмосферному и отметьте уровень воды в ней. Пример 2:Исследование кинетики реакции разложения тиосерной кислоты. Скорость реакции определяется кинетическим уравнением: r = kC (H 2 S 2 O 3) α Тиосерная кислота неустойчива, поэтому ее получают непосредственно в эксперименте при взаимодействия тиосульфата натрия с серной кислотой: Na2S2O3 + H2SO4 = H2S2O3 + Na2SO4 или в ионном виде: S2O32- + 2H+ = H2S2O3 Реакция протекает мгновенно. Средняя скорость реакции разложения тиосерной кислоты рассчитывается по уравнению: r ср. = - ΔC(H2S2O3)/Δ τ Приготовьте из 1 М раствора тиосульфата натрия 50 мл 0,2 М раствора. Этот раствор необходимо готовить непосредственно перед опытом, так как он неустойчив и быстро разлагается на свету. С помощью пипетки налейте в фигурную пробирку 3 мл приготовленного раствора тиосульфата натрия; а в пробирку-трубочку - 3 мл. - приготовленного раствора серной кислоты. Быстро перелейте раствор серной кислоты в фигурную пробирку с раствором тиосульфата натрия. В момент сливания растворов включите секундомер к перемешайте раствор пробиркой-трубочкой, опустив ее 2-3 раза до дна фигурной пробиркой. Вытащите пробирку-трубочку из раствора. Наблюдайте через раствор за цветной полоской на фигурной пробирке. В момент, когда цветная полоска перестает быть видимой, остановите секундомер. Время опыта занесите в таблицу.
21. Порядок реакции. Экспериментальное определение порядка реакции (конкретный пример описания и расчета). Экспериментально найденный характер зависимости скорости реакции от концентраций реагирующих веществ определяет так называемый порядок реакции, который в лишь некоторых простейших случаях определяется суммой стехиометрических коэффициентов). В общем случае для реакции аА + b В +... = X, v = kCAα · CB β … Стехиометрические коэффициенты уравнения реакции а, b... могут быть равны, но чаще не равны соответствующим показателям степеней в кинетическом уравнении α, β... Сумма показателей степеней при концентрациях реагирующих веществ в кинетическом уравнении определяет общий порядок реакции. В реакции окисления двухвалентного железа порядок реакции равен 2. 2Fe2+ + H2O2 = 2FeOH2+ Следует различать молекулярность и порядок реакции. Молекулярность - это число молекул (частиц), принимающих участие в элементарном акте Пример реакции 1 порядка и одновременно мономолекулярной: H2S2О3 = Н2О + SO2 + S, v = kC(H2S2 О 3). Также кинетике 1 порядка подчиняется реакция разложения оксида азота (V): 2N2O5 = 2N2O4 + O2 Примером реакции 1 порядка, хотя и бимолекулярной, служит реакция с участием растворителя: С12Н22О11 + Н2О = 2С6Н12О6, v = kC(С12Н22О11) Значительно чаще встречаются реакции 2 порядка: Н2 + I2 = 2HI, v = kC(Н2)·C(I2) 2CI2O = 2CI2 + O2, v = C2(CI2O) В приведённых примерах порядок и молекулярность совпадает. Одновременное столкновение трех молекул, очевидно, менее вероятное событие, чем двух. Поэтому тримолекулярные реакции очень редки. Один из немногих примеров - это реакция 2NO + О2 =2NO2 Однако реакции 3 порядка встречаются довольно часто, особенно в жидкой фазе. В растворах известны реакции и более высоких порядков, в то время как молекулярность выше 3 практически невозможна. Пример реакции более высокого порядка: Не всегда вообще существует порядок. Например, для реакции Н2 + Вr2 = 2НВr. Сначала скорость описывается уравнением v = kC (Н2)· C 0,5 (В r 2), а затем, когда образовались заметные количества бромоводорода, v = k 1 C (Н2)· C 1,5 (В r 2)/(k 2 C (Br 2) + C (H В r)).
22. Влияние температуры на скорость химической реакции. Причины влияния. Уравнения Аррениуса. Приведите 2 примера реального использования изменения температуры для, изменения скорости. Важный фактор, влияющий на скорость реакции – температура. Простейшее объяснение факта увеличения скорости реакции при повышении температуры - вследствие увеличения числа столкновений, противоречит опыту. Действительно, увеличение температуры, например, от 273 до 283К, приводит кувеличению числа столкновений за единицу времени в корень из 283/273 = 1,02 раза. В то же время экспериментальное правило Вант-Гоффа (1884) говорит, что при повышении температуры на 10 градусов скорость реакции возрастает в 2-4 раза. Более точную эмпирическую зависимость константы скорости реакции от температуры установил С. Аррениус (1889): dlnk / dT = A / RT 2 Интегрирование этого уравнения дает k = k 0 ·е- Ea / RT. Здесь k - константа скорости реакции, Ea – энергия активации процесса, R - газовая постоянная, Т - температура (К), k0 и А - константы. Полученную зависимость Аррениус объяснил тем, что реакция происходит не при всех столкновениях реагирующих веществ, а лишь при тех, когда суммарная энергия сталкивающихся молекул больше некоторой минимальной величины, т.е. когда сталкиваются «активные» молекулы. С повышением температуры доля активных молекул и, следовательно, скорость реакции быстро возрастают, причем, тем быстрее, чем больше энергия активации. Более наглядно температурную зависимость скорости реакции можно представить с помощью температурного коэффициента реакции Вант-Гоффа, показывающего, во сколько раз возрастает скорость реакции при повышении температура на 10º. kT1/kT2 = γ(T1-T1)/10, здесь kT1 и kT2 – константы скоролсти некоторой реакции при температурах Т1 и Т2, соответственно γ – коэффициент Вант-Гоффа.
23. Влияние концентрации на скорость химической реакции. Причины влияния. Приведите 2 примера реального использования изменения концентрации реагента для изменения скорости реакции. Изучение протекания обратимых реакций в 50-60-х годах прошлого века показало, что состояние равновесия может изменяться при добавочном введении в равновесную смесь некоторых количеств реагентов, т.е. что направление химического процесса определяется не только химической природой веществ, но и их относительными количествами, массами. Этот вывод сформулировал Бертолле. Основываясь на этих представлениях и применяя выводы молекулярно-кинетической теории строения вещества, норвежские химики К. Гульдберг и П. Вааге в 1879 г. предложили общее выражение кинетической формы закона действующих масс (ЗДМ), основанного на положении, что скорость реакции определяется вероятностью столкновения реагирующих частиц, т.е. пропорциональна их концентрации. Действительно, химическая реакция происходит врезультате взаимодействия молекул, которое, очевидно, может наступить лишь в результате их столкновений между собой. Иными словами, скорость реакции должна быть пропорциональна произведению концентраций реагирующих веществ. В этом и состоит основной закон химической кинетики, называемый также иногда законом действующих масс. Обозначив коэффициент пропорциональности k, получим для реакций: А = X v = kCa А + В = X v = k СаС b А + В + С = X v = k СаС b Сс А + 2В = X v = k СаС b 2 Уравнения, записанные в правой колонке и показывающие зависимость скорости реакций от концентрации, называются кинетическими. Коэффициент пропорциональности k называется константой скорости, или удельной скоростью реакции. Он численно равен скорости реакции, когда произведение концентраций реагирующих веществ равно 1. В выше приведенные кинетические уравнения концентрации входят в степенях, равных стехиометрическими коэффициентами при соответствующих веществах в уравнениях реакций. Это имеет место в тех случаях, когда реакция действительно осуществляется столкновением указанного в уравнении реакции числа частиц. В большинстве случаев это не так. В качестве примера рассмотрим реакцию (в водном растворе): 2Fe2+ + H2O2 = 2FeОН2+ Соответствующее кинетическое уравнение, найденное в результате экспериментального изучения зависимости скорости этой реакции от концентраций двухвалентного железа и пероксида водорода, имеет вид: V = kC(Fe2+)·C(H2O2) Т.е. в него концентрация Fe2+ входит не во второй (по уравнению), а впервой степени. Оказывается, эта реакция, как и подавляющее большинство химических реакций, идет в несколько стадий, в данном случае в две. Fe2+ + H2O2 = 2FeОН2+ + ОН, Fe2+ + ОН = FeОН2+ Константа скорости первой из этих реакций равна 80 л/моль·с, а второй – 3,2·108л/моль·с. Очевидно, что скорость суммарного процесса полностью определяется скоростью более медленной стадии. Действительно, экспериментально найденный характер зависимости реакции от концентрации реагирующих веществ определяет так называемый порядок реакции (см. вопрос 24).
24. Кинетическое обоснование принципа Ле-Шателье (действие температуры, концентрации, давления, катализаторов) на конкретных примерах реакций. Приведите пример системы, к которому принцип Ле-Шателье не применим. Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, смещающее это равновесие, то равновесие смещается э сторону, указанную данным воздействием (ослабляющую его действие), до тех пор, пока нарастающее е системе противодействие не станет равно оказанному действию. Принцип Ле-Шателье относится только к равновесным системам, т.е. таким, состояние которых соответствует минимуму свободной энергии, так что любое изменение; выводящее систему из равновесного состояния, сопровождается увеличением G, требует затрат работы; а самопроизвольным оказывается процесс, возвращающий систему в состояние равновесия. В химических системах, где равновесное состояние определяется отношением активностей веществ—компонентов системы, выражаемым соответствующей константой равновесия, новое состояние равновесия (т.е. снова ΔG = 0) возникает благодаря перераспределению величин активностей в результате изменения количеств веществ в реакционной смеси. Это перераспределение и есть «нарастающее в системе противодействие». Увеличение (уменьшение) концентрации (активности) одного из веществ в реакционной смеси способствует процессу связывания, расходования (освобождения, образования) именно данного вещества. Иными словами, при увеличении (уменьшении) концентраций одного из исходных веществ равновесие смещается в сторону уменьшения (увеличения) его концентрации, т.е. соответственно вправо (влево). См. вопрос 22. На процессы, происходящие в равновесной химической системе, оказывают влияние вещества-катализаторы. Однако равновесия они не смещают. Их активность не входит ни в константу равновесия, ни в расчёт ΔG, т.е. не изменяет ΔG, величина которой определяется характеристиками веществ в начальном и конечном состоянии системы и не зависит от пути перехода, в том числе от про межуточных взаимодействий с катализатором.
25. Растворы (твердые жидкие газообразные - по 2 примера) Способы, выражения концентрации растворов. Процентная и молярная концентрация, мольная доля. Раствор - это гомогенная многокомпонентная система. Если образующие раствор вещества имеют одинаковое строение и близкую природу химических связей, то они могут неограниченно растворяться друг в друге, и, следовательно, деление на растворитель и растворенное вещество бессмысленно. Но чаще встречаются случаи ограниченной взаимной растворимости. Растворителем служит тот компонент, который сохраняет структуру раствора. Формально растворителем можно назвать тот компонент, при прибавлении которого не может образоваться насыщенный раствор. Растворимость - это концентрация в насыщенном растворе. Насыщенным называется раствор, находящийся в равновесии с растворенным веществом. Может существовать только в гетерогенной системе. 1. Газ в газе. Газообразное состояние вещества характеризуется малым взаимодействием между его частицами и большими расстояниями между ними. Поэтому газы смешиваются в любых отношениях. При очень высоких давлениях, когда плотность газа приближается к плотности жидкости и газ нельзя считать идеальным даже приближенно, может наблюдаться ограниченная растворимость. 2. Газ в жидкости. Два типа систем (как и в любых других системах): с образованием химических 3. Газ в твердом. Растворение газа в металле сопровождается деформацией кристаллической решетки металла и часто диссоциацией газообразных молекул на атомы. Оба процесса эндотермичны. Существует общее правило: жидкость как растворитель значительно эффективней твердого, эффект обусловлен отсутствием энергетических затрат на искажение кристаллической решетки твердого тела при растворении в нем другого вещества (водород в железе). 4. Жидкое и твердое в жидком. Наиболее часто встречаемые. Особенность - в совмещении двух важных для течения хим. реакции характеристик: высокой концентрации вещества, характер
|
|||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 191; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.217.134 (0.112 с.) |




 16. Принцип Ле-Шателье в применении к химическим системам (по 1 примеру гомогенных и гетерогенных равновесий и влияние на них различных факторов). К каким системам применим закон Ле-Шателье? Является ли принцип Ле-Шателье физическим, или химическим, или геологическим законом?
16. Принцип Ле-Шателье в применении к химическим системам (по 1 примеру гомогенных и гетерогенных равновесий и влияние на них различных факторов). К каким системам применим закон Ле-Шателье? Является ли принцип Ле-Шателье физическим, или химическим, или геологическим законом?


