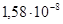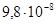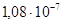Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Проводниковые металлы различного назначения
Рассмотрим некоторые проводниковые металлы, имеющие узкое назначение. Из-за особенностей тех или иных физико-химических свойств эти металлы имеют специальное применение в производстве различных электротехнических изделий. Например, их используют в качестве нитей накаливания и электродов в электро- и радиолампах, различных разрывных контактах, испарителях, сверхпроводниках, ферромагнетиках. В основу классификации этих материалов положена температура плавления. 2.8.1. Тугоплавкие металлы К тугоплавким металлам относятся металлы, имеющие температуру плавления Тпл выше, чем у железа (у Fe Тпл =1539°С). При низких температурах эти металлы, как правило, химически стойкие. Однако при повышенных температурах в атмосфере воздуха они довольно легко окисляются, поэтому при высоких температурах их можно эксплуатировать только в среде инертных газов или в вакууме. Эти металлы трудно поддаются механической обработке. Изделия из них, как правило, получают методами порошковой металлургии (прессованием и спеканием порошков) или методами электровакуумных технологий (плавлением электронным или лазерным лучом, плазменной обработки). Тугоплавкие металлы (и сплавы на их основе), несмотря на дефицитность и высокую стоимость, являются основными проводниковыми материалами в электровакуумной промышленности. Из тугоплавких металлов наиболее широко применяют вольфрам W, тантал Та, молибден Мо, ниобий Nb, хром Сr, ванадий V, титан Ti, цирконий Zr, рений Re. Рассмотрим основные из них. 2.8.1.1. Вольфрам W – это самый тугоплавкий металл (Тпл =3380°С) светло-серого цвета, с высокой плотностью (19,3 Мг/м3); удельное сопротивление ρ=5,5×10–8
Вольфрам относительно дорог и трудно поддается механической обработке, поэтому его применяют только там, где нельзя заменить другим металлом. Основная область его применения – нити накаливания, электроды, крючки в осветительных и электронных лампах, в рентгеновских трубках, т.е. там, где высока рабочая температура и проявляется термоэлектронная эмиссия. Вольфрам наиболее стоек по сравнению с другими материалами к образованию дуги и обладает высокой стойкостью к эрозии и механическому износу. У него отсутствует привариваемость, поэтому вольфрам широко и давно применяют для изготовления разрывных контактов. В микроэлектронике вольфрам в виде спиралей используют в испарителях для термического напыления в вакууме тонких пленок различных материалов. Вольфрам со стеклами марок С37…С41 образует вакуумно-плотные спаи и выпускается в виде кованых и тянутых прутков диаметром 1,0–12 мм, проволоки диаметром 0,01–1,5 мм, фольги и полос толщиной 0,01–3,0 мм. Основные недостатки вольфрама: 1) трудность механической обработки; 2) образование в атмосфере воздуха при температуре выше 400°С оксидных пленок, а при содержании в воздухе или жидком диэлектрике серосодержащих веществ (сернистого газа, сероводорода) – сульфидных пленок; 3) необходимость больших контактных давлений для получения небольших величин сопротивления в месте электрического контакта. При нагревании тянутого вольфрама до высоких температур начинается процесс рекристаллизации, т.е. укрупнения зерен. Волокнистая структура постепенно исчезает, а отдельные зерна увеличиваются до площади поперечного сечения проволоки. Кроме того, при высоких температурах образовавшиеся крупные кристаллы получают возможность скользить ("провисать") под действием собственной массы относительно друг друга. Такой вольфрам становится очень хрупким. Для улучшения свойств чистого вольфрама в него вводят различные присадки. Для понижения работы выхода и увеличения эмиссии электронов в вольфрам вводят 1–2% оксида тория ThO, который, кроме того, препятствует росту кристаллитов вольфрама и увеличивает тем самым его формостойкость и, следовательно, срок службы изделий из вольфрама при эксплуатации в области температур до 2300°С. Для достижения большей формоустойчивости вводят добавки окислов Si, Al, Ca. Эти присадки вызывают красталлизацию в направлении оси проволоки, образуя структуру со взаимно зацепляющимися по большей поверхности, т.е. расположенными "внахлест", удлиненными кристаллами. Такой вольфрам получил название непровисающего. Он используется для изготовления нитей ламп накаливания.
2.8.1.2. Тантал. Та – тугоплавкий металл светло-серого цвета с голубоватым оттенком, Tпл =3000°С, плотность 16,6 Мг/м3, удельное сопротивление ρ=1,2410–7 Тантал применяют для изготовления анодов и сеток генераторных ламп, в производстве электролитических конденсаторов, которые по своим свойствам превосходят алюминиевые электролитические конденсаторы, при изготовлении пленочных резисторов, в качестве лодочек в испарителях для термического напыления в вакууме тонких пленок различных материалов. Его также используют как сверхпроводник. 2.8.1.3. Молибден. Мо – металл, по внешнему виду и по свойствам похож на вольфрам, однако почти в два раза легче вольфрама (плотность Мо 10,2 Мг/м3) и из всех тугоплавких металлов (его Тпл =2620°С) имеет самое низкое удельное сопротивление (ρ=
Молибден, как и вольфрам, используют в качестве электродов в радиолампах, испарителях в вакуумной технике, разрывных электрических контактах, для получения вакуумно-плотных спаев (вводов) со стеклами марки С47-С52. 2.8.1.4. Ниобий. Nb – тугоплавкий металл светло-серого цвета; Тпл =2470°С, плотность 8,57 Мг/м3, удельное сопротивление ρ= 2.8.1.5. Хром Сr – один из распространенных химических элементов в земной коре. Металлический хром получают термическим восстановлением окиси хрома Сr2О3 алюминием или кремнием, или путем электролиза водных растворов его химических соединений. Хром обладает высокой стойкостью к окислению, поэтому его применяют в качестве защитного (антикоррозионного) покрытия металлических (стальных) изделий, в том числе эксплуатируемых при повышенных температурах. Хром входит в состав жаростойких сплавов – нихромов и других материалов, используемых для нагревательных элементов, а также в состав нержавеющих и кислотоупорных сталей. Применяется для изготовления пленочных резисторов и подслоя для контактных площадок в интегральных микросхемах. 2.8.2. Металлы со средним значением температуры плавления К металлам со средним значением температуры плавления относятся такие, температура плавления которых ниже 1600°С и выше 500°С. Наибольший интерес для электро- и радиотехники представляют металлы группы железа – железо Fe, кобальт Со и никель Ni и сплавы на их основе. Эти металлы и их сплавы обладают ферромагнитными свойствами. Для них характерно также повышенное значение температурного коэффициента удельного сопротивления ТК ρ.
2.8.2.1. Железо (сталь). Железоуглеродистые сплавы – стали и чугуны обладают высокой механической прочностью, дешевы, доступны и поэтому широко используются в технике (в том числе в электротехнике) как конструкционные материалы. В электротехнике железо и его сплавы с углеродом и другими химическими элементами используют также в качестве проводникового и ферромагнитного материала. В качестве проводникового материала иногда используют низкоуглеродистые стали с содержанием углерода до 0,10–0,15% и удельным сопротивлением ρ около
Рис. 2.9. Зависимость удельного сопротивления r стали от концентрации N различной примеси При переменном токе у стали отмечается скин-эффект и как у ферромагнетика возникают потери мощности на вихревые токи и магнитный гистерезис. В отличие от чистого железа стали имеют низкую коррозионную стойкость, поэтому изделия из стали, работающие во влажной атмосфере, покрывают защитным слоем цинка. У биметаллических проводов на основе стали (сердцевина) и меди или алюминия (оболочка) повышается не только коррозионная стойкость, но и электропроводность. Биметаллические провода позволяют увеличить расстояние между опорами линий электропередач. 2.8.2.2. Кобальт. Со–пластичный блестящий белый металл с сероватым оттенком; Тпл =1500°С, плотность 8,85 Мг/м3, удельное сопротивление 2.8.2.3. Никель. Ni–серебристо-белый ковкий и тягучий металл; Тпл =1453°С, плотность 8,96 Мг/м3, удельное сопротивление 2.8.2.4. Сплавы на основе ферромагнитных металлов. Их широко используют в качестве магнитных материалов, а также для получения вакуумно-плотных спаев со стеклами и керамикой. Обычно эти сплавы применяют в спаях, которые работают при относительно невысоких температурах, и поэтому нет необходимости применять такие тугоплавкие и дорогие металлы, как вольфрам, молибден, платина. Наиболее известными из этой группы сплавов являются ковар, инвар и платинит.
Ковар – сплав системы Fe–Ni–Со. В состав ковара марок Н28К18 и Н29К18 входит Ni 28,7–29,2%, Со 17,3–17,8% и остальное Fe. У ковара Тпл =1450°С, σ в ≈630 МПа, δ=35%, удельное сопротивление Инвар (сплав Н36) – сплав железа примерно с 36% никеля. У него очень низкий температурный коэффициент линейного расширения; ТКЛР в интервале температур от минус 100 до плюс 100°С равен Платинит – это биметаллическая проволока, сердечник которой выполнен из никелевой стали Н43 (Ni 43% и Fe 57%), а наружная оболочка из меди марки М0. Свое название получил из-за близкого значения его ТКЛР к ТКЛР платины. ТКЛР платинита равен 2.8.3. Легкоплавкие металлы К легкоплавким металлам относятся металлы, температура плавления которых ниже 500°С. Наиболее широкое применение в электро- и радиотехнике среди легкоплавких металлов получили: свинец Рb, олово Sn, цинк Zn, кадмий Cd, ртуть Hg, индий In, галлий Ga. 2.8.3.1. Свинец Рb – мягкий и высокопластичный металл (легко режется ножом) синевато-серого цвета с металлическим блеском на свежем срезе. Благодаря высокой пластичности Рb в холодном состоянии можно прокатывать в фольгу. На воздухе свинец окисляется, и его поверхность быстро тускнеет. Его Тпл =327°С, σ в =16 МПа, δ=55%, НВ=39 МПа, удельное сопротивление Свинец коррозионностоек к действию воды, серной и соляной кислот. Однако разрушается под действием азотной и органических кислот, извести и некоторых других веществ. Вода, особенно при повышенной температуре и в присутствии кислорода воздуха, постепенно окисляет Рb, так как растворяет его защитную оксидную пленку. Свинец применяют для изготовления баббитов (подшипниковые сплавы на основе свинца или олова и содержащие Sb и Сu), а также для защиты от радиоактивного излучения (он хорошо поглощает γ-лучи). В электротехнике его используют в плавких предохранителях, мягких припоях (ПОС), свинцовых аккумуляторах и в кабельных оболочках. В последних применяют его сплавы с малыми количествами Sb, Те, Cd, Сu, Са и Sn. В настоящее время кабельные оболочки производят из алюминия или пластмассы, наиболее дешевых материалов. Водорастворимые соединения свинца ядовиты. 2.8.3.2. Олово. Sn – мягкий и пластичный металл серебристо-белого цвета, легко прокатывается в холодном состоянии в тонкую фольгу (до 6 мкм). Для олова Тпл =232°С, σ в =16–38 МПа, НВ=52 МПа, ρ= Применяют олово в качестве защитного покрытия стали (лужение); оно входит в состав мягких припоев (ПОС) и в некоторые марки бронз. 2.8.3.3. Цинк. Zn – металл синевато-белого цвета, хрупкий при комнатной температуре; при нагревании до 100–150°С становится пластичным и хорошо куется и прокатывается в листы. При температуре выше 200°С становится настолько хрупким, что растирается в порошок. У цинка высокой степени чистоты полиморфизм отсутствует. Его Тпл =419°С, ρ= Цинк применяют в качестве антикоррозионного покрытия стальных изделий, в виде составной части латуней, при металлизации бумаги для малогабаритных бумажных конденсаторов, в производстве фотоэлементов. Цинк на поверхности стального изделия является эффективным анодным покрытием, так как обладает значительным отрицательным электродным потенциалом. 2.8.3.4. Кадмий. Cd – ковкий и тягучий металл серебристо-белого цвета, Тпл =32°С, ρ= Кадмий применяют в производстве фотоэлементов, щелочных аккумуляторов (кадмиево-никелевые), в качестве защитного (антикоррозионного) покрытия. Он входит в состав некоторых бронз и низкотемпературных припоев. В качестве электролитического покрытия кадмий применяют для защиты от атмосферной коррозии метиза из стали и цветного металла, используемого в электротехнике. Кадмиевые покрытия обладают высокой коррозионной стойкостью к воздушной и жидкой средам, содержащим хлориды, например, к морской воде. Однако у них низкая стойкость к действию серосодержащих веществ. Растворимые соединения Cd ядовиты. 2.8.3.5. Ртуть. Hg – металл серебристо-белого цвета. Это единственный металл, находящийся при комнатной температуре в жидком состоянии, Тпл = –39°С, удельное сопротивление 2.8.4. Благородные металлы В электротехнике благородными металлами принято считать золото Аu, серебро Ag, платину Pt и палладий Pd. В широком смысле к благородным металлам можно отнести и другие металлы платиновой группы (иридий Ir, осмий Os, рутений Ru, родий Rh). Эти металлы и сплавы на их основе обладают высокой химической стойкостью, в том числе и при повышенных температурах. Золото, серебро и платина на воздухе практически не окисляются, даже при их плавлении. Точными оптическими исследованиями установлено, что на воздухе золото покрыто тончайшим адсорбционным слоем кислорода, а на поверхности серебра обнаружена окисная пленка толщиной 12 Å. Палладий на воздухе при температуре 600–700°С образует пленку моноксида PdO. В природе благородные металлы встречаются в виде самородков и в различных рудах. Из руды их получают путем последовательной металлургической, химической и электролитической переработки со степенью чистоты, которая может составлять у золота – 99,998%, серебра – 99,999%, платины – 99,9998%, палладия – 99,94%. 2.8.4.1. Золото. Аu – металл желтого цвета, обладающий очень высокой пластичностью. Из него можно получать фольгу толщиной до 0,01 мкм. С кислотами и щелочами не взаимодействует, растворяется только в «царской водке» (смесь азотной и соляной кислот); Тпл =1063°С, σ в =150 МПа, δ=40%, удельное сопротивление В электронной технике золото применяют как контактный материал в слаботочных коммутирующих устройствах (например, в герконах), в качестве покрытия резонаторов СВЧ, внутренних поверхностей волноводов, в производстве электродов полупроводниковых фоторезисторов, фотоэлементов и для других целей. В коммутирующих устройствах чистое золото используют только для изготовления прецизионных контактов с малым контактным нажатием и низким напряжением. В других типах контактов применяют сплавы золота с серебром, никелем, цирконием, имеющие повышенную твердость, хорошую эрозионную и коррозионную стойкость. 2.8.4.2. Серебро. Ag – металл белого цвета, пластичный, обладает самым низким удельным сопротивлением ρ= Как проводниковый материал серебро применяют для получения гальванического покрытия в ВЧ- и СВЧ-устройствах. У керамических конденсаторов из него получают прочные электроды методом вжигания. Применяют серебро в качестве контактного материала в коммутирующих устройствах, в составе некоторых твердых припоев, в производстве серебряно-цинковых и серебряно-кадмиевых аккумуляторов и в других случаях. К недостаткам серебра следует отнести его миграцию по поверхности и внутрь диэлектрика в условиях повышенных температур и влажности, более низкую коррозионную стойкость, чем у других благородных металлов, – серебро химически взаимодействует с серосодержащими веществами, например с газами H2S, SO2, и образует темные пленки сернистого серебра, имеющие повышенное удельное сопротивление. Взаимодействие серебра с серосодержащими веществами имеет место даже при их низких концентрациях в жидкостях и в воздухе. 2.8.4.3. Платина Pt – блестящий тугоплавкий металл серовато-белого цвета (Тпл =1770°С), с высокой плотностью (21,45 Мг/м3) и пластичностью (у отожженных образцов σ в ≈150 МПа, δ=30–35%), удельным сопротивлением В качестве контактного материала обычно используют сплавы платины с никелем, серебром, золотом, иридием, которые повышают ее твердость и удельное сопротивление. Особо тонкие нити из платины (диаметром около 1 мкм) используют в качестве подвесок в электрометрах. Применяют платину для изготовления высокотемпературных (до 1600°С) термопар. 2.8.4.4. Палладий. Pd – серебристо-белый металл, самый легкий (плотность составляет 12,02 Мг/м3) и наиболее легкоплавкий (Тпл =1550°С) из всех металлов платиновой группы; мягкий и пластичный (отожженные образцы имеют σ в =200 МПа, δ=40%), удельное сопротивление
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 134; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.15.1 (0.026 с.) |
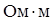 , ТК ρ=5×10–3 К–1, механическая прочность σ в =550–3500 МПа, относительное удлинение перед разрывом δ=4%, твердость НВ=2620 МПа. Вольфрам получают из руды путем сложной химической переработки в виде порошка, из которого методами порошковой металлургии (прессованием и спеканием порошков W) производят бруски и детали несложной формы. Такой вольфрам имеет зернистую структуру; он тверд, хрупок и легко ломается. Если зернистый вольфрам подвергнуть механической обработке (ковке, волочению), то его структура становится волокнистой и прочность на излом повышается в несколько раз. Путем волочения получают тонкие гибкие нити диаметром до 10 мкм и менее, у которых значение σ в в 5–7 раз выше, чем у вольфрамовых кованых стержней диаметром 5 мм. Вольфрам также прокатывают в тонкие гибкие ленты с волокнистой структурой. Механическую обработку вольфрама производят при высоких температурах в защитной среде (атмосфере водорода), так как на воздухе он начинает окисляться при температуре выше 400°С. По этой же причине изделия из вольфрама, работающие при температуре выше 400°С, должны эксплуатироваться в атмосфере инертных газов (азоте, аргоне) или в вакууме. Нагревостойкость в защитной среде у него высока – до 2200°С.
, ТК ρ=5×10–3 К–1, механическая прочность σ в =550–3500 МПа, относительное удлинение перед разрывом δ=4%, твердость НВ=2620 МПа. Вольфрам получают из руды путем сложной химической переработки в виде порошка, из которого методами порошковой металлургии (прессованием и спеканием порошков W) производят бруски и детали несложной формы. Такой вольфрам имеет зернистую структуру; он тверд, хрупок и легко ломается. Если зернистый вольфрам подвергнуть механической обработке (ковке, волочению), то его структура становится волокнистой и прочность на излом повышается в несколько раз. Путем волочения получают тонкие гибкие нити диаметром до 10 мкм и менее, у которых значение σ в в 5–7 раз выше, чем у вольфрамовых кованых стержней диаметром 5 мм. Вольфрам также прокатывают в тонкие гибкие ленты с волокнистой структурой. Механическую обработку вольфрама производят при высоких температурах в защитной среде (атмосфере водорода), так как на воздухе он начинает окисляться при температуре выше 400°С. По этой же причине изделия из вольфрама, работающие при температуре выше 400°С, должны эксплуатироваться в атмосфере инертных газов (азоте, аргоне) или в вакууме. Нагревостойкость в защитной среде у него высока – до 2200°С.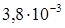 К–1, σ в =350–1250 МПа, δ=2–40%, НВ=450 МПа. В сравнении с вольфрамом тантал обладает более низкой температурой плавления и лучше поддается пластическому деформированию – ковке, волочению, прокатке, которые производят при комнатной температуре. Полученные прутки имеют диаметр 3–50 мм. Фольгу и листовой тантал выпускают толщиной 0,008–2,0 мм, проволоку – диаметром 0,03–1,6 мм, бесшовные тянутые трубки – наружным диаметром 15–40 мм при толщине стенок 0,3–2 мм. Тантал, так же как и вольфрам, получают методом порошковой металлургии с последующей механической обработкой. Однако спекание Та производят в вакууме, так как он сильно поглощает газы, в результате чего становится хрупким. При повышенной температуре тантал взаимодействует почти со всеми газами, за исключением инертных.
К–1, σ в =350–1250 МПа, δ=2–40%, НВ=450 МПа. В сравнении с вольфрамом тантал обладает более низкой температурой плавления и лучше поддается пластическому деформированию – ковке, волочению, прокатке, которые производят при комнатной температуре. Полученные прутки имеют диаметр 3–50 мм. Фольгу и листовой тантал выпускают толщиной 0,008–2,0 мм, проволоку – диаметром 0,03–1,6 мм, бесшовные тянутые трубки – наружным диаметром 15–40 мм при толщине стенок 0,3–2 мм. Тантал, так же как и вольфрам, получают методом порошковой металлургии с последующей механической обработкой. Однако спекание Та производят в вакууме, так как он сильно поглощает газы, в результате чего становится хрупким. При повышенной температуре тантал взаимодействует почти со всеми газами, за исключением инертных.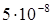
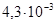 К‑1, δв=350–2500 МПа, δ=2–55%, НВ=1530 МПа. Молибден получают из руды, и изделия из него изготавливают по тем же технологиям, что и из вольфрама. Структуры кованого образца молибдена и образца, полученного волочением, схожи со структурами соответствующих образцов вольфрама. Однако в отличие от вольфрама отожженный мелкозернистый молибден обладает хорошей пластичностью, и его обработка не вызывает особых трудностей. На воздухе молибден начинает окисляться при температуре 400°С и интенсивно окислятся при 600–700°С и выше. Во влажной атмосфере окислы образуются уже при 250°С. Поэтому детали из молибдена при высоких температурах должны работать в вакууме или в инертных газах.
К‑1, δв=350–2500 МПа, δ=2–55%, НВ=1530 МПа. Молибден получают из руды, и изделия из него изготавливают по тем же технологиям, что и из вольфрама. Структуры кованого образца молибдена и образца, полученного волочением, схожи со структурами соответствующих образцов вольфрама. Однако в отличие от вольфрама отожженный мелкозернистый молибден обладает хорошей пластичностью, и его обработка не вызывает особых трудностей. На воздухе молибден начинает окисляться при температуре 400°С и интенсивно окислятся при 600–700°С и выше. Во влажной атмосфере окислы образуются уже при 250°С. Поэтому детали из молибдена при высоких температурах должны работать в вакууме или в инертных газах.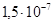
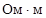 , ТК ρ=
, ТК ρ= 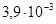 К–1, σ в =350–900 МПа, δ=1–30%, НВ=750 МПа. По химическим свойствам и методам механической обработки ниобий подобен танталу. Его также получают методами порошковой металлургии. Выпускают ниобий в виде проволок, лент и труб. Ниобий и некоторые его соединения являются сверхпроводниками с относительно высокой температурой перехода Ткр (для чистого Nb Ткр =9,2 К, а для его соединений Ткр =23 К), поэтому его применяют для изготовления сверхпроводящих магнитов, СВЧ волноводов. В электровакуумной технике Nb применяют для производства анодов, экранов, в качестве газопоглотителей, а также для получения пленочных резисторов в микросхемах.
К–1, σ в =350–900 МПа, δ=1–30%, НВ=750 МПа. По химическим свойствам и методам механической обработки ниобий подобен танталу. Его также получают методами порошковой металлургии. Выпускают ниобий в виде проволок, лент и труб. Ниобий и некоторые его соединения являются сверхпроводниками с относительно высокой температурой перехода Ткр (для чистого Nb Ткр =9,2 К, а для его соединений Ткр =23 К), поэтому его применяют для изготовления сверхпроводящих магнитов, СВЧ волноводов. В электровакуумной технике Nb применяют для производства анодов, экранов, в качестве газопоглотителей, а также для получения пленочных резисторов в микросхемах.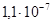
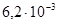 К–1, σв=380–420 МПа, δ=31–25%. Удельное сопротивление стали зависит от природы и концентрации примеси (рис. 2.9).
К–1, σв=380–420 МПа, δ=31–25%. Удельное сопротивление стали зависит от природы и концентрации примеси (рис. 2.9).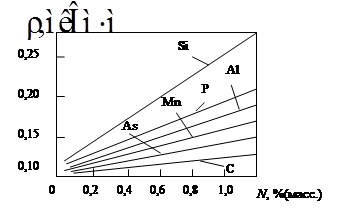
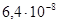
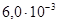 К–1, у отожженных образцов σ в =500 МПа, δ>5%. В отличие от железа он химически менее активен. На воздухе кобальт не окисляется. При нагревании до 300°С он покрывается тонкой оксидной пленкой СоО. Кобальт является составной частью многих сплавов и композиционных материалов магнитных и жаростойких (до 1000°С) с повышенной механической прочностью и малым значением ТК ρ.
К–1, у отожженных образцов σ в =500 МПа, δ>5%. В отличие от железа он химически менее активен. На воздухе кобальт не окисляется. При нагревании до 300°С он покрывается тонкой оксидной пленкой СоО. Кобальт является составной частью многих сплавов и композиционных материалов магнитных и жаростойких (до 1000°С) с повышенной механической прочностью и малым значением ТК ρ.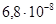
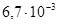 К–1, у отожженных образцов σ в =400–600 МПа, δ=35–50%. Никель менее активен, чем железо и кобальт; на воздухе не тускнеет, стоек к действию воды и органических кислот. Никель выпускают в виде полос, пластин, лент, трубок, стержней и проволок. Никель используют в жаропрочных (до 1000°С), магнитных, проводниковых и других сплавах с особыми физико-химическими свойствами, а также в качестве защитных и декоративных покрытий металлических изделий, в производстве щелочных кадмиево-никелевых и железоникелевых аккумуляторов. В электровакуумной технике никель используют в качестве электродов и арматуры в электронных лампах.
К–1, у отожженных образцов σ в =400–600 МПа, δ=35–50%. Никель менее активен, чем железо и кобальт; на воздухе не тускнеет, стоек к действию воды и органических кислот. Никель выпускают в виде полос, пластин, лент, трубок, стержней и проволок. Никель используют в жаропрочных (до 1000°С), магнитных, проводниковых и других сплавах с особыми физико-химическими свойствами, а также в качестве защитных и декоративных покрытий металлических изделий, в производстве щелочных кадмиево-никелевых и железоникелевых аккумуляторов. В электровакуумной технике никель используют в качестве электродов и арматуры в электронных лампах.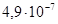
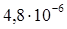 К–1). Со стеклом марки С48 ковар марок Н28К18 и Н29К18 образует вакуумно-плотный спай. Пленка окисла на поверхности ковара при нагревании растворяется в стекле и обеспечивает прочное соединение ковара со стеклом. Ковар легко паяется и сваривается, выпускается в виде лент и полос толщиной 0,1–4,0 мм, прутков диаметром 6–40 мм, проволок диаметром 0,2–3,0 мм и бесшовных труб с внешним диаметром 2,0–4,1 мм при толщине стенок 0,3–2,0 мм.
К–1). Со стеклом марки С48 ковар марок Н28К18 и Н29К18 образует вакуумно-плотный спай. Пленка окисла на поверхности ковара при нагревании растворяется в стекле и обеспечивает прочное соединение ковара со стеклом. Ковар легко паяется и сваривается, выпускается в виде лент и полос толщиной 0,1–4,0 мм, прутков диаметром 6–40 мм, проволок диаметром 0,2–3,0 мм и бесшовных труб с внешним диаметром 2,0–4,1 мм при толщине стенок 0,3–2,0 мм.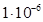 К–1. У инвара σ в ≈530 МПа, δ=40%, удельное сопротивление
К–1. У инвара σ в ≈530 МПа, δ=40%, удельное сопротивление 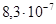
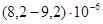 К–1, а ТКЛР платины
К–1, а ТКЛР платины 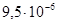 К–1. Его удельное сопротивление
К–1. Его удельное сопротивление 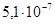
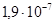
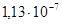
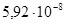
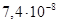
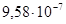
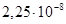
 .
.