
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Генные механизмы функционирования живого
Генетика (от греч. genesis – происхождение) – наука о законах наследственности и изменчивости, а также о механизмах реализации генетической информации в живых организмах. Законы генетики положены в основу современного эволюционного учения – неодарвинизма. Методы и данные генетики получили широкое практическое применение в селекции, биотехнологии, генной инженерии и медицине. Американскими учеными А. Херши и М. Чейз (1952) было доказано, что носителем генетической информации является ДНК, а не белки, как считалось ранее. ДНК – высокополимерное соединение, содержащееся в ядрах клеток живых организмов, вместе с белками гистонами образуют вещество хромосом. Генетическая информация хранится в виде длинной последовательности нуклеотидов в молекуле ДНК. Каждый нуклеотид состоит из остатка фосфорной кислоты (Р), присоединенного по
Химическая формула РНК отличается от ДНК тем, что вместо тимина (Т) у молекулы ДНК в состав РНК входит урацил (У), а вместо дезоксирибозы – рибоза. Очень важно, что если нуклеотид на одном конце имеет Вплоть до 50-х годов ХХ в. точное строение ДНК, как и способ передачи наследственной информации, оставались неизвестными. Хотя и было известно, что ДНК состоит из нескольких цепочек, состоящих из нуклеотидов, но не было известно, сколько этих цепочек и как они соединены. Структура двойной спирали ДНК предложена Ф. Криком и Д. Уотсоном в 1953 г. на основании рентгеноструктурных данных, полученных М. Уилкинсом и Р. Франклин, и правил Чаргаффа. Согласно правилам Чаргаффа, установленным в начале 50-х годов Согласно модели Уотсона и Крика (1953), молекула ДНК состоит из двух правозакрученных вокруг общей оси спиралей (рисунок 125). Пары азотистых оснований расположены перпендикулярно оси молекулы, они «упрятаны» внутрь ДНК и не контактируют с водой. Последовательность азотистых оснований в цепи может быть совершенно произвольна. Но эти последовательности в одной молекуле ДНК связаны друг с другом принципом комплементарности, или дополнительности.
Это когда каждое основание на одной из цепей связывается с одним определенным основанием на второй цепи. Пурины комплементарны пиримидинам, то есть способны к образованию водородных связей с ними. Аденин образует связи только с тимином, а цитозин – с гуанином, поэтому в двойной спирали эти азотистые основания находятся друг против друга (рисунок 126).
Комплементарность двойной спирали означает, что информация, содержащаяся в одной цепи, содержится и в другой цепи. Обратимость и специфичность взаимодействий между комплементарными парами оснований важна для репликации ДНК и всех остальных функций ДНК в живых организмах. Если между атомами, образующими каркас полинуклеотидных цепей химические связи являются ковалентными, то между комплементарными цепями действуют сравнительно слабые взаимодействия, обусловленные водородными связями. Ковалентная связь обеспечивает стабильность и устойчивость ДНК, а водородные связи – ее гибкость и подвижность, поскольку они легко разрываются и восстанавливаются. Под действием ферментов или высокой температуры цепочки двойной спирали могут расходиться как замок-молния. Разные пары оснований образуют разное количество водородных связей. Было обнаружено, что гуанин с цитозином связаны тремя водородными связями, а аденин с тимином – двумя. Следовательно, на разрыв ГЦ связей требуется больше энергии, чем АТ связи. Части молекул ДНК, которые из-за их функций должны быть легко разделяемы, например, ТАТА последовательность в бактериальных промоторах обычно содержат большое число А и Т. Диаметр двойной спирали 2,2–2,4 нм, расстояние между соседними парами оснований вдоль спирали – 0,34 нм. Полный оборот двойная спираль делает через 10 пар. Длина зависит от того, какому организму ДНК принадлежит. Обычно размер молекулы ДНК определяется в тысячах пар нуклеотидов. ДНК простейших вирусов содержит всего несколько тысяч пар, бактерий – несколько миллионов, а высших организмов – миллиарды. Например, полный геном кишечной палочки (Е. coli) представлен единственной молекулой ДНК и содержит около
Другая проблема связана с репликацией столь длинных молекул. Две комплементарные нити, которые первоначально были закручены одна относительно другой, должны при репликации расплетаться сверху вниз (рисунок 127). Скорость расплетания должна была бы составлять 15000 оборотов в минуту. Это совершенно немыслимая скорость. Было установлено, что при репликации молекулы ДНК она сначала расщепляется во многих местах, так что наращивание второй молекулы идет одновременно по всей длине ДНК. Если выстроить в одну линию все молекулы ДНК, заключенные лишь в одной клетке человека, то получится нить длиной 2 м. Следовательно, длина этой нити в миллиард раз больше ее толщины и в миллион раз больше диаметра ядра клетки. Проблема упаковки молекулы ДНК в ядре решается природой следующим образом. Двойная спираль благодаря своей гибкости способна изгибаться и сворачиваться в клубок. При этом получается полимерный клубок диаметром 0,5 мм, который нужно локализовать в ядре, диаметр которого меньше микрометра. В клетках высших организмов эволюцией разработан специальный насильственный механизм изгибания двойной спирали. Молекула навивается, как нитка на катушку, на особый комплекс ядерных белков (гистонов). На каждой «катушке» молекула делает около двух оборотов, затем она переходит на следующую катушку и так далее. «Катушка» с намотанной на нее ДНК называется нуклеосомой, так что ДНК в ядре высших организмов – это ожерелье из нуклеосом. В свою очередь сами нуклеосомы очень сложным образом компактно уложены в особые тельца, называемые хромосомами. Кроме ядерной ДНК, эукариотические клетки содержат небольшое количество цитоплазматической ДНК, т.е. ДНК, которая располагается вне ядра – в цитоплазме. На долю внеядерной ДНК приходится около 0,1–0,2 % всей клеточной ДНК. Она находится в митохондриях и участвует в преобразовании энергии в клетке. Ген – это элементарная единица наследственности, представляющая собой опре-деленную специфическую последовательность нуклеотидов в ДНК. В 1969 г. был выделен отдельный ген из остальной части ДНК. Этот ген находится в ДНК кишечной палочки и служит для синтеза фермента, который помогает бактерии усваивать сахар, лактозу. Удалось также рассмотреть этот ген под электронным микроскопом. Его длина оказалась равной
В хромосомах диплоидных организмов гены расположены парами. Хромосома разделена на участки – локусы. Локус – это место расположения того или иного гена в хромосоме. Сам ген состоит из двух или нескольких аллелей. Аллель – это один или несколько вариантов гена, которые могут находиться в данном локусе хромосомы. Общее число генов в клетке высших организмов составляет около 100000. Каждому гену соответствует свой белок. Строение и функционирование живого организма определяется набором белков в нем. Живая природа для синтеза белков использует только 20 аминокислот. Этот набор из 20 аминокислот абсолютно одинаков, универсален для всей живой природы на Земле. Отличие живых существ друг от друга кроется в том, какие цепочки образуют аминокислоты. Ответ на главный вопрос биологии, чем же определяются последовательности аминокислот в белках, а значит, и многообразие живых существ, содержится в работах Уотсона и Крика. Аминокислотные последовательности всех белков клетки определяются последовательностью звеньев в одной из двух комплементарных цепочек ДНК. Рассмотрим генные механизмы синтеза РНК и белка, репарацию, репликацию и рекомбинацию ДНК. Транскрипция – это синтез РНК на ДНК-матрице. Генетическая информация, закодированная в ДНК, должна быть прочитана и в конечном итоге выражена в синтезе различных белков, из которых состоят клетки. Поскольку синтез белка происходит в цитоплазме, то для его осуществления одной ДНК недостаточно. Транскрипция является первым этапом реализации генетической информации в клетке, в процессе которого последовательность нуклеотидов соответствующего участка ДНК переписывается в нуклеотидную последовательность мРНК. В результате транскрипции происходит биосинтез молекулы информационной, или матричной, РНК (мРНК). В отличие от ДНК РНК представляет собой одиночную короткую цепочку. Копирование гена происходит по принципу комплементарности, только роль, ко-торую играет в ДНК тимин, в РНК играет урацил. Синтез РНК ведется по одной из
Транскрипция начинается на промоторе, представляющего собой нуклеотидную последовательность между генами, и заканчивается терминатором. РНК-полимераза, двигаясь вдоль нуклеотидной последовательности гена, снимает с него копию в виде молекулы РНК. Процесс копирования возможен только в том случае, если РНК-полимераза присоединится к промотору. Считается, что важную роль в узнавании РНК-полимеразой промотора играет последовательность ТАТААТ.
В ходе транскрипции цепь синтезируемой мРНК постепенно удлиняется. У терминатора синтез мРНК прекращается, после чего РНК-полимераза и мРНК отделяются друг от друга, а ДНК восстанавливает свою двуспиральную структуру. Синтез мРНК происходит в ядре клетки, которое она покидает через имеющиеся в нем поры и поступает в цитоплазму. Каждый ген синтезирует собственную информационную (матричную) РНК, которая с помощью рибосомы направляет синтез белка, кодируемый геном. На данном участке ДНК может быть синтезировано любое число мРНК, так что клетка получает множество одноцепочечных копий гена, работающих в качестве матриц для синтеза биополимеров. Сплайсинг. К концу 70-х годов было установлено, что ДНК наряду с кодирующими белок последовательностями нуклеотидов (экзонами) содержит некодирующие (интроны). При транскрипции мРНК переписывает как экзоны, так и интроны. Однако для синтеза белков интроны не нужны, они удаляются, и образуется мРНК, состоящая из одних экзо-нов. Процесс удаления интронов и объединения экзонов в мРНК называется сплайсингом (от анг. splice – сравнивание). Генетический код. Концепция генетического кода была выдвинута американским физиком Г. Гамовым в 1954 г. Несмотря на свою умозрительность, идею Гамова можно назвать одной из самых революционных идей в биологии. Суть идеи заключается в следующем: если информация о последовательности 20 аминокислотных остатков в белках записана в ДНК в виде последовательности четырех нуклеотидов, то должен существовать код, переводящий четырехбуквенный текст ДНК в двадцатибуквенный текст белков. При этом возник вопрос, что представляет собой генетический код и как он реализуется? Гамов предположил, что для кодирования одной аминокислоты используется последовательность трех нуклеотидов. Эта тройка нуклеотидов была названа кодоном, а сам код – триплетным. Триплетность кода связана с тем, что каждой из 20 аминокислот необходимо сопоставить свой кодон. Число возможных сочетаний из четырех нуклеотидов (А, Г, Ц, У) показывает, что сочетания по 2 образует лишь 42 = 16 кодонов, а из трех 43 = 64, а из четырех 44 = 256. Дуплетные кодоны не могут кодировать все 20 аминокислот, так как их число равно 16. С другой стороны, сочетания по 4 дают сильно избыточное число кодонов (256) для кодирования 20 аминокислот, что излишне расточительно для оптимально устроенной природы. Остается вариант с 64 триплетными кодонами. Гипотеза Гамова получила экспериментальное подтверждение в начале 60-х годов. 61 из 64 кодонов кодирует определенные аминокислоты, а три, так называемые стопкодоны (ТАА, ТГА, ТАГ), определяют окончание синтеза белковой молекулы. Генетический код является вырожденным, так как несколько кодонов могут кодировать одну и ту же аминокислоту. Кодоны мРНК и триплеты нуклеотидов кодирующей цепочки ДНК с направлением от
Расшифровка генетического кода, т.е. нахождение соответствия между кодоном и аминокислотами осуществлена американскими биологами М.У. Ниренбергом, С. Очоа и другими в 1961–1965 годах. Этот код помещен в таблице 12. Таблица 12
Аминокислоты: Ала – аланин; Арг – аргинин; Асн – аспаргин; Асп – аспарат; Цис – цистеин; Глу – глиталат; Глн – глутамин; Гли – глицин; Гис – гистидин; Илей – изо-лейцин; Лей – лейцин; Лиз – лизин; Мет – метионин; Фен – фенилалалин; Про – пролин; Трип – триптофан; Тир – тирозин; Вал – Валин; Сер – серин; Тре – треонин. В квадратной таблице первые нуклеотиды кодонов указаны слева, вторые – сверху, а третьи – справа. Символ Тер, обозначает терминирующие кодоны. Специальных иници-ирующих кодонов не существует. Эту роль в определенных условиях играют кодоны АУГ и ГУГ, обычно отвечающие аминокислотам метионину и валину. Синтез белка. Для синтеза полипептидной цепи необходимо большое количество компонентов, совместное и согласованное взаимодействие которых приводит к образованию белка. Все 20 аминокислот, входящих в структуру белков организма человека, должны присутствовать в достаточном количестве. Это требование, прежде всего, относится к незаменимым (т.е. не синтезирующимся в организме) аминокислотам, так как недостаточное снабжение клетки, хотя бы одной незаменимой аминокислотой, приводит к снижению, а иногда и полной остановке синтеза белка на кодоне, требующем включения этой аминокислоты в белок. Информационная (матричная) мРНК, образованная из триплетов нуклеотидов, кодирующих аминокислоты, направляется к рибосомам, где осуществляется синтез белка. Образование в клетке мРНК может обеспечить синтез необходимых для нее белков. Однако она еще не разрешает главного вопроса: каким образом генетическая информация переводится с «языка» нуклеотидов на «язык» аминокислот. В 1956 г. Ф. Крик высказал предположение, что эта проблема может быть решена с помощью специализированных молекул – адапторов (от лат. а daptere – приспособлять). Через год такие молекулы были обнаружены и названы транспортными тРНК. Транспортные РНК относятся к низкомолекулярным типам РНК, молекулярная масса которых коле-блется от 23000 до 30000, так как в составе тРНК находится от 75 до 90 рибонуклеотидов. На долю тРНК приходится около 10–15 % общего количества клеточной РНК. Основной функцией тРНК является транспорт аминокислоты на соответствующий участок мРНК, находящийся в рибосоме. Все известные последовательности оснований транспортных РНК обладают не только сходными функциями, но и имеют одинаковую конформацию в виде клеверного листа (рисунок 129). На
Рисунок 129
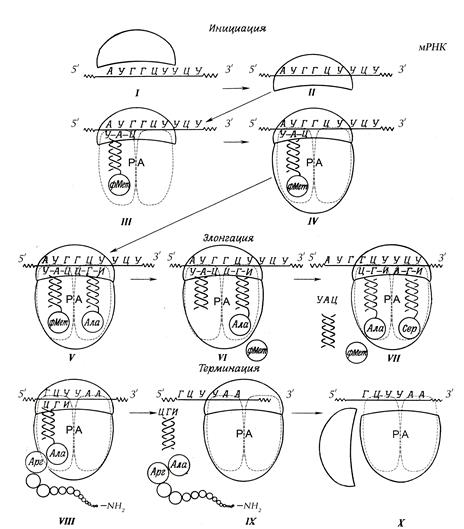
Кроме того, тРНК имеет еще петли, одна из которых обеспечивает связывание Каждый из ферментов этого семейства узнает только одну определенную аминокис-лоту и те тРНК, которые способны связываться с этой аминокислотой. Транспортируемая аминокислота под действием фермента, аминоацил-тРНК-синтетазы, активизируется и присоединяется к выходному концу молекулы тРНК. В результате такой реакции тРНК превращается в аминоацил-тРНК (см. рисунок 129), заканчивающаяся аминогруппой NH2. На осуществление этой реакции расходуется энергия АТФ участвующей в активации аминокислоты. Для каждой аминокислоты существует свой фермент – аминоацил-тРНК-синтетаза. Каждая тРНК способна переносить всего одну из 20 аминокислот. Следовательно, для каждой аминокислоты в клетке имеется, по крайней мере, одна специфическая тРНК. Для ряда аминокислот открыто более одной тРНК (для серина – 5, для лизина и глицина – по 4 разных тРНК). Таким образом, во всех клетках содержится набор тРНК, которых более двадцати. Энергия, заключенная в сложноэфирной связи аминоацил-тРНК, впоследствии используется на образование пептидной связи в ходе синтеза белка. Чрезвычайно высокая специфичность аа – тРНК синтетаз в связывании аминокислоты с соответствующими тРНК лежит в основе точности трансляции генетической информации. В активном центре этих ферментов есть 4 специфических участка для узнавания: аминокислоты, тРНК, АТФ и четвертый – для присоединения молекулы Н2О, которая участвует в гидролизе неправильных аминокислотных фрагментов. За счет существования в активном центре этих ферментов корректирующего механизма, обеспечивающего немедленное удаление ошибочно присоединенного аминокислотного остатка, достигается очень высокая точность синтеза: например, на 1300 связанных с тРНК аминокислот встречается только одна ошибка. Аминокислота, присоединяясь к тРНК, в дальнейшем не определяет специфических свойств аа – тРНК, так как ее структуру не узнает ни рибосома, ни мРНК. Участие в синтезе белка зависит только от структуры тРНК, а точнее, от комплементарного взаимодействия антикодона аминоацил – тРНК с кодоном мРНК. Молекулы тРНК подбирают в цитоплазме «свои» аминокислоты в соответствии с последовательностью нуклеотидов. Транспортная РНК готова к выполнению своей функции, когда к ней присоединена ее аминокислота под действием фермента. Фермент узнает одновременно аминокислоту и транспортную тРНК и соединяет их ковалентной связью. В действительности все обстоит значительно сложнее. Связано это с тем, что рибосома имеет только два участка для связывания двух молекул транспортной РНК. Поэтому удлинение (элонгация) белковой цепи происходит путем многократного повторения довольно сложного цикла. Устойчивость и цикличность придают синтезу белка участие в этих процессах рибосомы. Рибосома состоит из двух субчастиц – большой и малой. Малая субчастица примерно вдвое меньше большой и состоит из одной большой рРНК и двух десятков различных белков; большая субчастица – из двух молекул РНК и около 30 белков. В тельцах размером всего ~ 10 нм сосредоточено около 50 белков, что говорит о необычайной сложности процессов, протекающих в рибосоме при синтезе белков. Третий вид РНК – рибосомная (рРНК), синтезируется в ядре клетки путем комплементарного встраивания ее к определенным участкам ДНК, каждая из которых кодирует собственную рРНК. Процесс протекает с участием специфического фермента РНК-полимеразы. Рибосомная РНК выполняет исключительно важные биологические функции. В молекулах мРНК и рРНК имеются специфические комплементарные участки, за счет которых осуществляется первоначальное связывание мРНК с рибосомой. Еще одной важной функцией рРНК является формирование активного центра рибосо-мы, в котором происходит образование пептидных связей между молекулами аминокислот в процессе синтеза белка. Рассмотрим синтез белка, схематически показанный на рисунке 130.
Рисунок 130 Процесс инициации синтеза белка слагается из нескольких этапов (I–IV), каждый из которых протекает с участием ферментов. Сначала малая субчастица рибосомы, изображенная на рисунке в форме полумесяца, прикрепляется к информационной мРНК в том месте, где расположен инициирующий кодон (старт-кодон) АУГ (I), образуя с ней комплекс II. Особая инициаторная транспортная тРНКМет с присоединенной к ней специальной инициаторной аминокислотой метионином связывается с кодоном АУГ (III). В результате присоединения инициаторного комплекса к большой субчастице образуется полная рибосома (IV). Инициация окончена, и с метионина начинается процесс синтеза полипептидной цепи. В рибосоме имеется два смежных участка для присоединения двух тРНК: амино-ациловый (А) и пептидильный (Р) центры, в образовании которых участвуют обе субъ-единицы. Вместе центры А и Р включают участок мРНК, равный двум кодонам. В процессе трансляции центр А занимает аа – тРНК, строение которой определяет кодон, находящийся в области этого центра. В структуре этого кодона закодирована природа аминокислоты, которая будет включена в растущую полипептидную цепь. Центр Р занимает пептидил – тРНК, т.е. тРНК, связанная с пептидной цепочкой, которая уже синтезирована. По завершении инициации рибосома располагается на мРНК таким образом, что в V этап: процесс элонгации полипептидной цепи происходит в три этапа (V–VII) VI этап: с Р-центра метионин от пептидил тРНК переносится в А-центр, где аланин присоединяет к себе метионин с Р-центра, образуя с ним пептидную связь, а пептидил тРНК, выполнив свою функцию и став свободной, возвращается в цитоплазму клетки. VII этап: рибосома перемещается на кодон вправо, а новое соединение метионин- аланин перемещается из А-центра в Р-центр. Триплет УЦУ напротив А-центра кодирует новую аминокислоту – серин, которая немедленно доставляется аминоацил-тРНК на свободный А-центр. Начинается следующий цикл элонгации, в ходе которого на рибосоме повторяются вышеприведенные этапы. Второй цикл заканчивается присоединением к серину растущей полипептидной цепочки (метиониналанина). Повторение таких циклов по числу смысловых кодонов завершает весь процесс элонгации. VIII этап – терминация: присоединение аминокислот к растущей цепи белка прекращается, когда рибосома доходит до одного из трех терминирующих кодонов мРНК (УАА, УАР и ЦГА). Терминирующий кодон предписывает окончание синтеза, и в А участке не связывается никакая тРНК. При участии особого фермента полипептидная цепь и тРНК отделяются от рибосомы. Одна молекула мРНК может кодировать несколько белков, если синтезирован последний из них, то комплекс распадается на отдельные компоненты – мРНК и две субчастицы рибосомы. Они могут вновь объединиться, если произойдет инициация синтеза новой белковой молекулы. В процессе синтеза белка рибосома присоединяется к Каждая рибосома занимает на мРНК участок длиной около 80 нуклеотидов, поэтому, чем длиннее полипептидная цепочка синтезируемого белка, тем больше рибосом может одновременно осуществлять синтез этого белка, значительно увеличивая, таким образом, эффективность использования матрицы. Каждая рибосома способна катализировать образование 100 пептидных связей в минуту. Репликация ДНК. Важнейшими признаками живого организма является его рост и размножение, которые невозможно представить без деления клеток. План построения и функционирования каждого живого существа заключен в ядре одной-единственной клетки, в ее молекуле ДНК. Любая специализированная клетка целого организма знает, как устроен весь организм. При этом их генетическое содержание копируется в потомках. В основе передачи наследственной информации от клетки к клетке, от организма к организму лежит репликация ДНК. Репликация (от лат. replication – повторение) – это удвоение двуспиральной молекулы ДНК при участии ферментов, т.е. образование дочерних ДНК, аналогичных материнским. Информация о репликации ДНК содержится в ней самой. Как указывалось ранее, ДНК упакована в ядре клетки, и чтобы начался процесс репликации, необходимо ее, прежде всего, расщепить. Функцию расплетания молекулы ДНК выполняют специализированные белки, так называемые ДНК-геликазы. В расщеплении ДНК участвует также фермент ДНК-полимераза, открытый в 1956 году А. Корнбергом. Структурно две комплементарные цепи ДНК ориентированы противоположно друг другу (рисунок 131а). Поэтому при удвоении молекулы синтез новых цепей также должен идти в разных направлениях.

Рисунок 131
Для этого необходимо, чтобы перед репликацией цепи родительской молекулы полностью разъединились (см. рисунок 131а). Однако в действительности новые цепи строятся одновременно с разъединением двух старых цепей. Если бы синтез новых цепей начинался одновременно со свободных концов репликативной вилки (рисунок 131б), то для этого потребовалось бы два фермента, осуществляющих синтез в противоположных направлениях (по отношению к ее структуре). Однако нуклеиновые кислоты синтезируются ДНК-полимеразой и только в направлении Ферменты раскручивают определенный участок ДНК с образованием так называ-емой репликативной вилки (см. рисунок 131в), каждая ножка которой представляет собой последовательность нуклеотидов, соединяющих азотистые основания (А, Т, Т, Ц). Открытость и доступность азотистых оснований превращает ножки репликативной вилки в матрицы для синтеза двух новых цепей ДНК путем комплементарного спаривания оснований. Путь информации, связанный с синтезом белка, можно представить формулой:
Эту формулу называют центральной догмой биологии. Она означает, что информация, содержащаяся в ДНК, направляет синтез новой ДНК и РНК, а информация, содержащаяся в РНК, направляет синтез белка. Этот путь передачи информации представляет собой биохимическую основу жизни. Воздействие различных излучений, химических веществ, тепла и многих других факторов вызывает нарушения в генетическом аппарате живых организмов. Особенно губительны для молекулы ДНК ультрафиолетовые лучи. Квант ультрафиолетового излучения, попадая в ДНК, передает свою энергию азотистому основанию, которое переходит в возбужденное состояние. Далее возможны различные сценарии развития событий. Если фотон поглощен аденином, гуанином или цитозином, то ничего особенного не произойдет. Поглощенная энергия в этом случае быстро превратится в тепло, а ДНК останется невредимой. Однако если фотон поглотится тимином, причем не любым, а тем, который соседствует в цепи с другим тимином. В этом случае поглощенная энергия не успевает еще превратиться в тепло, как два соседних тимина вступают в химическую связь. В результате образуется новое химическое соединение, называемое фотодимером тимина (Т – Т). В ДНК возникло повреждение – вместо двух тиминов образовалось совершенно новое химическое соединение. Подобное повреждение нарушает репликацию ДНК: ферменты, дойдя до фотодимера тимина остановятся, так как в генетическом коде такого соединения не значится. Невозможно также будет снять с ДНК информацию для синтеза мРНК, что ведет к прекращению синтеза белка. Все это приводит к гибели клетки, а возможно, и всего организма. В процессе эволюции клетка выработала специальную репарирующую систему для устранения повреждений различными физическими и химическими факторами. Сначала фермент УФ-эндонуклеаза узнает тиминовый димер и рвет в этом месте сахарофосфатную цепь. Далее фермент расширяет возникший разрыв. В одной из нитей ДНК, там, где образовался тиминовый димер, получается брешь в несколько тысяч нуклеотидов. При этом оказываются удаленными не только тиминовый димер, но большое число нормальных нуклеотидов (во избежание ошибки). Поскольку другая комплементарная нить остается целой и по ней специальный фермент, ДНК-полимераза Корнберга, надстраивает вторую цепь, создавая нормальную двойную спираль, идентичную исходной, неповрежденной ДНК. Репарирующие системы имеют все клетки. Биосинтез белков, протекающий под генетическим контролем, – это только начало сложных многоступенчатых биохимических процессов в клетке. В любом организме содержатся дифференцированные клетки с определенной формой и функцией. Такими являются, например, клетки нервные, мышечные, половые и т.д. Каждая клетка организма содержит всю генетическую информацию в виде набора генов, полученных от родителей. Однако в зависимости от специализации клеток функционируют лишь определенные гены, остальные находятся в неактивном состоянии и в развитии клетки участия не принимают. Во всех процессах жизнедеятельности клетки принимают участие ферменты. В каждой клетке (с ее характерными функциями) имеются регуляторные механизмы, контролирующие качественный и количественный состав ферментов. В противном случае беспрерывно синтезируемые макромолекулы белков накапливались бы в клетке в избыточном количестве, загромождая ее. Ф. Жакоб и Ж. Моно доказали, что не все гены одинаковы по назначению. Одна группа – структурные гены, выдающие информацию о синтезе определенных полипеп-тидных цепей, другая – регуляторные гены, управляющие активностью структурных генов путем «включения» и «выключения». Управляющие гены представлены геном-оператором, непосредственно сцепленным с группой структурных генов, и геном-регулятором, который кодирует синтез специфи-ческого белка-репрессора. Ген-оператор, с группой регулируемых им структурных генов, получил название оперон. Оперон служит единицей транскрипции, то есть с него списывается одна молекула мРНК. Ген регулятор действует не путем непосредственного контакта со структурными генами, а при помощи репрессора. При наличии достаточно накопившихся молекул синтезируемого вещества репрессор, соединяясь с этими молекулами, активизируется и связывается с геном-оператором. В результате синтез данного вещества прекращается. Свое название белок-репрессор получил из-за того, что подавляет деятельность гена-оператора, то есть ставит его в положение «выключено». При малом количестве синтезируемых молекул репрессор остается неактивным. В таких условиях действие оперона не подавляется, и синтез белка будет продолжаться.
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 125; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.15.1 (0.049 с.) |
 положению к сахару – дезокси-
положению к сахару – дезокси- положению присоединено одно из четырех азотистых оснований: А (аденин), Г (гуанин), Т (тимин) и Ц (цитозин).
положению присоединено одно из четырех азотистых оснований: А (аденин), Г (гуанин), Т (тимин) и Ц (цитозин).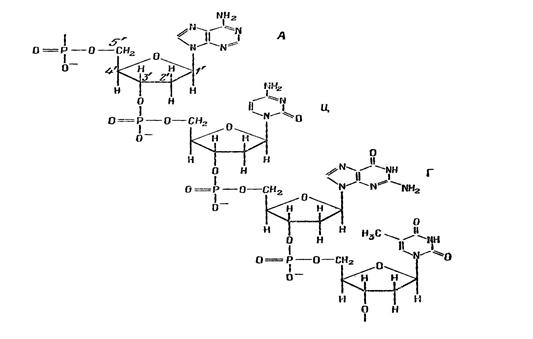
 -группу. Таким образом, тексты макромолекул ДНК (и РНК) записаны в четырехбуквенном алфавите.
-группу. Таким образом, тексты макромолекул ДНК (и РНК) записаны в четырехбуквенном алфавите. Рисунок 125
Рисунок 125
 Рисунок 126
Рисунок 126
 т.п.н., длина ее 1,4 мм заключена в клетку
т.п.н., длина ее 1,4 мм заключена в клетку  мкм. Длина молекулы ДНК достигает сотен тысяч нанометров. Это намного больше самой крупной белковой молекулы, которая в развернутом виде достигает длину не более 100–200 нм. Как же она все-таки умещается в ядре клетки? Причем уложить ее надо так, чтобы ДНК была доступной по всей длине для белков, например, для РНК-полимеразы, считывающей нужные гены.
мкм. Длина молекулы ДНК достигает сотен тысяч нанометров. Это намного больше самой крупной белковой молекулы, которая в развернутом виде достигает длину не более 100–200 нм. Как же она все-таки умещается в ядре клетки? Причем уложить ее надо так, чтобы ДНК была доступной по всей длине для белков, например, для РНК-полимеразы, считывающей нужные гены. м, и состоит он из 4700 пар нуклеотидов. Таким образом, по мере развития молекулярной биологии понятие классической генетики, ген – «элементарная частица» наследственности, приобрела совершенно конкретный молекулярный смысл. Оказалось, что ген – это не «неделимая частица», как полагали раньше, а участок ДНК, состоящий из сотен и тысяч нуклеотидов.
м, и состоит он из 4700 пар нуклеотидов. Таким образом, по мере развития молекулярной биологии понятие классической генетики, ген – «элементарная частица» наследственности, приобрела совершенно конкретный молекулярный смысл. Оказалось, что ген – это не «неделимая частица», как полагали раньше, а участок ДНК, состоящий из сотен и тысяч нуклеотидов. Рисунок 127
Рисунок 127
 Рисунок 128
Рисунок 128


 . Поэтому синтез новой ДНК осуществляется так: одна из новых цепей синтезируется непрерывно, тогда как синтез другой новой цепи осуществляется в том же направлении
. Поэтому синтез новой ДНК осуществляется так: одна из новых цепей синтезируется непрерывно, тогда как синтез другой новой цепи осуществляется в том же направлении 
 ДНК
ДНК  РНК
РНК 




