
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие о термодинамическом процессе. Виды процессов (равновесные и неравновесные, обратимые и необратимые).
ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС (или просто ПРОЦЕСС) – это переход системы (газа) из одного состояния в другое в результате ее взаимодействия с окружающей средой. Напомним: КАЖДОЕ СОСТОЯНИЕ газа ХАРАКТЕРИЗУЕТСЯ тремя параметрами состояния: абсолютное давление (р), абсолютная температура (T) и удельный объем (v). РАВНОВЕСНЫЕ И НЕРАВНОВЕСНЫЕ, а также ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ РАВНОВЕСНОЕ СОСТОЯНИЕ системы (газа) – это состояние системы (газа) при котором каждый из параметров состояния (р, v, T) имеет одинаковые значения во всех ее точках. В противном случае будет НЕРАВНОВЕСНОЕ СОСТОЯНИЕ. В равновесном состоянии может находиться только ЗАМКНУТАЯ (ЗАКРЫТАЯ) СИСТЕМА, т.е. система, которая не обменивается веществом с окружающей средой. Переход от неравновесного состояния к равновесному называется ВРЕМЕНЕМ РЕЛАКСАЦИИ. РАВНОВЕСНЫЙ ПРОЦЕСС – это процесс, в котором система (газ) проходит через равновесные состояния. Если состояния неравновесны, то будет НЕРАВНОВЕСНЫЙ ПРОЦЕСС. Все равновесные процессы являются ОБРАТИМЫМИ ПРОЦЕССАМИ, т.е. при протекании равновесного процесса в обратном направлении, система (газ) будет проходить в обратной последовательности те же равновесные состояния и приходить в исходное состояние. В противном случае мы имеем НЕОБРАТИМЫЙ ПРОЦЕСС. Основные условия обратимости процесса: - время перехода от одного равновесного состояния к другому больше времени релаксации (т.е. параметры успевают выравниться по всему объему); - обмен теплотой между системой и окружающей средой происходит при бесконечно малой разности температур. ! В термодинамике рассматриваются обратимые процессы. Все реальные процессы необратимы. Политропный процесс: уравнение процесса, формулы соотношения между параметрами, изменение энергетических составляющих, перераспределение энергии в процессе. Политропным называется процесс при неизменной теплоемкости с. При условии независимости изохорной теплоемкости от температуры в политропном процессе остается неизменным и распределение подведенной теплоты на изменение внутренней энергии рабочего тела и совершение работы: Характерные политропные процессы: изотермный (T=const),
адиабатный ( Уравнения процессов Политропный процесс:
Частные случаи политропного процесса: изохорный, изобарный, изотермический, адиабатный процессы (уравнения процессов, формулы соотношения между параметрами, изменение энергетических составляющих, перераспределение энергии в процессах).
Изохорный процесс: уравнение процесса теплоемкость процесса Изобарный процесс: уравнение процесса Изотермический процесс: уравнение процесса Адиабатный процесс: уравнение процесса получается из уравнения первого закона термодинамики при dq=0:
уравнение процесса
|
|||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 143; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.41.87 (0.009 с.) |

 const;
const;  const;
const; 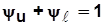 , где
, где  - коэффициент разветвления теплоты.
- коэффициент разветвления теплоты. ), при условии
), при условии  – изохорный (v=const) и изобарный (p=const).
– изохорный (v=const) и изобарный (p=const).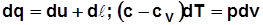 ; с учетом
; с учетом 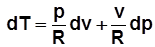
 ;
; ;
; ;
; ;
;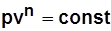 - уравнение процесса; (3.1)
- уравнение процесса; (3.1)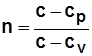 - показатель политропы; (3.2)
- показатель политропы; (3.2) - теплоемкость политропного процесса. (3.3)
- теплоемкость политропного процесса. (3.3)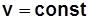 получается из уравнения политропного процесса
получается из уравнения политропного процесса  при n= ± ¥;
при n= ± ¥;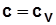 .
. получается из уравнения
получается из уравнения  .
. или
или  получается из уравнения
получается из уравнения  .
.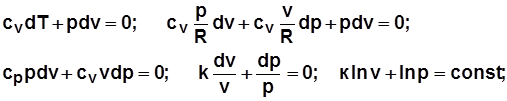
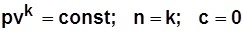 .
.


